4种病原菌“单管一步法”PCR快速检测方法的建立
潘雅君, 徐汪节, 彭丽娜, 乔中东, 王朝霞
(上海交通大学a.实验动物中心;b.生命科学技术学院,上海 200240)
0 引 言
对实验动物定期进行微生物检测是实验动物质量控制中非常重要的环节[1-3]。肺炎克雷伯杆菌(KlebsiellɑPneumoniɑe,K.pneumoniɑe)、金黄色葡萄球菌(Stɑphylococcusɑureus,S.ɑureus)、嗜肺巴斯德杆菌(Pɑsteurellɑpneumotropicɑ,P.pneumotropicɑ)和绿脓杆菌(Pseudomonɑsɑeruginosɑ,P.ɑeruginosɑ)是SPF级实验小鼠必须检测和排除的项目[4]。这4种病原菌均属于条件性致病菌,在动物免疫功能低下等特定情况下引起感染,对于免疫系统受损的宿主影响较大,常表现为感染、炎症甚至死亡[5-7]。从近年来国内外实验动物质量监测结果可以看出,这4种病原菌在实验小鼠中的感染率较高[8-12],严重影响实验动物质量,干扰试验结果。
中国实验动物微生物学检测方法(GB14926)针对上述4种细菌推荐的检测方法主要为分离培养和生化鉴定。但该方法通常需要3~7 d,操作烦琐,费时费力,也不适用于无法培养的微生物,检测周期较长,对检测人员专业技能要求较高[13-16],不适用于对这4种细菌同时进行简便、快速检测。
近年来,分子检测方法如质谱(MS),聚合酶链反应(PCR),环介导等温扩增(LAMP),高通量下一代测序(NGS)等迅速发展[14,17-18]。PCR方法可以快速准确检测样品中的微生物,在此基础上发展的多重PCR可以使用多对特异性引物同时检测样本中的多种病原体,但由于样本中待检测病原体的含量较低以及多种引物的干扰,往往导致一些非特异性片段在经过30个PCR循环后出现条带,影响检测的准确性[19-20]。
本文设计了一种基于16S rDNA序列的检测思路,能够通过一步PCR反应同时检测多种实验动物病原体。为避免多重PCR的缺点,将16S rDNA保守区的富集和16SrDNA特异性可变区检测这两个步骤整合为一步反应,并选择了肺炎克雷伯杆菌、金黄色葡萄球菌、嗜肺巴斯德杆菌和绿脓杆菌进行检测验证。结果表明多重巢式PCR(MN-PCR)方法灵敏度更高,在临床样本检测中比多重PCR更加简便,节省了时间和劳力。
1 材料与方法
1.1 实验材料
(1)菌株。金黄色葡萄球菌(ATCC 6538)、肺炎克雷伯杆菌(ATCC 46117)、表皮葡萄球菌(ATCC 12228)购自广东省微生物菌种保藏中心。绿脓杆菌、嗜肺巴斯德杆菌由本实验室分离保存。多杀巴斯德杆菌(ATCC 12945)基因组DNA、肺炎链球菌(ATCC 49619)、鼠伤寒沙门氏菌(SL1344)、大肠杆菌(CMCC 44102)由中国农业科学院上海兽医研究所惠赠。
(2)实验动物临床检测样本。选取了4个经第三方检测机构检测结果分别为肺炎克雷伯杆菌阳性,金黄色葡萄球菌阳性,嗜肺巴斯德杆菌阳性,绿脓杆菌阳性的小鼠咽拭子样本。同时选取了39只不确定是否有细菌感染的待生物净化小鼠,饲养在隔离包中,采集咽拭子样本。
(3)引物。本研究中设计了一对通用引物:Universal Primers-F,Universal Primers-R(UP-F,UPR)和4对特异引物:K.pneumoniɑe-F,K.pneumoniɑe-R(KP-F,KP-R),S.ɑureus-F,S.ɑureus-R(SA-F,SA-R),P.pneumotropicɑ-F,P.pneumotropicɑ-R(PPF,PP-R),P.ɑeruginosɑ-F,P.ɑeruginosɑ-R(PA-F,PA-R)(表1)。引物由生工生物工程(上海)股份有限公司合成。
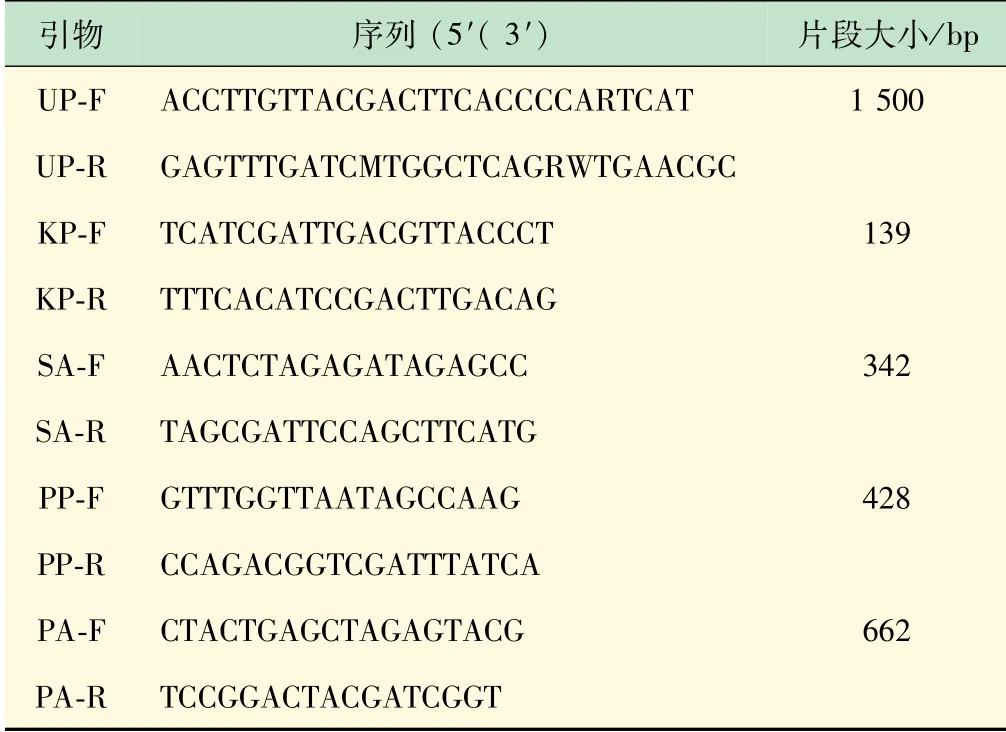
表1 引物序列
(4)主要试剂。羊血琼脂平皿购自上海伊华医学科技有限公司;营养肉汤培养基购自杭州滨河微生物试剂有限公司;细菌基因组DNA快速提取试剂盒,琼脂糖凝胶回收试剂盒和PCR纯化试剂盒均购自生工生物工程(上海)股份有限公司;100 bp DNA Ladder购自宝日医生物技术(北京)有限公司;2×ES Taq Master Mix(Dye)购自北京康为世纪生物科技有限公司;琼脂糖和SYBR safe核酸染料购自英潍捷基(上海)贸易有限公司。
1.2 实验方法
(1)细菌基因组DNA提取。将所有菌株分别划线接种于血琼脂平皿,37℃培养24 h后挑取单菌落,接种于5 mL液体营养肉汤培养基,37℃有氧条件下振荡培养18~24 h,取1 mL菌液,严格按照细菌基因组DNA提取试剂盒说明书操作,提取DNA模板于-20℃用于后续PCR检测。通过细菌基因组DNA快速分离试剂盒提取模板DNA。
(2)实验动物咽拭子样本处理。采集小鼠的咽拭子样本并将其浸入1.5 mL无菌水中10 min,对咽拭子进行吹打悬浮后分为两部分进行处理:将其中750μL接种培养按照1.2.(1)步骤提取基因组DNA;将剩余750μL在8 000 r/min下离心2 min,除去上清,加入15μL TE(Tris+EDTA)缓冲液并充分混合作为PCR模板。
(3)MN-PCR方法特异性检测。反应体系为20 μL,包括:2×ES Taq Master Mix(Dye)10μL;引物UP-F,UP-R各0.01μmol/L;特异性引物(KP-F,KPR,SA-F,SA-R,PP-F,PP-R,PA-F和PA-R)各0.15 μmol/L;模板DNA各1 ng。
鹿科属于偶蹄目,大多数雄鹿都长有角,这是雄性的象征。生活在北方的鹿,鹿角会在繁殖季节过后脱落,第二年再生出新的角。初长的角叫作“茸”,外面包裹着皮肤,角上有一层细细的绒毛,还有血管为新生的角大量供血。随着鹿角慢慢长大,供血会逐渐停止,鹿角随之干枯脱落。1—2岁小鹿的角是直直的,鹿角的分叉会随着它们年龄的增长而增多,直到成年才会定型。
反应条件:95℃预变性5 min;94℃变性30 s,65℃退火30 s,72℃延伸30 s,进行15个循环;94℃变性30 s,55℃退火30 s,72℃延伸30 s,进行25个循环;最后72℃延伸10 min。
PCR扩增产物经2%琼脂糖凝胶电泳检测分析。
(4)MN-PCR方法在4种病原体检测中的灵敏度。MN-PCR反应体系为20μL,模板DNA在体系中的终含量分别为:1 pg,100 fg,10 fg,1 fg,10-1fg,10-2fg,10-3fg,10-4fg,体系中其他参数同1.2.(3)中所述。反应条件同1.2.(3)中所述。
普通多重PCR反应体系为20μL,包括:2×ES Taq Master Mix(Dye)10μL,特异性引物(KP-F,KPR,SA-F,SA-R,PP-F,PP-R,PA-F和PA-R)各0.15 μmol/L,模板DNA终浓度同上。反应条件:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,进行30个循环;72℃延伸10 min。
PCR扩增产物经2%琼脂糖凝胶电泳检测分析。
2 结 果
2.1 MN-PCR方法在4种病原体检测中的特异性
以实验动物微生物检测中的一些常见细菌和相近菌株作为阴性对照来验证MN-PCR方法检测的特异性,包括:肺炎链球菌,表皮葡萄球菌,多杀巴斯德杆菌,鼠伤寒沙门氏菌和大肠杆菌。结果表明,设计的4种特异性引物均能准确扩增出预期的目的条带,而无法以对照细菌基因组DNA为模板扩增出其他DNA条带,有较好的特异性(见图1)。
2.2 普通多重PCR与MN-PCR方法检测单模板灵敏度比较
对MN-PCR和普通多重PCR方法的灵敏度进行比较。结果表明,在检测单种细菌时2种方法的灵敏度有很大的差异,MN-PCR的灵敏度比普通多重PCR方法高10~100倍(见图2)。

图1 MN-PCR检测方法的特异性
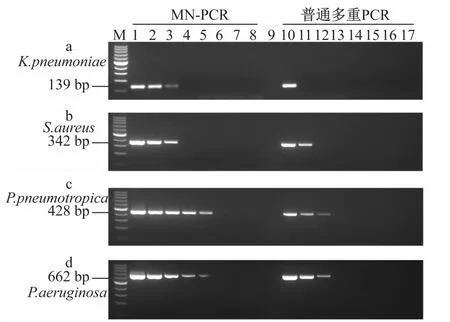
图2 MN-PCR和普通多重PCR方法在单模板检测中的灵敏度比较
2.3 MN-PCR方法对4种病原体的多重检测能力
根据MN-PCR优化条件,将4种待测细菌的基因组DNA按照:单细菌基因组,两两细菌混合基因组,三三细菌组合基因组以及四种细菌基因组,分别作为MN-PCR模板,验证了该方法的多重检测能力。结果表明,单一模板和多种模板的PCR产物条带均清晰可辨(见图3)。
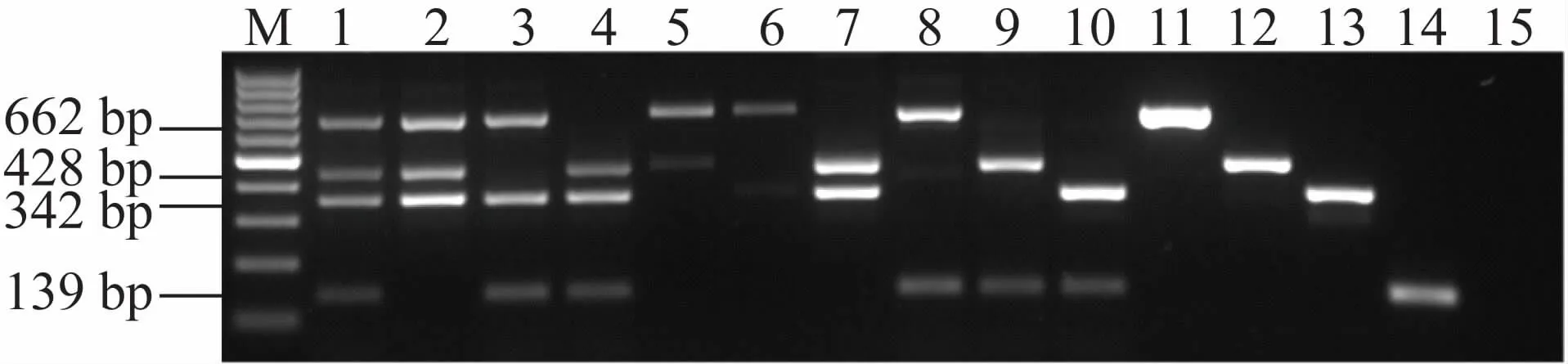
图3 通过MN-PCR检测四种细菌
2.4 MN-PCR方法同时检测4种病原体的灵敏度
验证了MN-PCR方法和多重PCR方法在同时检测4种病原体时的灵敏度。结果表明,利用MN-PCR方法可以同时检测出4种细菌的特异性条带,灵敏度为10 fg,而多重PCR无法同时检测出4种细菌(见图4)。

图4 MN-PCR和多重PCR方法在多种混合模板检测中的灵敏度比较
2.5 MN-PCR方法在临床样本检测中的应用
为了评估该方法在实际样本检测过程中的应用效果,选择了部分确定阳性的临床样本,以及未知待检39临床样本(样品来源于39只待生物净化小鼠),分别利用MN-PCR和多重PCR方法进行了检测,已确定阳性样本检测结果如图5所示,与已知确认阳性一致。同时,为了验证在某些极端情况下如SPF小鼠同时感染多种细菌时,MN-PCR方法是否能够同时检测临床样本中多种微生物,混合临床样本进行MN-PCR方法检测。结果显示,MN-PCR方法能够同时扩增出2种细菌的目的条带(图5(a)~(d)),而传统的多重PCR在以未经培养的低模板浓度下无法扩增出目的条带(图5(e))。
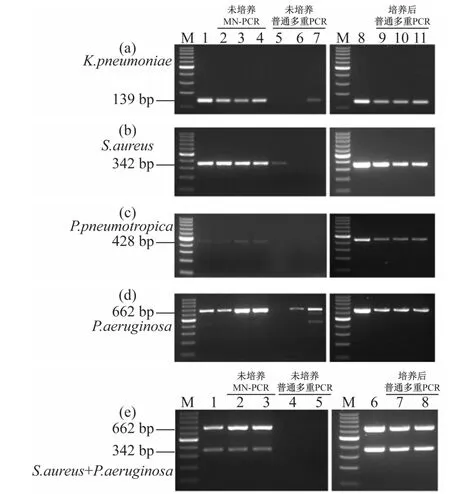
图5 利用MN-PCR方法对临床样本进行检测
未知待检的39份临床样本检测结果如表2所示,MN-PCR在对未经培养的临床样本进行检测时检出率高于普通PCR方法,且与培养后PCR验证结果相同。
3 讨 论
微生物检测在非常多的领域都发挥着重要的作用。传统的检测方法如对样本进行培养,对可疑菌落进行分离纯化和生化鉴定的操作费时费力,难以应用于常规的大规模检测。近年来,微生物检测的方法也在不断创新,PCR技术的不断进步推动其在微生物检测中的应用越来越广。
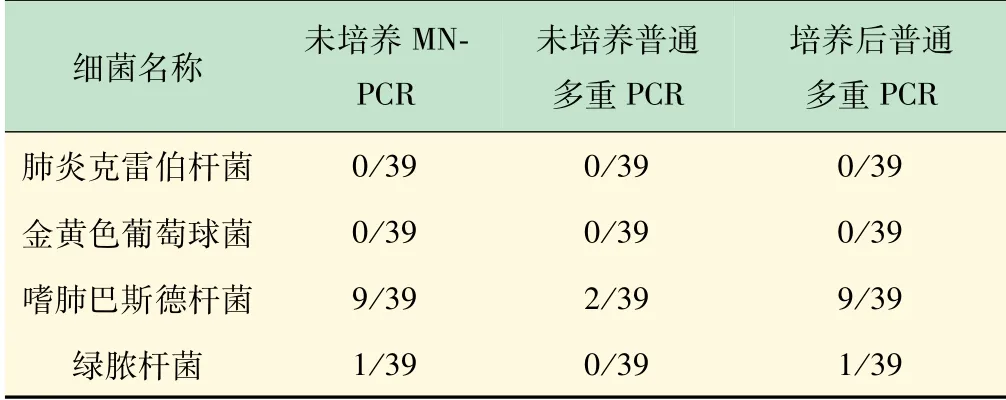
表2 不同方法对39份临床样本中4种病原菌的检出率
多重PCR可以同时扩增多个DNA片段,通常用于检测样本中的多种微生物,可以节省大量时间和精力,已被成功应用于许多领域的微生物检测中。但普通多重PCR很容易出现特异性和多重性检测的矛盾。
为了克服普通多重PCR方法上述不足,在MNPCR方法中整合巢式PCR和多重PCR的优点,来确保扩增检测的高灵敏度和特异性。以肺炎克雷伯杆菌、金黄色葡萄球菌、嗜肺巴斯德杆菌和绿脓杆菌4种实验动物设施常见细菌为例,在其16srDNA保守区内设计了一对通用引物并使用简并碱基来避免差异位点的扩增偏好,在首轮PCR中扩增富集待测细菌的16srDNA全长序列,后续基于每种细菌16srDNA序列的可变区设计特异性检测引物以扩增不同片段长度的检测产物(见图6)。同时,为了将16srDNA序列保守区域的富集和特异区域的扩增整合为一步PCR,实现快速、灵敏,同时检测多种微生物,采用如下设计策略:利用通用引物及特异性引物长度差异达到两阶段PCR退火温度高低不同;控制通用引物及特异性引物浓度的高低,使得低浓度通用引物既可以发挥作用且产物(1 500 bp片段)在电泳凝胶中不显示条带,从而在富集16srDNA序列片段的同时不会干扰第2阶段的特异性扩增;此外,对两个PCR阶段的循环数进行了优化来确定最终的反应条件及体系。

图6 MN-PCR整体效果示意图
在实际临床样本的检测中,粪便或咽拭子样本中微生物种类非常复杂,包含细菌、病毒和其他物质等。由于样品中待检测细菌含量低和存在杂质的影响,通常很难直接作为PCR检测的模板。普通多重PCR方法通常需要较高的模板浓度,在检测前需要对微生物进行培养富集,这是一个费时费力的过程,并且会增加污染的可能性从而导致潜在的假阳性。而MN-PCR方法由于具有较高的灵敏度,无需培养富集即可直接对样本中的微量细菌进行检测。与培养后的临床样本检测结果相比,MN-PCR方法具有较好的准确性,大大缩短检测时间和成本,减少了工作量,做到快速准确。因此,NM-PCR方法可以快速大量检测临床样本,在环境水源、临床诊断、食品等领域的微生物检测中具有非常广泛的应用前景。
实践告诉我们,伟大事业都成于实干。新时代是奋斗者的时代。新时代是在奋斗中成就伟业、造就人才的时代。我们要激励更多科学大家、领军人才、青年才俊和创新团队勇立潮头、锐意进取,以实干创造新业绩,在推进伟大事业中实现人生价值,不断为实现中华民族伟大复兴的中国梦奠定更为坚实的基础、作出新的更大的贡献。
——2019年2月20日,习近平在会见探月工程嫦娥四号任务参研参试人员代表时讲话

