香蕉枯萎病拮抗放线菌的分离鉴定及抑菌机理分析
张惠茜,王 尉,周登博,云天艳,陈宇丰,谢江辉
(1 海南大学园艺学院,海口,570228;2 中国热带农业科学院热带生物技术研究所,海口,571101)
香蕉(Musaspp.)属于芭蕉科(Musaceae)、芭蕉属(Musa)单子叶植物,是重要的果粮兼用作物。我国是世界香蕉第一大消费国和第二大生产国,主要栽培香蕉品系为“香芽蕉”(Cavendish,AAA)[1]。香蕉枯萎病是由尖孢镰刀菌古巴专化型Fusariumoxysporumf. sp.cubense(简称Foc),引起的维管束病害,为害我国香蕉种植区的主要为4号生理小种(Foc 4),该小种侵染几乎所有香蕉品种[2]。目前,尚未培育出农艺性状较好的抗病品种,对于香蕉枯萎病的控制仍以传统化学农药为主,而此方法不仅污染环境,还会诱发病原菌产生抗药性[3]。利用生防菌进行微生物防治,不仅能克服化学防治带来的副作用,还能维持土壤菌群平衡。
当前,用于防治香蕉枯萎病的生防菌有芽孢杆菌、木霉和放线菌三大类。杨迪等从广西蕉园土壤中分离出1株贝莱斯芽孢杆菌Blz02,对香蕉枯萎病的盆栽防效达到63.33%[4]。郭立佳等从香蕉根系土壤中分离出1株芽孢杆菌JK05,对香蕉枯萎病的盆栽防效达到了70.5%[5]。覃柳燕等从香蕉根系土壤中分离得到1株棘孢木霉PZ6,对香蕉枯萎病的盆栽防效为48.28%[6-7]。Jing等从健康的香蕉园中分离出1株放线菌JBS5-6,对香蕉枯萎病的防效达到64.94%[8]。尽管发现了一些具有作用的拮抗菌,但是不同生防菌的生长状态及大田应用效果仍有待评价,因此,分离和鉴定高效拮抗菌仍是未来生防的重要课题。
本研究以Foc 4为靶标菌,从尖峰岭国家森林公园润楠根系土壤中分离得到1株具有良好拮抗作用的链霉菌JRGG-11;通过表型分析和16S rRNA聚类分析对JRGG-11的种属进行鉴定;盆栽试验进一步明确该菌防效,并对其抑菌机理进行了分析,研究结果有利于丰富香蕉枯萎病菌拮抗微生物资源库,开发生物菌肥。
1 材料与方法
1.1 材料
拮抗菌株分离材料:海南省尖峰岭国家森林公园1株润楠Machiluspingii的根际土壤。
供试培养基:腐殖酸—维生素琼脂培养基(HV)、葡萄糖—天冬氨酸培养基(GA)、淀粉—酪蛋白培养基(SIM)、淀粉酪素琼脂培养基(SCA)、酵母膏麦芽膏培养基(YE/ISP2)、马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖肉汤(PDB)、黄豆粉发酵培养基(SLM)。
供试病原菌:香蕉枯萎病菌4号生理小种(Foc 4)保存于中国热带农业科学院热带生物技术研究所/海南省热带微生物资源重点实验室。
植物材料:6~7叶巴西蕉(Musaspp.,AAA)杯苗,种植用土取自海南省儋州市健康香蕉园。
1.2 拮抗放线菌的分离筛选
土样自然风干,充分研磨后过60目筛,称取样品5 g,溶于45 mL无菌水,55 ℃加热20 min,28 ℃、180 r/min培养1 h。用无菌水稀释为终浓度10-1、10-2、10-3的土壤悬浮液,分别吸取稀释液0.15 mL涂布于分离培养基(HV、GA、SIM、SCA)上,28 ℃培养7 d,取不同单菌落于YE培养基上纯化[9]。
拮抗菌株初筛:采用平板对峙培养法[10]筛选Foc 4拮抗放线菌,十字交叉法测量菌落直径,计算抑菌率。抑菌率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-5) ×100,菌落直径单位为mm。
拮抗菌株复筛:将纯化后的放线菌接种到SLM中,28 ℃、180 r/min摇床上培养7 d,得到发酵液,加入与发酵液等量的95%乙醇萃取2 d,过滤菌体,得到发酵液萃取液,旋转蒸发仪蒸干,无菌水稀释至终浓度20 mg/mL。用琼脂孔洞扩散法[11]测定放线菌发酵液对Foc 4抑菌活性,十字交叉法测定抑菌率。
1.3 拮抗放线菌的分类鉴定
参考徐丽华等方法进行生理生化鉴定[12]。取YE培养基上生长良好的菌落,参照张文娟[13]的方法进行扫描电镜样品处理,通过扫描电镜观察放线菌菌丝和孢子的形态。采用北京BioTeke生物技术有限公司的细菌基因组DNA快速提取试剂盒分离总DNA。细菌鉴定通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT- 3′)用于PCR扩增,PCR产物送至上海生工生物公司测序。GenBank和EzBioCloud数据库用于同源性比对,使用MEGA 7.0中的Neighbor-Joining法构建系统发育树。
1.4 盆栽试验
将带有GFP荧光的Foc 4孢子液接种至PDB培养基中,28 ℃、180 r/min摇菌3 d,用4层纱布过滤得到孢子悬浮液,于10 000 r/min室温离心,无菌水洗去培养基,制备成106CFU/mL病原菌孢子悬浮液。设置3个处理:即Foc 4处理,Foc 4孢子悬浮液浸泡香蕉苗30 min后定植于盆内,每7 d浇Foc 4孢子液100 mL和SLM培养基100 mL,连浇3周。Foc 4+JRGG-11处理,Foc 4孢子悬浮液浸泡香蕉苗30 min后定植于盆内,每7 d浇Foc 4孢子液100 mL和浓度为108CFU/mL的JRGG-11发酵液(由SLM培养基发酵)100 mL,连浇3周。对照,每7 d给香蕉苗浇SLM培养液100 mL。每处理香蕉苗30株,于28 ℃、70%相对湿度和12 h光照+12 h黑暗下培养。接种7 d和14 d后分别选取3个处理香蕉苗根系,用激光共聚焦显微镜观察Foc 4孢子侵染情况。发病率和病情指数参照周登博等[14]方法计算。
1.5 抑菌机理
依据1.2的方法获取的拮抗放线菌发酵液萃取液,在旋转蒸发仪上浓缩至200 mL,利用色谱柱层析法将浓缩后的萃取液用50%、60%、70%、100%甲醇进行洗脱并蒸干,获得活性物质提取物。用50%甲醇溶解提取物至20 mg/mL作为母液,保存于4 ℃冰箱。配制成含药平板测定不同浓度甲醇洗脱的提取物活性。利用最小二乘法建立线性回归[15],根据毒力回归方程计算EC50和EC95值。孢子萌发测定依据Wei等[16]的方法进行。
通过扫描电子显微镜(model S-4800,Hitachi Limited,Japan)观察4×EC50处理下Foc 4菌丝形态,通过透射电子显微镜(JEM-1400 Flash,Hitachi Limited,Japan)观察4×EC50处理下Foc 4细胞超微结构。
2 结果与分析
2.1 Foc 4拮抗放线菌的分离筛选
将根际土壤在4种分离培养基上稀释涂布,共分离得到放线菌61株,以Foc 4靶标进行初筛,得到对Foc 4菌丝生长具有抑菌作用的放线菌17株,其中编号为JRGG-11的放线菌抑菌效果最好,初筛对Foc 4的抑菌率为(80.48±1.49)%,发酵液复筛对Foc 4抑菌率为(58.77±1.31)%(见图1)。
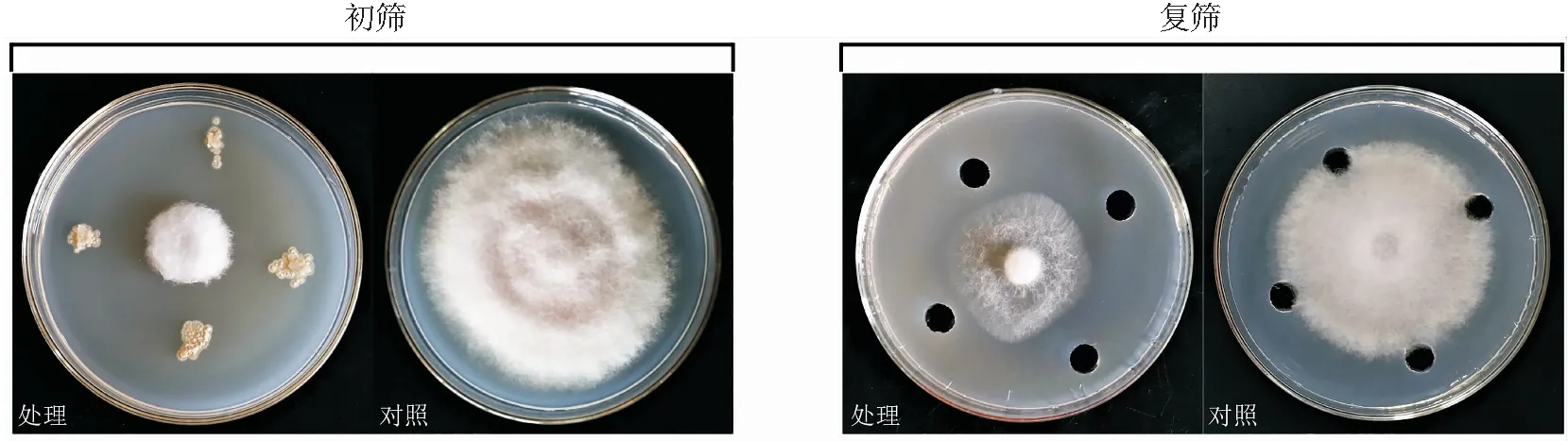
图1 放线菌JRGG-11对香蕉枯萎病菌的抑菌活性
2.2 放线菌JRGG-11的分类鉴定
2.2.1 放线菌JRGG-11生理生化鉴定 通过碳、氮源测试发现,菌株JRGG-11对鼠李糖、阿拉伯糖、棉子糖、D-纤维二糖、D-木糖、木聚糖、海藻糖、松三糖等8种碳源有偏好性,能够较好地利用组氨酸、天门冬酰胺、L-羟基脯氨酸、硝酸钾、蛋白胨、朊蛋白胨、酵母膏、酪蛋白等8种氮源。酶学测试发现菌株JRGG-11过氧化氢酶、硝酸还原、明胶液化、淀粉水解、纤维素水解、色氨酸、脲酶、脂酶等测试均为阳性,最适pH值7,对NaCl的耐受性小于7%(见表1)。

表1 放线菌JRGG-11的生理生化特性
2.2.2 放线菌JRGG-11分子生物学鉴定和扫描电镜 菌株JRGG-11在扫描电镜下的形态见图2,可以看出孢子呈球形,表面有类似毛发的刺状凸起。系统发育树表明,菌株JRGG-11与菌株StreptomycesalbospinusNBRC 13846聚为一支,但置信度较低,无法确定具体种,结合生理生化特性,将菌株JRGG-11归为链霉菌属,在NCBI上登录号为MW110901(见图2)。
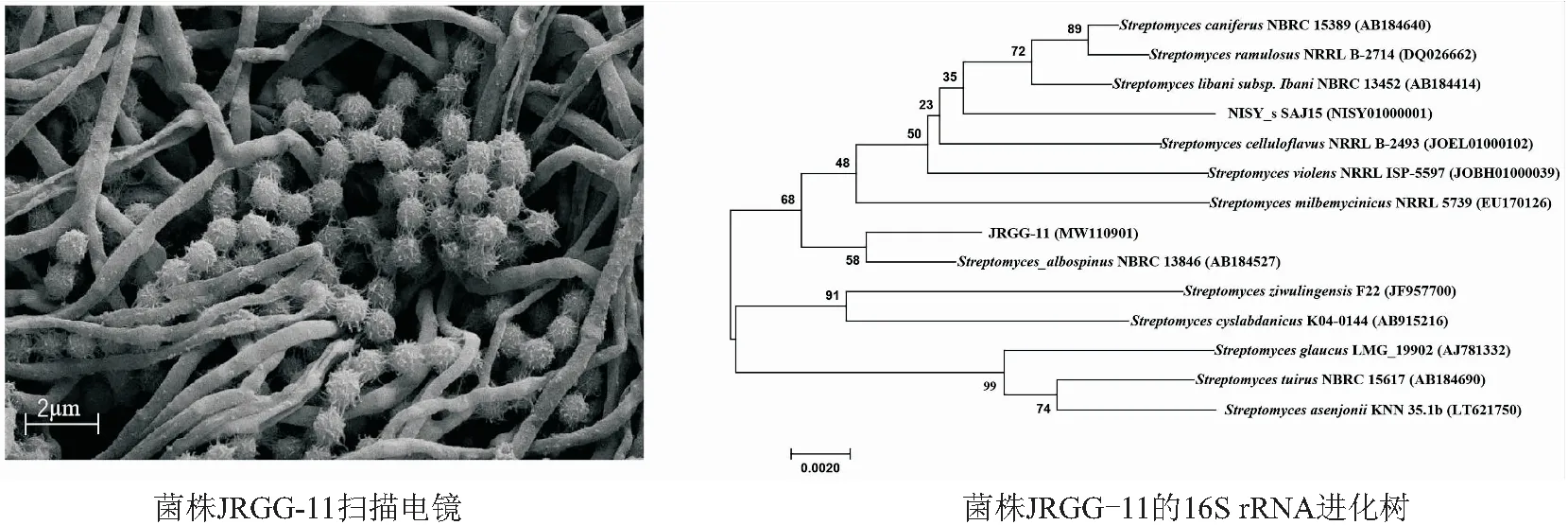
图2 放线菌JRGG-11的鉴定
2.3 菌株JRGG-11发酵液的盆栽防效
从图3香蕉根系切片可以看出,在病原菌处理7 d后,Foc 4处理的香蕉苗根表皮细胞富集了大量Foc 4孢子,14 d时中部导管有大量孢子附着。Foc 4和JRGG-11发酵液处理的香蕉苗根表皮只有少量Foc 4孢子分布。当Foc 4处理出现明显的枯萎病症状时,其香蕉苗叶片大量枯黄,病情指数达到67.62;Foc 4+JRGG-11处理香蕉苗仅有少量枯黄叶片,病情指数为11.43。菌株JRGG-11对Foc 4防控效果达到83.10%。
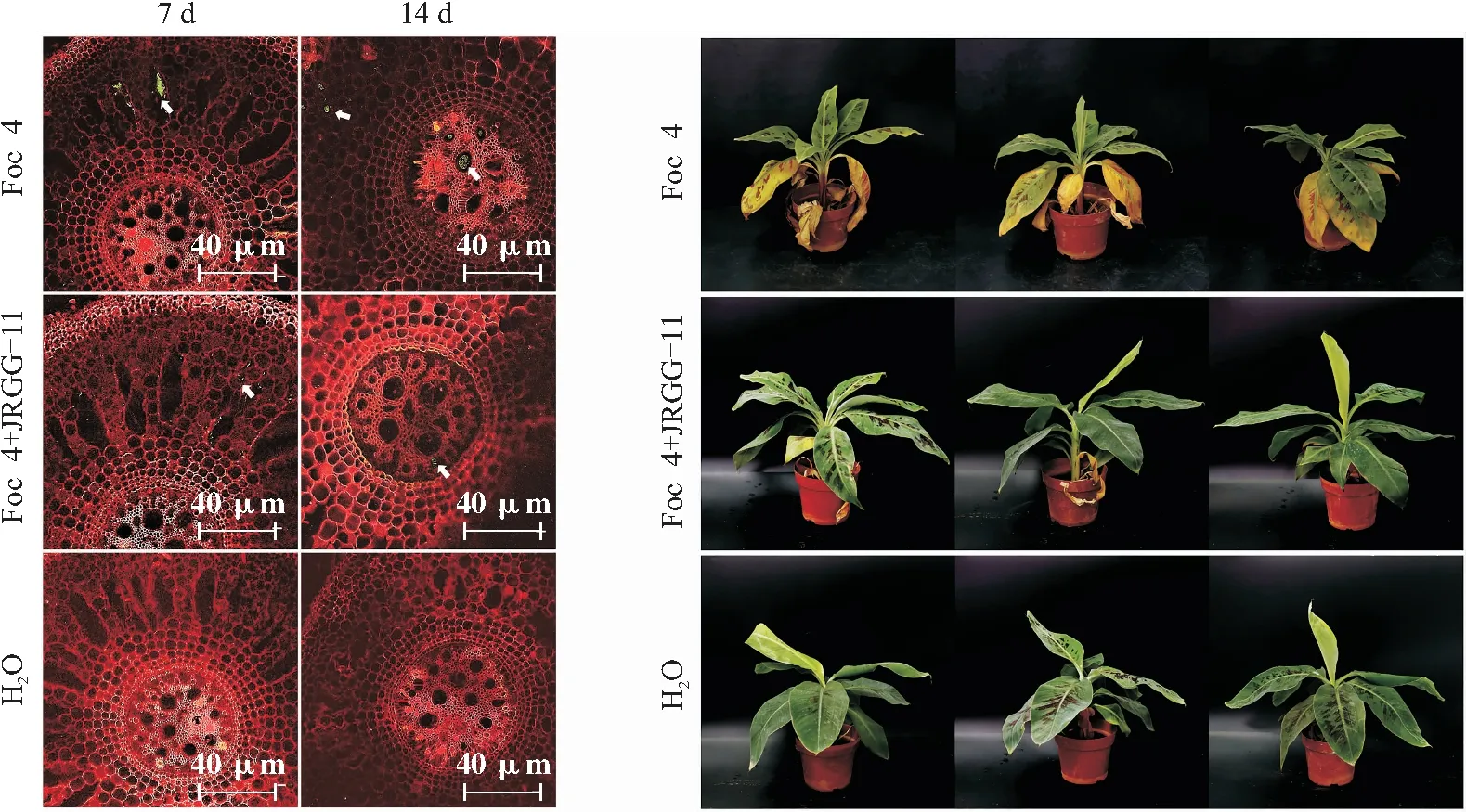
注:左图为不同处理香蕉幼苗根系中GFP-Foc 4定殖情况,右图为不同处理香蕉幼苗病变症状。
2.4 菌株JRGG-11提取物的抑菌机理
2.4.1 JRGG-11提取物的活性测定 从图4可以看出,用不同浓度的甲醇对菌株JRGG-11发酵液的活性成分进行提取,对比提取物的抑菌活性,发现100%甲醇洗脱得到的提取物活性最好,对Foc 4的抑制率达到(99.25±0.19)%。对100%甲醇洗脱的提取物进行毒力回归方程测定,得到回归方程为Y=3.206 6+1.410 1X(R=0.99),EC50为18.70 μg/mL,EC95为274.43 μg/mL。
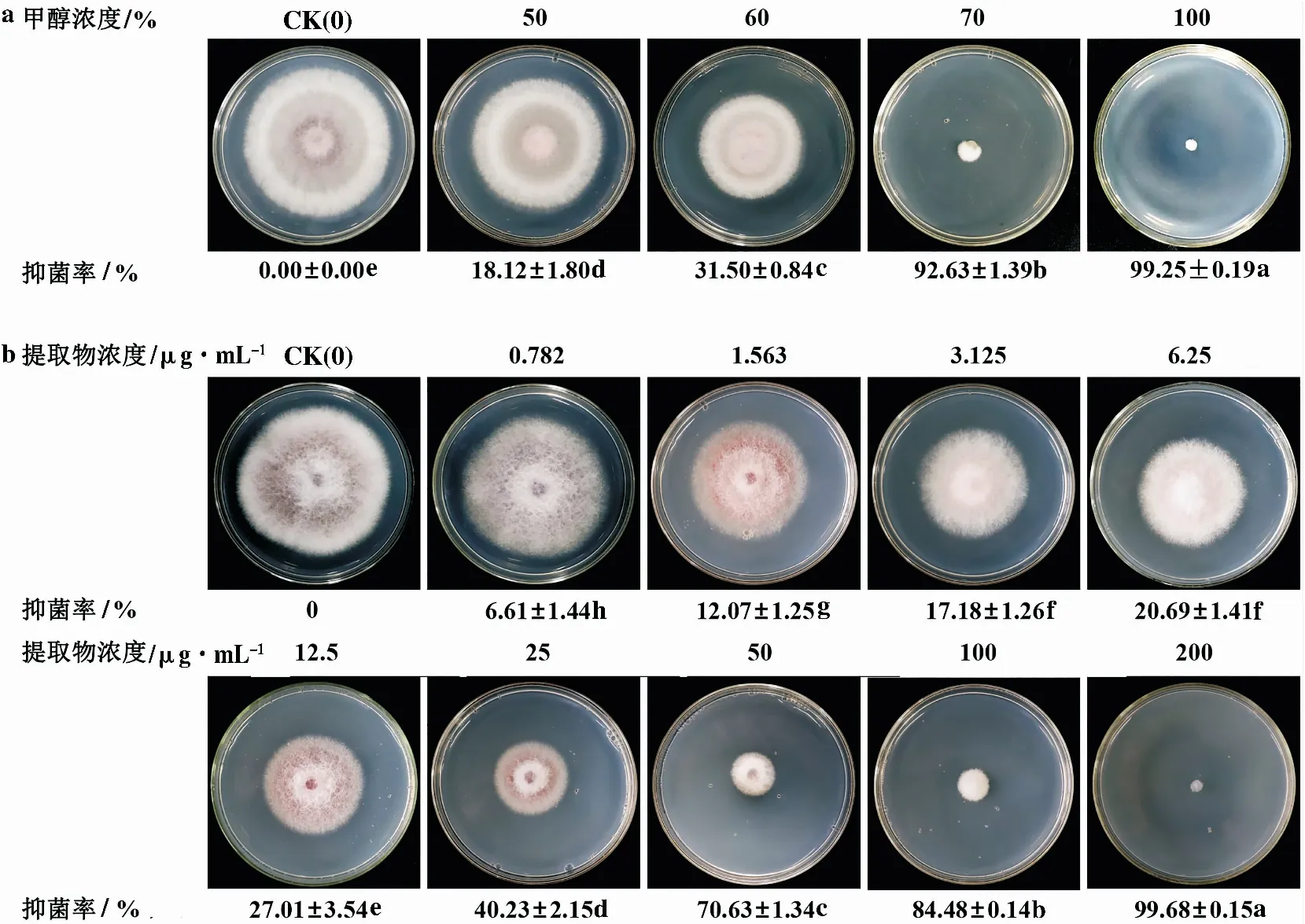
注:a.不同浓度甲醇洗脱得到的JRGG-11提取物的抑菌活性,b.不同浓度JRGG-11提取物对Foc 4菌丝生长的影响。不同小写字母表示在p<0.05水平上的差异显著性。
2.4.2 JRGG-11提取物处理对Foc 4孢子萌发的影响 从图5和表2 Foc 4孢子萌发情况可以看出,在JRGG-11提取物处理下,Foc 4孢子萌发受到抑制。2×EC50时,仅有少量孢子萌发,在4×EC50时,Foc 4孢子萌发完全被抑制。CK和1×EC50、2×EC50处理下,孢子萌发率之间存在显著性差异,2×EC50处理的Foc 4孢子萌发率仅为CK的1/3。相比CK,1×EC50和2×EC50处理下的Foc 4孢子芽管长度分别缩短了40.18%和63.61%。

注:a—e分别为提取物0(无菌水,CK)、1×EC50、2×EC50、4×EC50、8×EC50 mg/L处理。
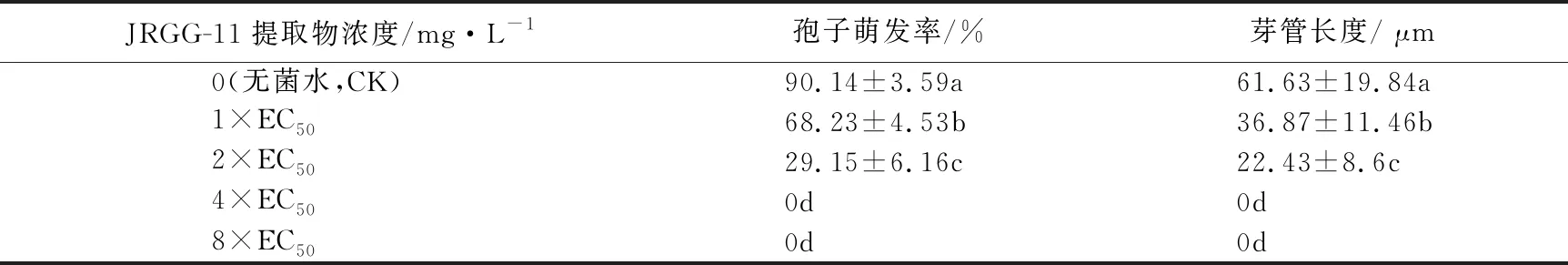
表2 放线菌JRGG-11不同浓度提取物对Foc 4孢子的影响
2.4.3 JRGG-11提取物对Foc 4菌丝形态特征的影响 从图6a和图6b可以看出,正常的Foc 4菌丝表面光滑,粗细均一,菌丝分布较为整齐。而从图6c至图6g可以看出,4×EC50浓度JRGG-11提取物处理后,Foc 4菌丝出现大面积膨大、破裂和皱缩现象,菌丝分布杂乱,顶端明显的膨大、断裂和皱缩。
2.4.4 JRGG-11提取物处理对Foc 4菌丝细胞超微结构的影响 从图7可以看出,透射电镜检测Foc 4菌丝超微结构,未经JRGG-11提取物处理的Foc 4病原菌细胞,其细胞壁光滑完整,厚薄均一,细胞器清晰可见。经过4×EC50浓度JRGG-11提取物处理后,病原菌的细胞壁明显增厚,细胞器模糊,细胞内出现大囊泡;细胞质和囊泡内基质明显流失和浓缩,出现空泡化现象;之后细胞壁开始溶解,细胞内细胞器溶解;细胞空腔化现象明显,细胞质和细胞壁分离。
3 结论与讨论
尖峰岭是位于海南的热带原始森林,独特的气候孕育了丰富的微生物资源,笔者从尖峰岭润楠根际土壤分离出的Foc 4拮抗放线菌JRGG-11归为链霉菌属,该属是主要的抗生素生产菌,也是在农业上运用较多的一类生防菌。其抑菌作用机制主要有4种:生态位竞争、抗生作用、重寄生作用和诱导系统抗性。抗生作用为最直接的抑菌方式,主要通过产生多肽类、聚酮类、核苷类或者水解酶等次级代谢物来抑制甚至杀死病原菌。

注:a和b为对照,c为4×EC50浓度JRGG-11提取物处理3 d的Foc 4菌丝形态;f和g分别为放大的d和e。a、c放大500×;b、f、g放大3 000×。

注:a为无菌水处理,b—f为4× EC50浓度JRGG-11提取物处理。
Jeong等从链霉菌CA5中提取出1种多烯大环内酯类物质CA5A,对葡萄灰霉病菌有良好的抑制作用[17];覃可等发现链霉菌FT05W中含有几丁质酶,抑制烟草黑胫病菌生长[18]。刘亚南等发现玫瑰黄链霉菌Men-myco-93-63活性代谢产物roflamycoin能够显著抑制4种病原菌生长[19]。本研究中,链霉菌JRGG-11提取物处理后的Foc 4菌丝发生断裂、膨胀,可以看出其活性物质直接作用于菌体,通过抗生作用杀死菌丝。Feng等报道的CPT-11对杧果炭疽病的作用[20]以及王志芳等报道的Streptomycesalboflavus对串珠镰刀菌的作用[21]也有类似结果出现。
盆栽试验显示,菌株JRGG-11的发酵液对Foc 4的防控效果达到了83.10%,优于赖宝春等[22]从辣椒根系土壤中分离出的Foc 4拮抗菌灰锈赤链霉菌FX81(对香蕉枯萎病盆栽防效81.05%),及周维等[23]从健康的香蕉植株根部分离出的解淀粉枯草芽孢杆菌G9R-3(对Foc 4盆栽防效65.00%),但和叶乃玮等用3株木霉制成的复合菌肥(对Foc 4防效89.73%)[24]相比效果稍差。大田不同于盆栽试验,其生产环境多变且情况复杂,用单菌作为生防制剂或者菌肥往往效果欠佳,而通过不同功效的菌株组合制成多功能复合菌制剂可以达到更好效果,后续研究将探索JRGG-11复合菌制剂的生产。

