白斑狗鱼早期发育阶段的高温耐受性分析
张钰 海萨·艾也力汗 热比古丽·沙吾提 时春明 张人铭
(新疆维吾尔自治区水产科学研究所 农业农村部西北地区渔业资源环境科学观测实验站,乌鲁木齐 830000)
鱼类属于变温动物,自身缺乏体温调节能力,其体温随环境温度的变化而变化,对水温的反应敏感且迅速,易受环境温度影响[1]。环境温度的变化影响鱼类繁殖发育、生长存活、免疫和摄食等重要生命活动过程[2]。鱼类的热耐受性在揭示鱼类温度适应能力和可塑性、种群地理分布以及评价水生态系统对潜在热冲击的承受能力等方面具有重要的作用[3-5]。白斑狗鱼(Esox lucius)隶属于鲑形目(Salmoniformes),狗鱼亚目(Esocoidei),狗鱼科(Esocidae),狗鱼属(Esox),主要分布于欧洲、亚洲和北美洲的北极圈周边地区,我国境内仅分布于额尔齐斯河流域,处于自然分布区域的南部边界。
不同鱼类对温度的适应能力不同,一般冷水性鱼类的温度适应能力低于温带分布的鱼类,同种鱼类在不同发育阶段的温度适应性也不同[6]。对于同一物种,早期生活阶段对外界环境温度的变化通常最为敏感,因此,相关耐热性研究的实验动物多选择幼体,这样得到的实验结果更有生物学和生态学意义[7]。
鱼类的热耐受性受生物因素(物种的种间差异、遗传特性、个体大小、年龄、性别、生活史阶段和营养状况等)和非生物因素(驯化温度、驯化时间、栖息地环境和水质等)影响。在这些因素中,驯化温度通常被认为是最重要的影响因素之一[3,8]。
最大临界值(critical thermal maximum,CTmax)和起始致死温度(upper incipient temperature,UILT50)是表达鱼类热耐受阈值的主要指标。热休克蛋白70(heat shock proteins70,HSP70)在热胁迫下参与机体和细胞的耐力形成,能够帮助生物体应对热胁迫。众多研究表明,在水生动物受热刺激后,HSP70表达量升高[9-14]。本研究以白斑狗鱼仔、稚鱼为实验材料,测定热耐受性相关阈值,以期了解其高温耐受性,并测定HSP70基因在不同应激温度下在不同组织中的表达量,为白斑狗鱼养殖和生态适应性研究提供基础资料。
1 材料与方法
1.1 材料
2019年4月2 日以养殖于新疆水生野生动物救护中心的白斑狗鱼为亲本,从已性成熟的白斑狗鱼群体中,选择体重2 kg以上的雌鱼、体重0.8 kg以上的雄鱼,且丰满度好、无病、无伤的个体作为亲本。雌鱼分2次注射催产素,针距为24 h,第一次注射剂量:5 μg SGnRH-A+1.5 mgVB1+3 mg DOM,第二次注射剂量:25 μg SGnRH-A+3 mg DOM;雄鱼一次注射,注射剂量:5 μg SGnRH-A+1.5 mgVB1+3 mg DOM。人工催产3-4 d后,按照雌雄1∶2的比例挑选30组亲鱼人工采集精卵。在直径为180 cm、高度为74 cm的圆形PE池中进行受精卵孵化和苗种培育,以此作为高温耐受性实验材料。
人工繁殖的白斑狗鱼鱼苗经过2-3个月的培育,从中挑选体质健壮、规格均一的幼鱼作为HSP70基因表达量测定的材料。白斑狗鱼幼鱼平均体长为17.7 cm±1.2 cm,平均体重为42.9 g±3.5 g。在养殖车间暂养7日,暂养期间按常规养殖每日投喂2次,连续充气,每天换水1/3。
1.2 方法
1.2.1 白斑狗鱼受精卵高温耐受性测定 高温耐受性实验在长×宽×高为68 cm×58 cm×50 cm的玻璃缸中进行,控温设备为500 W的HX-836剑客PTC加热棒,用HACH HQ30d便携式溶解氧分析仪测定实验水温和溶解氧,24 h连续充气。
实验用受精卵为同批次采集,完全吸水膨胀后随机选取,每个温度梯度约1 000粒。实验在4个玻璃缸中进行,受精卵在离水面15 cm处固定的长×宽为10 cm×20 cm、网目为40目的着卵板上孵化。以人工授精自然水温(15℃)为基点,以0.5℃/h的加温速率达到设置水温[(15±0.5)℃、(17±0.5)℃、(19±0.5)℃和(21±0.5)℃]。受精卵孵化结束后统计孵出鱼苗中畸形和正常鱼苗的数量。受精率统计:同批次受精卵在(15±1)℃的水温中孵化至原肠中期后统计受精率。
1.2.2 白斑狗鱼仔鱼高温耐受性测定 高温耐受性实验在长×宽×高为68 cm×58 cm×50 cm的玻璃缸中进行,用加热棒控制水温,用溶氧仪测定实验水温和溶解氧,24 h连续充气。实验鱼完全失去平衡,无法正立,失去逃离能力则判定为已死亡。
温度驯化:实验在4个玻璃缸(规格同上)中进行,每个温度梯度300尾上浮鱼苗,驯化水温设置为(18±0.5)℃、(21±0.5)℃、(24±0.5)℃和(27±0.5)℃,24 h充气,每天投喂活体饵料2次,排污1次,实验进行7 d。
急性升温实验:实验在4个玻璃钢(规格同上)中进行,水温设置为(30±0.5)℃、(31±0.5)℃、(32±0.5)℃和(33±0.5)℃,每个玻璃缸内放置4个长×宽×高为25 cm×40 cm×50 cm的网箱,每个网箱内实验鱼苗数量为10尾,实验开始前24 h停止投喂,观察24 h内鱼苗的死亡数量,实验重复3次。
缓慢升温实验:实验在4个玻璃缸(规格同上)中进行,以驯化温度为基础温度,以2℃/d的升温速率提温至29℃,水温达到29℃后以1℃/d的升温速率提温至所有实验鱼死亡,观察和记录每条鱼死亡的时间和死亡时的水温。每组实验鱼苗数量为10尾,实验重复3次。实验期间每天投喂活体饵料2次,2 h监测一次溶解氧和水温。
1.2.3 不同胁迫温度下白斑狗鱼幼鱼HSP70基因的表达量 将20尾白斑狗鱼幼鱼置于水温27℃的水槽中24 h,用温控加热棒以1℃/d的升温速率将水温逐渐升至30、33℃,白斑狗鱼幼鱼在每个温度中刺激24 h。每个温度分别随机选3尾白斑狗鱼幼鱼取其脑、鳃、心和肝浸泡于RNAstore(天根)中,-80℃保存备用。实验设置3个平行组和1个对照组(对照组保持水温27℃不升温,下同)。
1.2.4 不同胁迫时间下白斑狗鱼幼鱼HSP70基因的表达量 将20尾白斑狗鱼幼鱼置于水温27℃的水槽中,快速提温,升温至30℃后,分别在0、6、9、12和24 h随机选3尾白斑狗鱼幼鱼取其脑、鳃、心和肝浸泡于RNAstore(天根)中,-80℃保存备用。实验设置3个平行组和1个对照组。
1.2.5 HSP70引物序列的扩增 向样品中加入适量Trizol,用玻璃研磨器充分研磨,提取样品总RNA。检测RNA的完整性,估算RNA的纯度并计算RNA的浓度,将各RNA浓度均一化。以均一化后的RNA为模板,反转录获得cDNA,将所得到的cDNA模板置于-80℃冰箱保存备用。
根 据 HSP70(GenBank登 录 号:NC_025974.Esox lucius isolate)、β-actin的基因序列,利用Primer Premier5.0软件结合DNAstar分析软件及BLAST程序,设计荧光定量PCR引物。引物由上海生工公司合成,用无菌双蒸水稀释至10 μmol/L,-20℃保存备用。引物序列如表1所示。
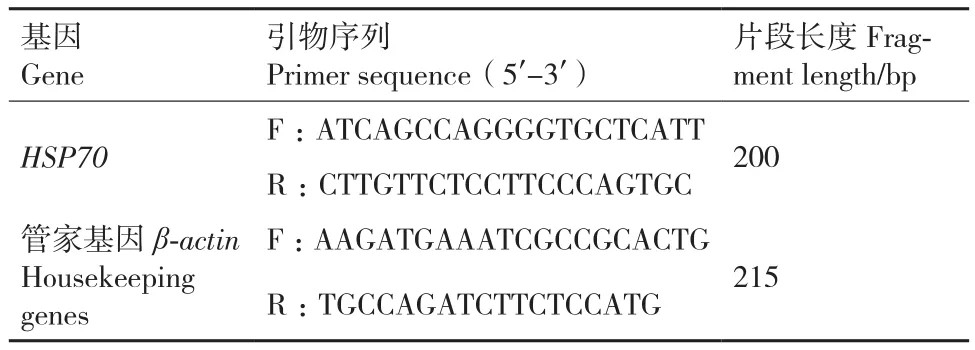
表1 荧光定量PCR引物Table 1 Fluorescent quantitative PCR primers
荧光定量PCR在BioRad CPX96 PCR扩增仪上进行,按照TB Green Premix Ex Taq(TaKaRa)使用说明,采用嵌合荧光法进行实时定量PCR扩增反应。PCR反应体系:TB Green Premix Ex Taq 12.5 μL,上下引物分别0.5 μL,cDNA 2.0 μL,加ddH2O至25.0 μL。反应条件 :95℃预变性 30 s,(95℃变性 5 s,56℃退火30 s)40个循环。
1.2.6 数据分析 受精率为在原肠中期1 000粒受精卵中正常发育鱼卵数的百分比。出苗率=正常破膜鱼苗数/原肠中期正常发育鱼卵数×100%。最大临界温度(CTmax)通过对失去平衡或致死的实验鱼的百分比进行线性回归,再由“内插法”得到50%个体所对应的温度值求得[15-16]。不同驯化温度下,利用Probit回归分析求得[17]白斑狗鱼仔鱼的起始致死温度(UILT50)。
分子生物学实验部分每个样品进行3个平行PCR反应,求出各样品Ct值的平均值。以白斑狗鱼β-actin为内参基因,运用公式2-ΔΔCt计算目的基因的相对表达量,公式中ΔΔCt=(Ct目的基因-Ct管家基因)实验组 -(Ct目的基因-Ct管家基因)对照组。结果用SPSS16.0软件进行单因素方差分析(One-way ANOVA)和Duncan’s多重比较,显著性水平设为0.05。
2 结果
2.1 白斑狗鱼受精卵热耐受性研究
在水温15-21℃范围内,白斑狗鱼受精卵的破膜时间随着孵化水温的升高而缩短。水温在15℃和17℃时,鱼苗的上浮率(孵出鱼苗中上浮鱼苗所占的比例)无明显的差别;当水温达到19℃时,上浮率下降;当孵化水温达到21℃时,鱼苗上浮率最低,结果见表2。
2.2 白斑狗鱼仔鱼在不同驯化温度下的24hUILT50
白斑狗鱼仔鱼在18、21、24和27℃驯化后的24hUILT50分 别 为 29.60、30.18、31.59和 32.74℃。24hUILT50值随着驯化水温的升高而升高,结果见图1。

表2 不同孵化水温对白斑狗鱼仔鱼上浮率的影响Table 2 Effects of different incubation water temperature on floatation rate of E.lucius fry
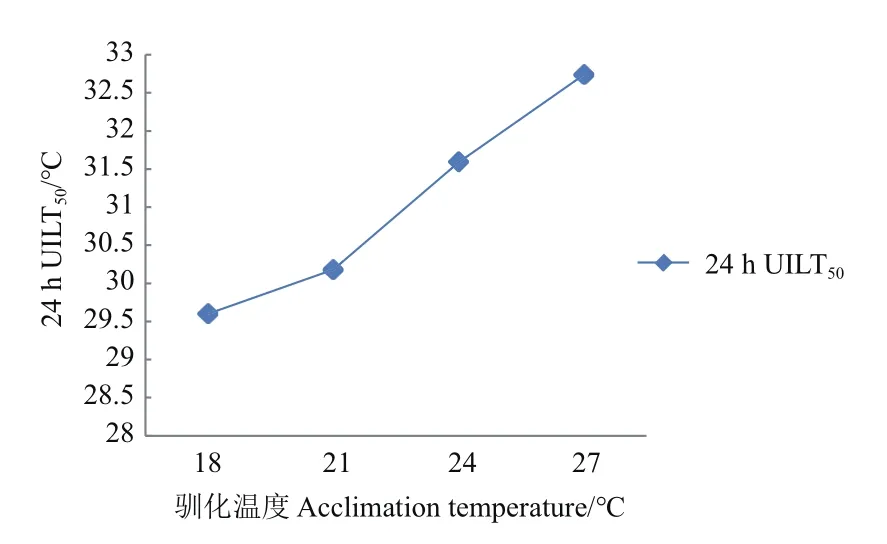
图1 白斑狗鱼在不同驯化温度下的24hUILT50Fig.1 24hUILT50 of E.lucius at different acclimation temperatures
2.3 白斑狗鱼仔鱼的CTmax
实验鱼中一半个体失去平衡时的温度即为CTmax。以(1±0.5)℃/d的升温速率进行热胁迫时,不同驯化温度(18、21、24和27℃)下的CTmax差异不大,分别为 32.90、33.06、33.36和33.27℃。但CTmax值出现的时间随着驯化温度的升高而延长:驯化温度为18℃时,CTmax出现的时间为1 152 min;驯化温度为27℃时,CTmax出现时间达到了1 735 min,结果见表3。
2.4 高温胁迫下HSP70基因在白斑狗鱼各组织中的表达
采用荧光定量PCR检测白斑狗鱼在不同温度(27、30和33℃)胁迫下各组织(脑、鳃、心、肝)中HSP70基因的表达情况,以27℃的基因表达量作为基准1,结果(图2)显示:与对照组27℃相比,白斑狗鱼各组织中HSP70基因表达量在30和33℃均有所上升。在脑组织中HSP70基因的表达量随着胁迫温度的上升呈现先显著上升(P<0.05),后显著下降(P<0.05)的趋势,在30℃时达到了最大表达量;在鳃和心脏组织中HSP70基因的表达量随着胁迫温度的上升呈现先显著上升(P<0.05),后下降的趋势,33℃的表达量与30℃的表达量无显著差异(P>0.05),在30℃时分别达到了最大表达量;在肝脏组织中HSP70基因的表达量随着胁迫温度的上升呈现逐步显著上升(P<0.05)的趋势,最大表达量出现在33℃时。

表3 白斑狗鱼仔鱼在不同驯化温度下的CTmaxTable 3 CTmax of E.lucius fry at different acclimation temperatures
2.5 高温胁迫下白斑狗鱼HSP70基因组织特异性表达
采用荧光定量PCR检测白斑狗鱼在30和33℃高温胁迫下各组织(脑、鳃、心和肝)中HSP70基因的表达情况,结果如图3所示:在30和33℃高温胁迫下HSP70基因在脑、鳃、心、肝各组织中的相对表达量均存在显著差异(P<0.05)。在30和33℃高温胁迫下HSP70基因的相对表达量在心脏组织中最低。在30℃高温胁迫下HSP70基因的相对表达量在脑组织中最高。在33℃高温胁迫下HSP70基因的相对表达量在肝脏组织中最高。
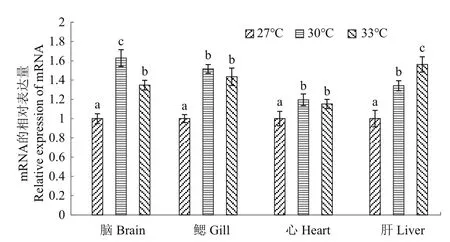
图2 不同温度高温胁迫下白斑狗鱼HSP70基因在各组织中的表达Fig.2 Expression of HSP70 gene in E.lucius different tissues under different high temperature stress

图3 相同温度高温胁迫下白斑狗鱼HSP70基因在不同组织中的表达Fig.3 Expression of HSP70 gene in E.lucius different tissues under the same high temperature stress
2.6 不同时间高温胁迫下白斑狗鱼HSP70基因在各组织中的表达
采用荧光定量PCR检测白斑狗鱼在30℃高温胁迫不同时间(0、6、9、12和24 h)后各组织(脑、鳃、心和肝)中HSP70基因的表达情况,其中以0h的基因表达量作为基准1,结果如图4所示:与对照组0 h相比,高温胁迫6、9、12和24 h时HSP70基因表达量在脑和鳃中均高于对照组,且差异显著(P<0.05);心脏组织中HSP70基因表达量在胁迫6、9、12和24 h时均高于对照组,除24 h外其他差异显著(P<0.05);在肝脏组织中仅在高温胁迫12 h时表达量略高于对照组0 h,差异不显著(P>0.05)。在脑、鳃、心脏组织中,随着高温胁迫时间的延长,HSP70基因的表达量呈现先上升后下降的趋势,在肝脏组织中则呈现先下降后上升再下降的趋势。脑和肝脏在高温胁迫12 h时达到了HSP70基因的最大表达量;鳃和心脏在9 h时达到了最大表达量。

图4 不同时间高温胁迫下白斑狗鱼HSP70基因在各组织中的表达Fig.4 Expression of HSP70 gene in E.lucius different tissues under different times of high temperature stress
2.7 相同时间高温胁迫下白斑狗鱼HSP70基因在不同组织中的表达
采用荧光定量PCR检测白斑狗鱼在相同时间(6、9、12和24 h)高温胁迫下不同组织(脑、鳃、心和肝)中HSP70基因的表达情况,结果(图5)显示:在30℃高温胁迫6、9、12和24 h时HSP70基因在脑、鳃、心、肝各组织中的相对表达量均存在显著差异(P<0.05)。高温胁迫6、9 h时4种组织中心脏的HSP70基因表达量最大,高温胁迫12、24 h时脑的HSP70基因表达量最大。在高温胁迫6、9、12和24 h时肝脏组织的HSP70基因表达量均小于同一胁迫时间下脑、鳃、心脏组织的表达量。

图5 相同时间高温胁迫下白斑狗鱼HSP70基因在不同组织中的表达Fig.5 Expression of HSP70 gene in E.lucius different tissues under the same time of high temperature stress
3 讨论
全球气候变暖对地球生物产生越来越多不良的影响,高温对鱼类的不利影响后果显而易见[18]。耐温性个体的生理特质在热适应性上的优势调控,为耐温选育工作在分子和蛋白水平上提供了理论依据[19]。高温对白斑狗鱼受精卵、仔鱼及幼鱼均有不同程度的影响。
3.1 白斑狗鱼受精卵热耐受性研究
水温对鱼类胚胎发育及其生存、生长和发育都有十分重要的影响,不同鱼类胚胎发育要求的温度不同[20-21]。在额尔齐斯河流域的白斑狗鱼产卵温度为8-15℃[22],齐遵利等[23]认为白斑狗鱼胚胎发育的适温范围在14-16℃,当水温超过18℃时,白斑狗鱼仔、稚、幼鱼成活率下降。本研究结果显示白斑狗鱼受精卵在15和17℃的水温中孵化时,鱼苗上浮率无明显的差异,而当孵化水温上升至19℃以上时鱼苗上浮率明显下降,这与上述研究结果基本一致。在生产中,将白斑狗鱼受精卵孵化水温提高至17℃,可缩短孵化时间,减少水霉病的发生,一定程度上提高成活率。
3.2 白斑狗鱼仔鱼在不同驯化温度下的24hUILT50和CTmax
鱼类的热耐受性通常是通过急性或缓慢升温实验来研究的[3,24]。急性升温实验是使鱼类从适应的温度突然暴露于实验温度,统计某一特定时间内实验鱼类的死亡情况[25]。缓慢升温实验是以某种特定的升温速率持续升温,直至鱼体达到一个临界点[26-27]。大量的研究采用缓慢升温的方法,这可使实验生物有充足的时间对改变的环境温度进行调节适应,能更客观地反映出实验生物本身的热忍耐力,建议采用 1℃/ d 的温升速率[1]。
24hUILT50和CTmax是生物热耐受性研究中两个最基本的指标。对白斑狗鱼仔鱼的急性升温和缓慢升温实验结果表明:适当提高白斑狗鱼仔鱼的驯化水温可提高其在高温胁迫下的24hUILT50值并推迟CTmax出现的时间,表明其对高温的耐受力能够在驯化后得以逐渐提高。
3.3 高温胁迫下白斑狗鱼HSP70基因的表达
本实验运用荧光定量PCR检测了30、33℃高温胁迫下白斑狗鱼各组织(脑、鳃、心和肝)中HSP70基因的表达情况。结果表明,随着温度的上升,HSP70的表达量在脑、鳃、心脏组织中下降,而在肝脏组织中则呈现上升趋势。
在30℃高温胁迫下,白斑狗鱼幼鱼脑、鳃、心脏组织HSP70基因的表达量均随着高温胁迫时间的延长表现出相似的变化趋势,即先升高后下降。说明调节热应激蛋白的表达量是机体细胞应对热应激的反应之一[28]。通过研究发现,HSP70基因的表达量达到峰值的时间点有两个,即9 h和12 h。根据这一特点,可将这3个组织分为两组:9 h组包括鳃和心脏,12 h组包括脑。而肝脏在30℃高温胁迫下,随着胁迫时间的延长,呈现先下降后上升再下降的趋势,在12 h时达到峰值,但波动幅度不大。
为了综合比较高温胁迫对白斑狗鱼幼鱼影响的组织间差异,以高温胁迫下各时间点为基准,横向比较了相同时间高温胁迫下各组织HSP70基因表达量的差异。研究结果显示,实验组中脑和心脏是HSP70基因表达较丰富的组织,也是HSP70基因表达量升高最为显著的组织。
4 结论
白斑狗鱼能对高温胁迫做出反应。适当提高驯化水温,可提高高温胁迫下白斑狗鱼仔鱼的24hUILT50值并推迟CTmax出现的时间。在不同温度和不同时间的高温胁迫下,白斑狗鱼脑、鳃、心和肝4种组织中HSP70基因的表达量均表现出不同程度的变化,具有时间特异性和组织特异性,但应答幅度不尽相同。经过高温驯化后,白斑狗鱼提高了温度耐受性,可能是通过HSP70参与重要调控作用。