虎杖PcMYB1启动子的克隆及其活性分析
林艳丽 覃建兵 伍翔 王岩岩 潘佑找 柳忠玉
(1.长江大学生命科学学院,荆州 434025;2.长江大学园艺园林学院 荆州 434025)
虎杖(Polygonum cuspidatum Sieb.et Zucc.)是蓼科多年生药用草本植物,药用成分包含蒽醌类、二苯乙烯类、黄酮类和多糖类等化合物,药用价值丰富。药用植物中发挥防病治病功能的有效成分是药用植物区别于其他作物最主要的特征,有效成分主要是药用植物生长过程中积累的代谢产物,转录因子是调节药用植物次生代谢及有效成分积累的重要影响因子。因此,研究转录因子对次生代谢产物的积累的影响尤为重要。
MYB转录因子家族是植物基因组中最大的转录因子家族之一[1],参与调控植物药效成分合成,目前,已有不少从植物中克隆MYB基因启动子的报道。如从黄芪中克隆出了AmMYB44的启动子[2];从银杏中克隆出了GbMYBF2的启动子[3];从丹参中克隆出了SmMYB7的启动子[4]。相关研究发现MYB家族基因启动子序列中除含有启动子TATA-box、CAAT-box等基本的组成元件外,还含有一些特有的与激素、抗逆境、组织器官发育等相关顺式作用元件,推测对MYB转录因子的激活和诱导起到调控作用。但虎杖MYB基因启动子的相关研究尚未见报道。
药用植物课题组前期从虎杖中分离得到1个新的转录因子PcMYB1(GenBank登录号为KY495789)[5],生物信息学分析PcMYB1序列C端存在一个抑制结构域基序pdLNL[D/E]LXI[G/S],并且利用酵母单杂交试验、转基因技术等证明PcMYB1具有转录抑制活性,对植物木质素合成具有负调控作用[6]。本研究拟用 hiTAIL-PCR[7]方法获得PcMYB1的启动子序列,并构建启动子植物表达载体,通过毛状根遗传转化以及GUS组织化学染色分析PcMYB1启动子活性。旨为后续研究PcMYB1参与植物次生代谢产物合成的分子机制奠定基础。
1 材料与方法
1.1 材料
样品由长江大学生命科学学院柳忠玉副教授鉴定为虎杖植株,植于长江大学苗圃,发根农杆菌菌株ATCC15834、大肠杆菌菌株DH5α、载体pCAMBIA1300G、pMD18-T等由药用植物课题组保存。卡那霉素(kanamycin,Kan)、潮霉素(hygromycin,Hyg)、乙酰丁香酮、质粒提取试剂盒、胶回收试剂盒等购自Tiangen公司;限制性内切酶、Taq DNA聚合酶、T4连接酶购自TaKaRa公司;所用引物和测序服务由上海生物工程有限公司完成。
1.2 方法
1.2.1 PcMYB1启动子的克隆与序列分析 利用hiTAIL-PCR法[7]扩增虎杖PcMYB1的启动子序列,以药用植物课题组已经获得的PcMYB1基因(GenBank登录号为KY495789)序列为基础,设计3条特异巢式引物SP0-1、SP1-1和SP2-1,结合4条LAD简并引物及AC1引物(表1)进行3轮PCR扩增。
以虎杖基因组DNA为预扩增模板,LAD1-LAD4、SP0-1为引物进行预扩增;以预扩增产物稀释40倍后作为模板,AC1、SP1-1为引物进行第一轮扩增;再以第一轮扩增产物稀释10倍后作为模板,AC1、SP2-1作为引物进行第二轮扩增。将PCR产物特异性条带回收并测序。所获序列经过同源比对确定为PcMYB1的5′侧翼序列后,设计并合成引物P0-F和P0-R(表1),以虎杖叶片基因组DNA为模板进行 PCR 扩增:94℃ 2 min;94℃ 30 s,58℃ 45 s,72℃ 1 min,35个循环;72℃ 10 min。将PCR产物回收,连接到pMD18-T载体后转化大肠杆菌并测序,重组子命名为pMD18-T-P0。获得虎杖PcMYB1启动子序列后,利用软件PlantCARE预测该启动子潜在的顺式作用元件。
1.2.2 PcMYB1启动子表达载体的构建 根据启动子测序和序列分析结果,在全长启动子P1(-2 884-+1)的基础上,设计3个5′端缺失启动子(图1),分别是 P2(-2 259-+1)、P3(-1 807-+1)和P4(-1 362-+1);并根据其序列设计对应引物(表1)。以质粒pMD18-T-P0为模板,引物P1-F、pro-R扩增全长启动子P1;引物P2-F、pro-R扩增5′端缺失启动子P2;引物P3-F、pro-R扩增5′端缺失启动子P3;引物P4-F、pro-R扩增5′端缺失启动子P4。PCR产物经过双酶切(PstⅠ+BamH I)后回收目的片段;与经过同样的酶切掉35S启动子的pCAMBIA1301G载体连接。
1.2.3 发根农杆菌介导的虎杖毛状根遗传转化 用电转化法将植物表达载体P1∷GUS、P2∷GUS、P3∷GUS和P4∷GUS以及阳性对照35S∷GUS分别转化农杆菌ATCC15834菌株。挑取阳性单菌落于5 mL TY液体培养基(含50 μg/mL卡那霉素)中,28℃条件下180 r/min培养48 h。取菌液100 μL涂布到TY固体培养基(含50 μg/mL卡那霉素),28℃培养48 h。将菌落用涂棒刮下,用1/2MS液体培养基(含有100 μmol/L乙酰丁香酮)重悬,振荡至A600为0.8左右。选取生长健壮的虎杖无菌苗,叶片切成1 cm×1 cm小块,并置于准备好的菌液中浸泡10 min,用灭菌滤纸吸干叶片表面的菌液,然后将叶片转移至1/2MS固体培养基(含7.5 μg/mL潮霉素),于黑暗中进行筛选培养并观察毛状根的生长状态。
1.2.4 转基因虎杖毛状根的PCR检测 利用CTAB法提取虎杖毛状根的基因组DNA。以基因组DNA为模板,利用引物Hyg-F和Hyg-R(表1)扩增潮霉素基因Hyg,预期扩增片段大小为500 bp;利用引物GUS-F和GUS-R(表1)扩增GUS,预期扩增片段大小为1 080 bp。
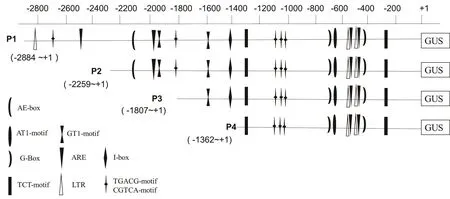
图1 PcMYB1启动子系列缺失片段表达载体构建示意图Fig.1 Schematic representation of expression vector construction of serial deletion fragments of PcMYB1 promoter
1.2.5 转基因虎杖毛状根的GUS染色检测 选取经PCR鉴定为阳性的毛状根进行GUS染色分析。参照Jefferson等[8]方法略加修改,将毛状根完全浸没在事先预冷的90%丙酮溶液中,室温放置20 min。再用预冷的去离子水冲洗,将丙酮溶液完全冲洗干净,再将毛状根浸没于GUS染色剂中,37℃过夜。随后将GUS染色处理的毛状根置于浓度为70%的乙醇中脱色30 min,最后用95%的乙醇洗脱,并观察拍照。
2 结果
2.1 PcMYB1启动子序列的获得
在已经获得的PcMYB1(GenBank登录号为KY495789)序列基础上,利用hiTAIL-PCR法扩增虎杖PcMYB1的启动子序列。用1%琼脂糖对PCR扩增产物进行检测,预扩增的PCR产物均无特异条带(图2-A)。第一轮hiTAIL-PCR产物出现特异条带(图2-B)。第二轮hiTAIL-PCR产物仍然是特异条带(图2-C),将该特异条带回收。测序后与PcMYB1进行同源性比对,确认其为PcMYB1的5′侧翼序列。再以虎杖基因组DNA为模板,通过PCR扩增最终获得PcMYB1启动子序列2 884 bp(图3),命名为proPcMYB1(GenBank登录号为MT811057)。
2.2 PcMYB1启动子的生物信息学分析
利用PlantCARE对克隆获得的启动子序列中可能存在的顺式作用元件进行预测,分析PcMYB1启动子元件的类型、数量及位置(表2和图3)。其中,+1为翻译起始位点,负值表示从翻译起始密码子开始的5′端上游序列。PcMYB1启动子包含多个真核生物启动子保守元件TATAbox和CAAT-box。此外,还有光响应元件GT1-motif、G-box,涉及光反应的AE-box、AT1-box、TCT-box、I-box元件,涉及厌氧诱导顺式作用的ARE元件,涉及低温诱导顺式作用的LTR元件,还有参与茉莉酸甲酯响应的CGTCA-motif和TGACG-motif元件。
2.3 植物表达载体的构建与鉴定

图2 PcMYB1的hiTAIL-PCR扩增产物电泳分析Fig.2 Analysis of PcMYB1 by electrophoresis of hiTAILPCR amplification products
根据启动子测序和生物信息学分析结果,将全长启动子P1和3个5′端缺失启动子(P2、P3、P4)分别与GUS基因融合构建植物表达载体(图1)。对重组质粒进行PCR鉴定,结果与预期片段大小一致,P1、P2、P3以及P4的片段大小分别为2 692、2 180、1 762和1 281bp。表明4个植物表达载体构建成功,分别命名为P1∷GUS、P2∷GUS、P3∷GUS 和 P4∷GUS(图4)。
2.4 转基因毛状根的PCR鉴定
将重组质粒P1∷GUS、P2∷GUS、P3∷GUS和P4∷GUS以及阳性对照质粒35S∷GUS转入发根农杆菌ATCC15834,然后分别侵染虎杖叶片。暗培养1个月后,选取潮霉素抗性平板上生长良好的毛状根,提取毛状根基因组DNA并PCR检测Hyg(图5-A)和GUS(图5-B)。野生型毛状根均无特异基因扩增条带,阳性对照35S∷GUS毛状根能检测出GUS和 Hyg,并 且 P1∷GUS、P2∷GUS、P3∷GUS和P4∷GUS毛状根也均能检测出GUS和Hyg,且Hyg实际大小为500 bp,GUS实际大小为1 080 bp,说明成功获得转基因毛状根。

图3 PcMYB1启动子的分析Fig.3 Analysis of PcMYB1 promoter

表2 PcMYB1启动子顺式作用元件预测分析Table 2 PcMYB1 promoter cis-acting element prediction analysis
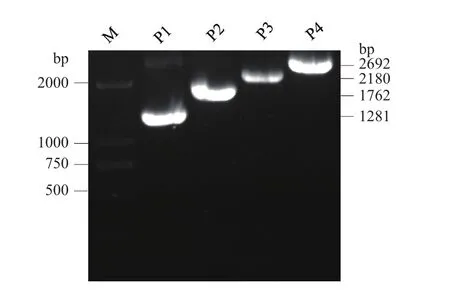
图4 重组载体的PCR鉴定Fig.4 PCR identification of recombinant vectors
2.5 转基因毛状根GUS组织化学染色
对转基因毛状根进行GUS染色,野生型毛状根不能染成蓝色,阳性对照35S∷GUS毛状根呈蓝色,P1∷GUS、P2∷GUS、P3∷GUS和 P4∷GUS毛状根也均能染成蓝色,但与阳性对照相比颜色较浅。证明全长启动子P1(-2 884-+1)和3个5′端缺失启动子 P2(-2 259-+1)、P3(-1 807-+1)、P4(-1 362-+1)均能驱动GUS报告基因的表达,但启动活性都比CaMV35S启动子的启动活性弱(图6)。
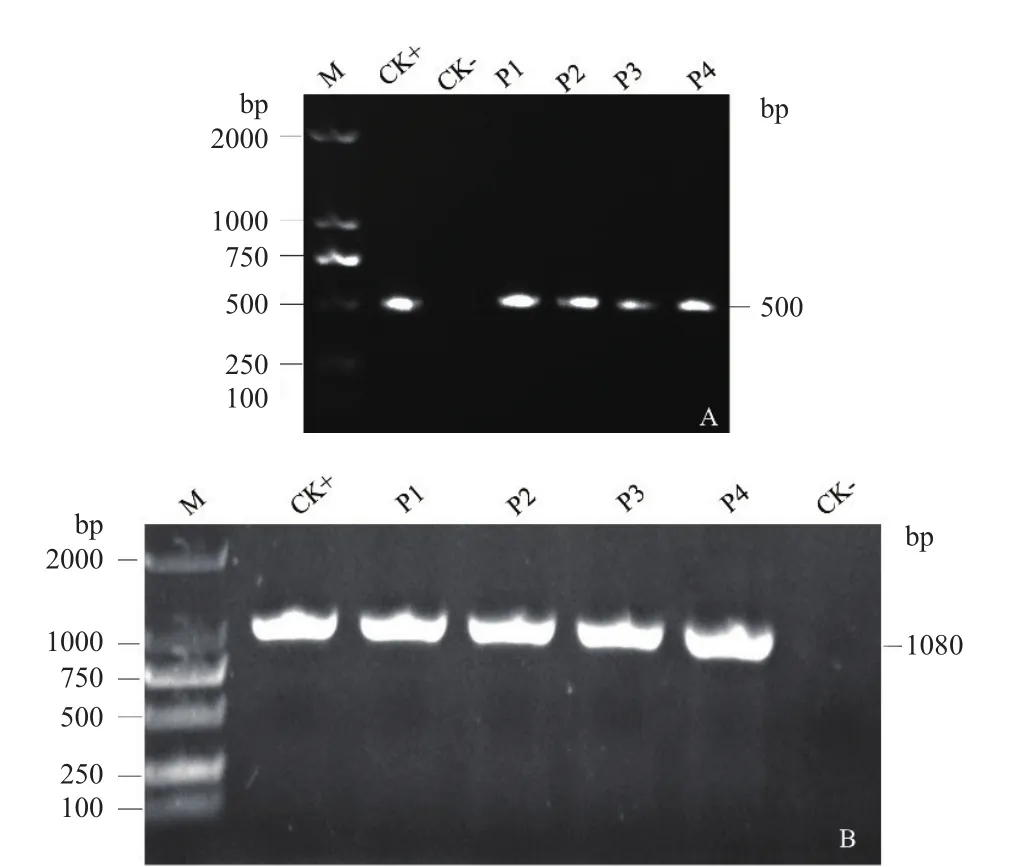
图5 转基因毛状根的Hyg(A)和GUS(B)检测Fig.5 Hyg (A) and GUS (B) detection of transgenic hairy roots
3 讨论
启动子是研究基因功能的重要组成部分,通常包含多种不同的顺式作用元件,与基因功能调节有关。目前,从药用植物中克隆启动子已有不少报道,如从黄花蒿(Artemisia annua L.)中克隆了乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)基因启动子[9],从刺五加(Eleutherococcus senticosus)中克隆法尼基焦磷酸合酶(farnesyl diphosphate synthase,FPS)基因启动子[10],从阳春砂(Amomum villousm)中克隆萜类合酶基因AvTPS1启动子[11],从滇龙胆(Gentiana rigescens Franch.ex Hemsl.)中克隆环烯醚萜氧化酶(iridoid oxidase,CrIDO)基因的启动子[12]。但是虎杖相关基因启动子的克隆鲜有报道。本研究在前期获得PcMYB1的cDNA序列的基础上,利用hiTAIL-PCR成功获得了PcMYB1启动子序列。

图6 转基因毛状根的GUS组织化学染色Fig.6 GUS histochemical staining of transgenic hairy roots
通过生物信息学分析,本研究克隆的PcMYB1启动子具有CAAT-box和TATA-box等丰富的核心调控元件。并且PcMYB1启动子在-1 021、-1 147和-1 808 bp处有3个茉莉酸甲酯响应元件(CGTCA-motif),在-1 072和-2 713 bp处有2个茉莉酸甲酯响应元件(TGACG-motif)。大豆GsMYB15启动子含有茉莉酸甲酯响应元件,该基因通过MeJA信号途径对虫害触发的植物自身免疫反应进行调控[13]。水稻萜类合成酶基因启动子PRJA140含有多种茉莉酸甲酯响应元件,对其启动子活性分析表明该基因的表达不仅受茉莉酸甲酯诱导,同时受白叶枯菌诱导,可以用于水稻的抗性改良[14]。在荞麦中,FtMYB13、FtMYB14、FtMYB15和 FtMYB16的表达均受茉莉酸甲酯诱导,进而抑制荞麦中的芦丁生物合成[15]。本研究PcMYB1启动子含有多个响应MeJA的元件,但该基因启动子是否存在茉莉酸甲酯调节机制有待深入研究。很多MYB转录因子的启动子中含有光响应元件,如荔枝LcMYB1[16]和葡萄VvMYBF1[17]启动子含有多个光响应元件,其启动子活性受到光的诱导,进而调控原花青素生物合成。PcMYB1启动子中也存在数量较多的光反应元件,推测该基因的表达可能受光的调控。前期实验发现紫外照射处理可诱导虎杖叶片中PcMYB1的高表达[6],表明PcMYB1可能响应紫外胁迫,但是PcMYB1响应紫外机制还有待探究。启动子序列中低温反应元件(LTR)与抗寒相关。麻风树(Jatropha curcas L.)的JcHKL1和JcHKL2启动子包含LTR元件,低温条件下能显著提高麻风树的抗寒能力[18]。PcMYB1启动子中也发现LTR元件,是否参与抗寒仍需试验证明。
4 结论
获得PcMYB1的启动子序列长为2 884 bp,PcMYB1启动子包含多个保守元件。通过毛状根遗传转化以及GUS组织化学染色证明PcMYB1启动子具有启动活性。

