华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠生殖能力的影响
郑环宇,高加龙,2,章超桦,2,司 蕊,郑惠娜,2,曹文红,2,秦小明,2
(1.广东海洋大学食品科技学院/国家贝类加工技术研发分中心 (湛江) /广东省水产品加工与安全重点实验室/广东省海洋生物制品工程实验室/水产品深加工广东普通高等学校重点实验室,广东 湛江 524088;2.大连工业大学/海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
华贵栉孔扇贝 (Chlamys nobilis) 隶属瓣鳃纲、珍珠贝亚目、扇贝科[1],为暖水性贝类,是我国南方海域的主要养殖经济贝类之一。其味道鲜美、营养丰富,富含精氨酸、牛磺酸、硒元素、VE等营养物质[2];该贝类生长快且不易储存,除鲜销及加工成干制品外,深加工利用价值低。目前,对华贵栉孔扇贝的研究主要集中在遗传育种[3]、水产养殖[4]等方面,利用其进行生物活性方面的研究鲜有报道。
性欲障碍、勃起功能障碍和射精障碍等症状是男性常见的多发性疾病,其中勃起功能障碍 (Eretile dysfunction, ED) 指男子在性刺激下,持续无法维持足够硬度的阴茎勃起以获得满意的性表现[5]。目前,ED已成为困扰全球男性的重要疾病之一,1995年全世界男性ED患者约1.52亿人,预计到2025年将增至3.22亿人[6]。原发性性腺机能减退及疾病、创伤等原因造成的睾丸损伤均可导致雄性性激素水平下降、引发ED等性功能障碍问题[7]。目前,营养药品和膳食补充剂成为治疗性功能障碍的一种可行选择[8],随着对性健康认识的提高,男性群体对改善性功能障碍膳食补充剂的需求也逐渐增加。研究表明,海洋生物资源如海马[9]、海参[10]、贻贝[11]、牡蛎[12-13]等均对男性生殖能力具有良好的保护作用,是制备此类膳食补充剂的良好来源。据《动物本草》记载,扇贝可滋阴补肾、调中,主治阴虚劳损、肾虚腰痛、遗精等症[14]。为探究富含精氨酸、硒 (Se) 元素等营养物质的华贵栉孔扇贝是否有改善男性生殖能力障碍的功效,本研究对SD雄性大鼠进行半去势手术,建立雄性大鼠生殖能力减退模型,考察华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠生殖能力及血清性激素水平等的影响,以期为挖掘扇贝的生理功效及开发扇贝作为改善男性生殖能力障碍的膳食补充剂提供理论依据。
1 材料与方法
1.1 材料与实验动物
华贵栉孔扇贝于2019年7月采自广东省雷州市覃斗镇养殖场,开壳取肉并去除内脏团、足丝得扇贝可食部分,于−40 ℃冻藏备用。
SPF级SD雄性大鼠40只,体质量约 (300±20) g;SPF级SD雌性大鼠40只,体质量 (280±20) g [ 使用许可证号 SCXK (鲁) 20190003]。于相对湿度50%~60%、温度 (24±2) ℃下自由进食饲养。
1.2 试剂与仪器
动物蛋白酶,酶活力 13×104U·g−1(广西南宁庞博生物有限公司);枸橼酸西地那非 (国药准字H20020526,辉瑞制药有限公司);水合氯醛 (上海源叶生物科技有限公司);大鼠睾酮 (T)、大鼠促黄体激素 (LH)、大鼠促卵泡生长激素 (FSH) ELISA试剂盒 (江苏酶免实业有限公司);一氧化氮 (NO)测定试剂盒、总一氧化氮合成酶 (NOS) 测试盒、考马斯亮蓝总蛋白测定试剂盒 (南京建成生物工程研究所)。注射用头孢噻呋钠 (抗生素,艾美科健生物医药有限公司);苯甲酸雌二醇注射液、黄体酮注射液 (宁波第二激素厂);其余试剂均为分析纯。
FA1004分析天平 (上海舜宇恒平科学仪器有限公司);VAPODEST-450全自动凯氏定氮仪 (德国格哈特分析仪器有限公司);L-8900全自动氨基酸分析仪 (株式会社日立制作所);G50组织研磨仪(卡尤迪生物科技有限公司);Thermo Varioskan Flash多功能全自动酶标仪;Lynx6000高速落地离心机 (美国Thermo公司);N-4000大型旋转蒸发仪(东京理化器械株式会社);FDU-1100型真空冷冻干燥机 (东京理化器械株式会社);ZS-YLS-9A生理、药理电子刺激仪 (上海众实迪创科技发展有限公司);UV-5100紫外分光光度计 (上海元析仪器有限公司)。
1.3 方法
1.3.1 贝肉及其酶解产物的制备 根据前期优化的酶解工艺条件制备华贵栉孔扇贝肉酶解产物。取冻藏华贵栉孔扇贝肉可食用部位,于 (−18±1) ℃暂贮24 h后转至 (4±1) ℃解冻,洗净沥干匀浆。匀浆液经冷冻干燥得华贵栉孔扇贝肉试样 (CN);另取匀浆液加蒸馏水至料液质量体积比为1∶3,调节pH至7.0,按3 000 U·g−1加入动物蛋白酶,于50 ℃ 恒温水浴中酶解4 h,沸水浴灭酶15 min,迅速冷却后经8 000 r·min−1离心20 min,过滤收集上清液,旋蒸浓缩后经冷冻干燥得华贵栉孔扇贝肉酶解产物试样 (CNH);测得CNH的水解度为29.87%。
1.3.2 基本成分测定 水分:常压干燥法 (GB 5009.3—2016);粗蛋白:凯氏定氮法 (GB 5009.5—2016);粗脂肪:索氏提取法 (GB 5009.6—2016);灰分:高温灼烧法 (GB 5009.4—2016);总糖:苯酚-硫酸法 (GB/T 9695.31—2008)。
1.3.3 氨基酸组成测定 贝肉酶解产物氨基酸按照食品安全国家标准GB 5009.124—2016进行测定。
1.3.4 微量元素测定 贝肉酶解产物的铁 (Fe)、锌 (Zn)、Se、铜 (Cu)、锰 (Mn) 按照国家标准GB 5009.268—2016的微波消解-电感耦合等离子体-质谱法进行测定。
1.3.5 实验动物去势模型构造 对32只SD雄性大鼠进行半去势手术,经15%水合氯醛麻醉消毒后,于大鼠阴囊部右侧作1 cm左右切口,分离右侧睾丸及附睾,在附睾头尾之间结扎,摘除右侧睾丸;另取8只SD雄性大鼠在阴囊部位作1 cm左右切口,不摘除睾丸,行假手术[15]。各组大鼠手术后使用注射用头孢噻呋钠 (抗生素) 15 mg·kg−1,注射3 d,同时对伤口进行碘酊消毒,防止感染。
对SD雌性大鼠进行全去势手术,经15 mg·kg−1盐酸赛拉嗪麻醉后,剪除两侧背部手术区毛发并消毒,以大鼠最后一肋与大腿根部连线的中点皮肤处行1 cm切口,肌肉层行0.5 cm的切口,挤压肾脏后下侧包裹卵巢的脂肪团,结扎后摘除卵巢[16]。两侧同法。手术后使用注射用头孢噻呋钠 (抗生素)30 mg·kg−1,注射3 d,同时对伤口进行碘酊消毒,防止感染。
1.3.6 实验动物分组 将恢复性饲养2周的半去势SD雄性大鼠32只随机分为4组,每组8只,分别为阳性对照组 (PC)、阴性对照组 (SM)、华贵栉孔扇贝肉酶解产物组 (CNH)、华贵栉孔扇贝肉组(CN);另行假手术的8只SD雄性大鼠作为空白对照组 (NC)。NC、SM 组灌胃生理盐水 1.5 mL·(kg·d)−1;PC 组灌胃枸橼酸西地那非 1.5 mg·(kg·d)−1;CNH、CN 组分别灌胃试样 1.3 g·(kg·d)−1。灌胃 7 周,期间大鼠自由进食饮水。
1.3.7 实验动物性行为表现 行为学实验于灌胃48 d后进行。实验前48 h对雌性去势大鼠皮下注射苯甲酸雌二醇注射液200 μg·kg−1,雌雄合笼前4 h皮下注射黄体酮注射液2 mg·kg−1,以获得发情良好的雌鼠[17]。实验于20:00—24:00进行,实验前将雄鼠放置观察箱 (30 cm × 40 cm × 40 cm) 中适应10 min,用高清摄像头记录。从放进雌鼠起开始记录,观察前30 min,并记录大鼠的扑捉次数、骑乘次数、扑捉潜伏期、骑乘潜伏期[18-19]、勃起潜伏期。扑捉次数为雄鼠嗅闻雌鼠尾根部后进行扑捉雌鼠行为的次数;扑捉潜伏期为放入雌鼠后,至发生第一次扑捉行为的时间;骑乘次数为雄鼠扑捉雌鼠后进行交配行为的次数 (有无射精都计,即雄性大鼠发生骑乘行为后舔舐阴茎的表现);骑乘潜伏期为放入雌鼠后,至发生第一次骑乘行为的时间;勃起潜伏期为生理、药理电子刺激仪正负极置于雄性大鼠阴茎根部,仪器参数为电流强度为4 mA,波宽为100 mS,电压为0.2 V,记录大鼠从电极接触阴茎开始至阴茎勃起的时间[20]。
1.3.8 附性腺脏器系数的测定 末次给药后称质量麻醉,眼球取血后迅速分离出大鼠左侧睾丸、阴茎、附睾、精囊腺-前列腺组织,并使用电子天平称质量 (g),计算脏器系数[21]。

1.3.9 血清性激素水平测定 眼球取血后室温自然凝固 15 min,经 3 000 r·min−1离心 15 min,收集上层血清,用于测定血清中的T、FSH和LH。
1.3.10 阴茎组织NO和NOS的测定 分离大鼠阴茎组织,剪除阴茎的表面皮肤、阴茎头,于冰浴中剪碎匀浆、离心,取上清液,使用考马斯亮蓝法测定组织蛋白质含量;硝酸还原法测定NO浓度,比色法测定NOS活力。
1.4 数据统计分析
采用JMP 10和Origin 9.0软件进行数据分析与绘图。结果以“平均值±标准差 ()”表示。对数据进行组间差异性显著分析,执行最小二乘均值studentt检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 华贵栉孔扇贝肉及其酶解产物的基本组成
CN及CNH的基本营养成分见表1,以干质量计,CN与CNH蛋白质质量分数较高 (分别为75.48%与76.14%);经酶解后CNH的脂肪质量分数较低 (仅0.77%)。由此可见,华贵栉孔扇贝是一种高蛋白低脂肪的海洋食物。
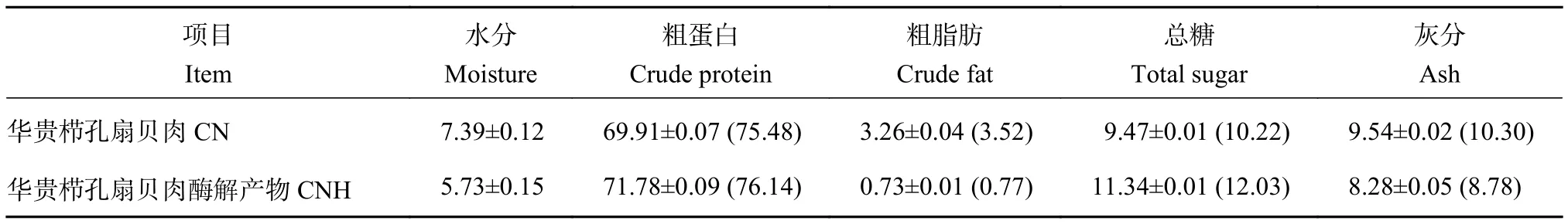
表1 华贵栉孔扇贝肉及其酶解产物的基本成分Table 1 Content of basic component in C.nobilis and its enzymatic hydrolysates %
2.2 华贵栉孔扇贝肉及其酶解产物的氨基酸组成
Tan等[22]报道华贵栉孔扇贝含有大量易于消化且符合人类膳食需求的必需氨基酸,可改善生物体的生长、发育、繁殖等生理机能。本研究测到华贵栉孔扇贝肉及其酶解产物含16种氨基酸 (表2),两者的必需氨基酸有7种,水解必需氨基酸与总氨基酸的比值 (EAA/TAA) 分别为32.85%、34.35%,游离EAA/TAA分别为5.24%、41.73%,所含氨基酸构成较均衡。CNH的水解支链氨基酸 (缬氨酸、异亮氨酸、亮氨酸) 含量较高,占氨基酸总量的16.21%,补充适量的支链氨基酸对精子功能和睾丸激素的产生有促进作用[23];CN、CNH水解氨基酸中精氨酸质量分数分别为13.07、20.90 g·kg−1,游离氨基酸中的精氨酸质量分数分别为56.04、55.16 g·kg−1,其中L-精氨酸能在NOS的催化下合成NO,产生瓜氨酸[24],是促进生殖激素发生的潜在物质。
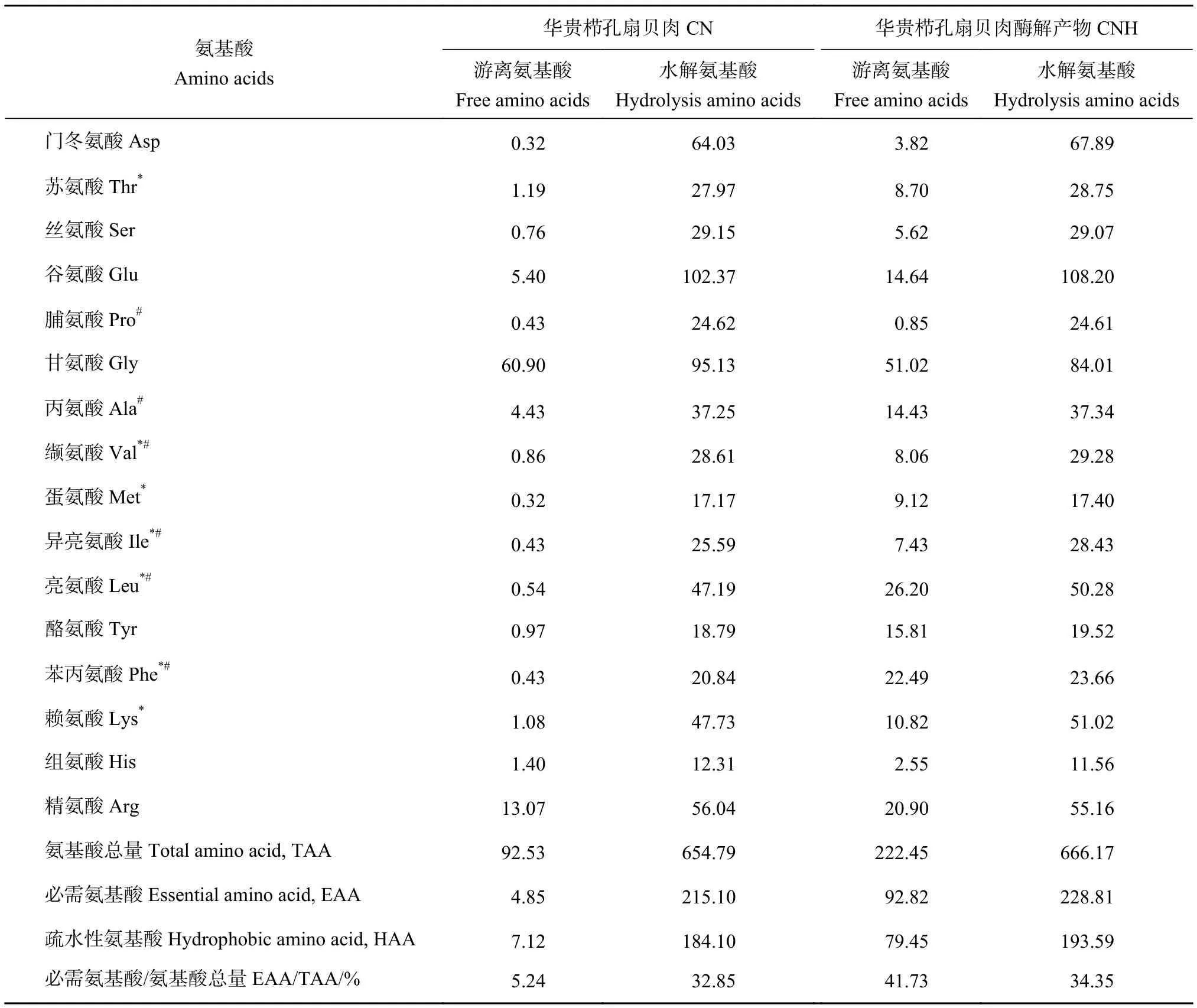
表2 华贵栉孔扇贝肉及其酶解产物的氨基酸组成 (干质量)Table 2 Amino acid composition of C.nobilis and its enzymatic hydrolysates (dry mass) g·kg−1
2.3 华贵栉孔扇贝肉及其酶解产物的微量元素含量
华贵栉孔扇贝肉的微量元素Zn、Fe、Mn、Cu、Se质量分数分别为114.51、691.76、20.46、5.19、2.87 mg·kg−1;华贵栉孔扇贝肉酶解产物的Zn、Fe、Mn、Cu、Se质量分数分别为84.13、32.59、8.20、1.28、1.22 mg·kg−1。Se 是人体精子发生必需的微量元素,由Se参与组成的谷胱甘肽过氧化物酶4 (GPx4),是人体内唯一可直接降解磷脂氢肽过氧化物 (PHGPx) 的酶,对调控睾丸组织中的精子发生与成熟起重要作用[25-26]。另外,Zn是维持睾丸生精细胞、促进精子发生并调节精子活力的必需微量元素[27]。
2.4 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠性行为表现的影响
扑捉、骑乘等指标可反映雄性大鼠性行为的能力[28]。各组大鼠性行为情况见表3,对SD雄性大鼠行半去势手术后,阴性对照组扑捉行为、骑乘行为显著减少 (P<0.05)、潜伏期显著延长 (P<0.05)。与对照组相比,CN、CNH两组大鼠扑捉次数和骑乘次数均有不同程度的增加,扑捉潜伏期和骑乘潜伏期均有不同程度的缩短。其中,CN组大鼠的扑捉次数和骑乘次数相较于阴性对照组显著增加(P<0.01);CNH组大鼠的扑捉潜伏期与骑乘潜伏期相较于阴性对照组显著缩短 (P<0.05),且改善效果优于阳性对照组。性行为表现结果说明CN和CNH组均有提高大鼠性欲、改善半去势雄性大鼠性行为的功效,且CNH组的改善作用更佳。
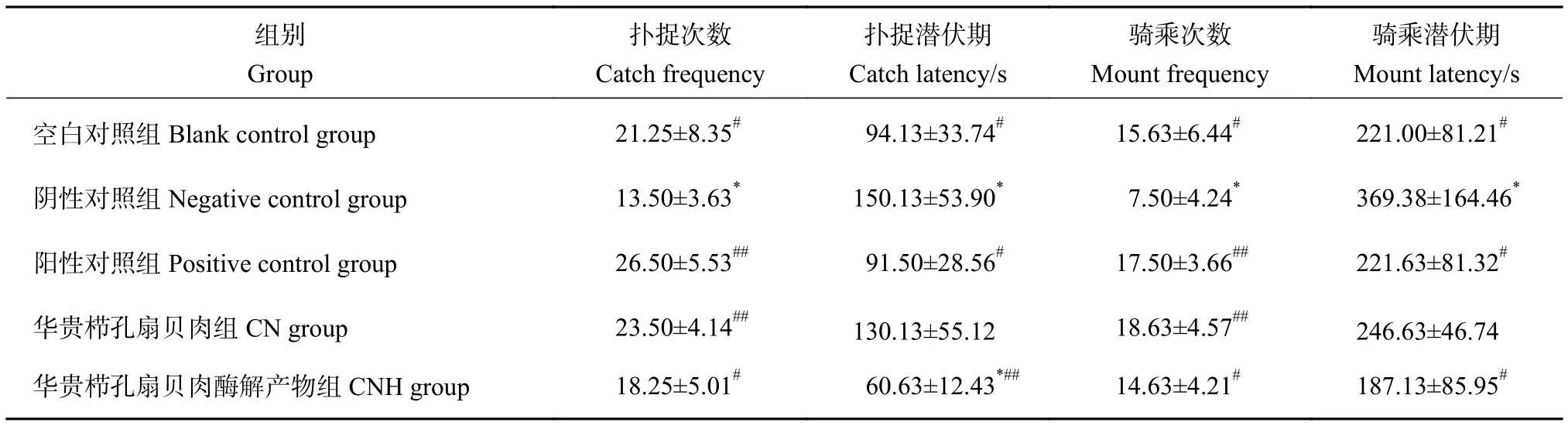
表3 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠性行为表现的影响Table 3 Effects of C.nobilis and its enzymatic hydrolysates on sexual behavior in hemi-castrated male rats
2.5 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠勃起潜伏期的影响
使用微弱电流刺激阴茎勃起,可直观地判断样品是否能改善大鼠勃起功能障碍。各组大鼠勃起潜伏期见图1,对雄性大鼠行半去势手术后阴茎勃起潜伏期显著延长 (P<0.01),阳性对照组能明显改善大鼠的阴茎勃起潜伏期 (P<0.01)。与阴性对照组相比,CN和CNH组均显著缩短了半去势雄性大鼠的阴茎勃起潜伏期 (P<0.01),但高于空白对照组。其中,CNH组的改善效果好于CN组,与阳性对照组的效果相当。
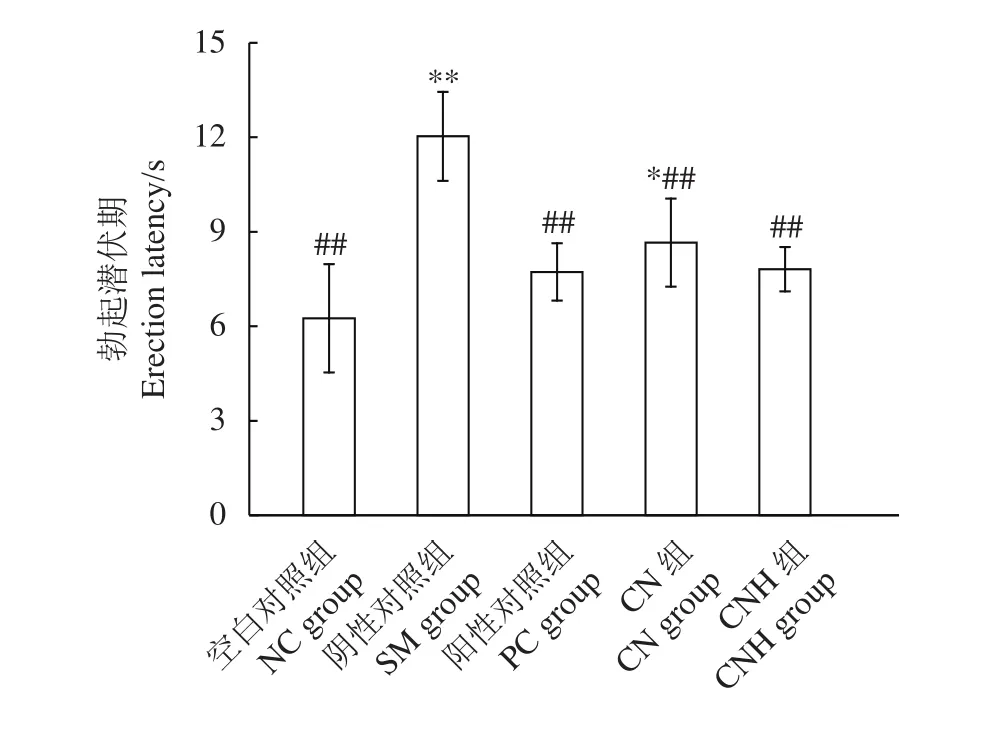
图1 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠勃起潜伏期的影响Figure 1 Effects of C.nobilis and its enzymatic hydrolysates on erection latency in hemi-castrated male rats
2.6 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠脏器系数的影响
CN和CNH对半去势雄性大鼠脏器系数的影响见表4,不同组大鼠的左侧睾丸、精囊腺-前列腺等性腺器官系数显示出不同的变化。与阴性对照组相比,CN和CNH组大鼠精囊腺-前列腺的质量及脏器系数显著增大 (P<0.01)。前列腺和精囊腺的质量变化可以作为一个良好的、相对快速反映雄激素水平变化的指标[29]。各组雄性大鼠的附睾系数均无显著性变化。CN和CNH组的左侧睾丸系数,相比阴性对照组与空白对照组,差异均达到显著水平 (P<0.05)。结合激素水平结果,左侧睾丸系数的增大可能与睾丸代偿[30]有关。雄激素具有刺激附性腺器官细胞增殖、增大的作用,因而能使雄性动物的附性腺器官系数增加的样品具有雄激素样作用,并可通过系数的变化程度判断雄激素样作用强度[31]。
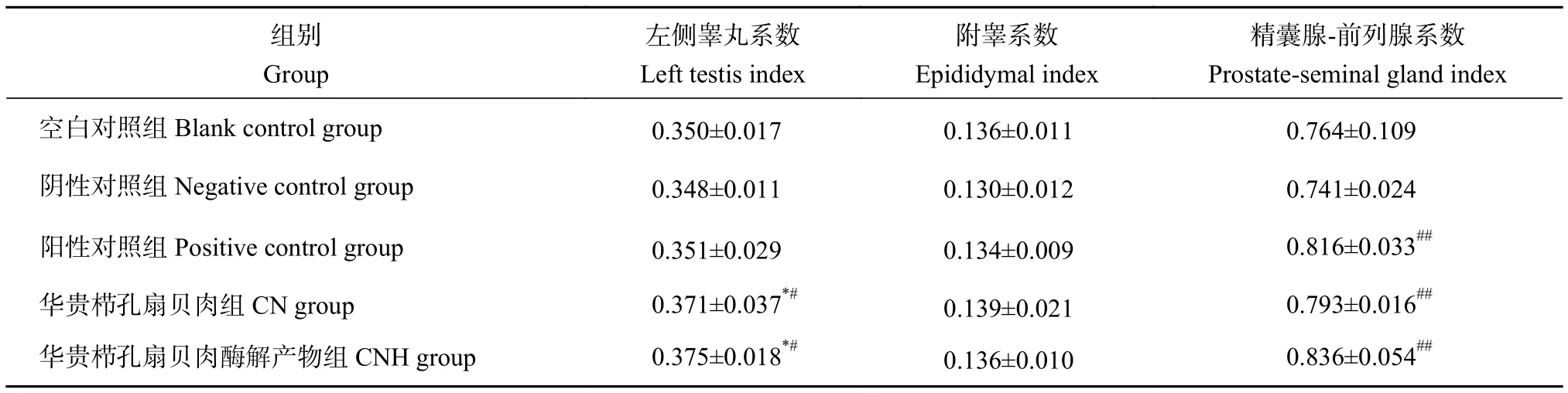
表4 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠脏器系数的影响Table 4 Effects of C.nobilis and its enzymatic hydrolysates on organ coefficient in hemi-castrated male rats
2.7 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠血清激素水平的影响
CN和CNH对半去势雄性大鼠血清T的影响结果见图2-a。对SD雄性大鼠行半去势手术后,阴性对照组大鼠的T浓度显著降低 (P<0.01),灌胃CN和CNH后,半去势雄性大鼠血清T的浓度较阴性对照组显著上升 (P<0.01),但低于空白对照组 (P<0.05) 与阳性对照组。对于FSH,各组均显著高于空白对照组 (P<0.01,图2-b),CN、CNH组FSH低于阴性对照组,但无显著性差异。
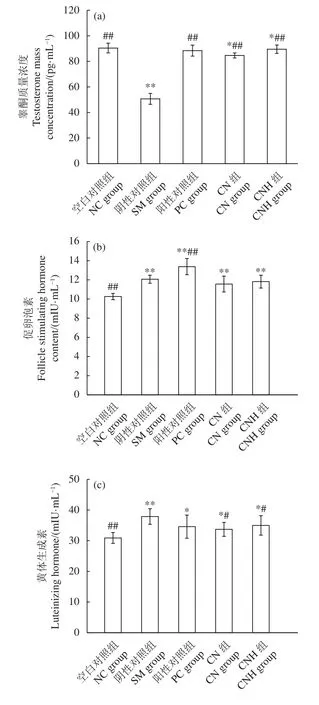
图2 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠血清睾酮、促卵泡激素和黄体生成素的影响Figure 2 Effects of C.nobilis and its enzymatic hydrolysates on serum testosterone, follicle stimulating hormone and luteinizing hormone in hemi-castrated male rats
LH的变化结果见图2-c,CN、CHN组LH浓度显著高于空白对照组 (P<0.05),显著低于阴性对照组 (P<0.05);CHN组略高于CN组,与阳性对照组水平相当。LH和FSH分别作用于睾丸间质细胞和睾丸支持细胞,调节性腺发育及生精过程,两者通过反馈调节介导睾丸组织分泌雄性激素T,进而刺激雄性器官的发育并维持其生理功能[32]。对大鼠行半去势手术后,T分泌量的减少介导“下丘脑-垂体-睾丸轴”的正反馈调节,促使下丘脑分泌更多的黄体生成素释放激素,进一步刺激垂体释放LH;同时半去势引起类固醇激素或来自支持细胞的非类素 (抑制素B) 的下降,通过正反馈作用,促使垂体前叶分泌更多的FSH[15]。本实验结果表明CN和CNH均能介导“下丘脑-垂体-睾丸轴”,调节半去势雄性大鼠的血清性激素至正常大鼠水平。
2.8 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠阴茎组织NO、NOS的影响
各组大鼠阴茎组织的NO、NOS变化见图3。对雄性大鼠行半去势手术后,阴性对照组大鼠阴茎组织的NO浓度和NOS活性显著降低 (P<0.01),与阴性对照组相比,阳性对照组、CNH组NO浓度均显著提高 (P<0.01),且优于CN组 (P<0.05)。CN和CNH组均能显著提高大鼠阴茎组织中的NOS活性 (P<0.05),与阳性对照组的效果相当。有研究表明,T可介导和维持雄性动物生殖器官内NOS活性,并在勃起期间刺激神经型一氧化氮合酶 (nNOS) 基因表达并诱导阴茎海绵体和阴茎动脉生成NO[33]。大鼠去势后,阴茎组织中的NOS活性明显降低,影响L-arg-NO-cGMP通路[34],导致NO生成量减少。NO通过阴茎海绵体内皮细胞释放,形成cGMP,引起阴茎海绵体平滑肌松弛。对大鼠行半去势后,T水平明显下降,引起血清-1-磷酸鞘氨醇 (S1P) 的变化,S1P1受体减少,S1P2、S1P3受体增加,导致RhoA/Rho激酶途径上调,抑制内皮型一氧化氮合酶 (eNOS) 活性以降低NO的产生[35]。NOS活力和NO水平明显降低,引起大鼠勃起功能障碍。本研究表明,CN和CNH可通过增加大鼠阴茎NO的释放、提高NOS活力来增强阴茎勃起能力,从而达到改善生殖能力的目的。
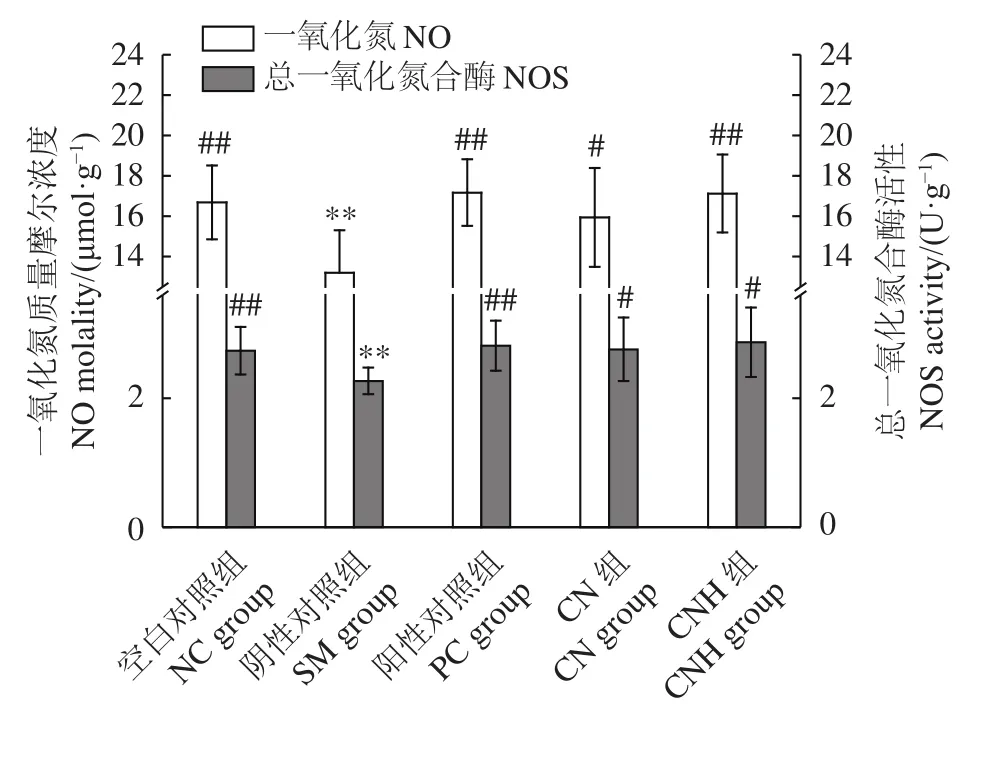
图3 华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠阴茎一氧化氮和总一氧化氮合酶活性的影响Figure 3 Effects of C.nobilis and its enzymatic hydrolysates on NO and NOS in penile tissue of hemi-castrated male rats
3 结论
本文通过动物实验研究了华贵栉孔扇贝肉及其酶解产物对半去势雄性大鼠生殖能力的改善作用。结果表明,华贵栉孔扇贝肉及其酶解产物均具有显著缩短半去势雄性大鼠勃起潜伏期、增加骑乘次数等性行为表现的作用,同时能够增大附性腺器官的脏器系数,具有稳定大鼠血清性激素水平、介导NO和NOS生成等功效。酶解产物的效果优于贝肉,但对于改善雄性大鼠生殖能力活性成分的解析还有待进一步研究。

