实时多影像融合介入导航系统引导下纳米刀消融治疗局部进展期胰腺癌的效果与安全性分析
苏东朝,李晓勇,陈艳军,杨金雨,陈升阳,胡水全,仝 昊
郑州大学第五附属医院 肝胆胰腺外科,郑州 450052
胰腺癌是一种侵袭性强、预后极差的消化道恶性肿瘤,其5年生存率不足10%[1-2]。根治性切除是胰腺癌患者获得长期生存治疗方式,但因其起病隐匿,确诊时仅15%患者有切除机会,55%患者已出现远处转移,30%~40%患者因肿瘤浸润或包绕腹腔大血管而无早期根治性切除机会,称为局部进展期胰腺癌(locally advanced pancreatic cancer,LAPC)[2]。目前,LAPC治疗以化疗或放化疗为主,但经治患者中位生存期很低[3]。远处转移是LAPC进展的主要形式,但30%~40%的患者死亡为肿瘤局部进展破坏造成而非远处转移[4],因此应当重视肿瘤局部破坏的治疗。由于LAPC周围组织结构复杂,射频消融治疗LAPC时容易对肿瘤周围重要组织造成非选择性热损伤,安全性低。不可逆电穿孔(irreversible electroporation,IRE)可利用高压电脉冲击穿细胞膜,使细胞内环境造成紊乱继而导致细胞凋亡,达到杀灭肿瘤的目的。IRE不依赖热能的选择性特性可保护胰腺肿瘤周围的重要组织结构,且无热沉效应,对肿瘤消融更彻底[5-6]。目前,国内对于经皮穿刺IRE消融LAPC的报道较少,本研究旨在评估实时多影像融合介入导航系统(real-time virtual sonography,RVS)引导下经皮穿刺消融治疗LAPC的安全性及有效性。
1 资料与方法
1.1 研究对象 回顾性收集2018年4月—2019年10月于本院就诊的LAPC患者的临床资料,按治疗方式分为IRE联合化疗(联合组)和单纯化疗组(对照组),化疗方案均为吉西他滨+替吉奥。
1.2 纳入及排除标准 纳入标准:(1)评估增强CT/MRI、肿瘤标志物结合病理学检查确诊为胰腺癌;(2)参照美国癌症联合会第8版胰腺癌TNM分期标准[7],Ⅱ~Ⅲ期的患者;(3)预计存活时间至少3个月以上;(4)无明显心、肺功能障碍者;(5)不耐受或不接受开腹纳米刀消融患者,自愿选择经皮穿刺消融治疗;(6)术后能够耐受辅助化疗者;(7)依从性良好,接受长期随访。排除标准:(1)不耐受全麻手术;(2)伴有严重的心、肺功能障碍;(3)具有严重心律失常或安装心脏起搏器、心脏支架者;(4)具有严重的凝血功能障碍者;(5)出现消化道梗阻者;(6)依从性差,不接受定期随访者。
1.3 仪器与材料 IRE 肿瘤治疗系统(NanoKnife System,美国Angio Dynamics公司),由高能直流发生器(电流25~45 A,电压1500~3000 V)、心电同步仪及电极针组成。ARIETTA 70实时多影像融合介入导航系统(Real-time Virtual Sonography,日本日立公司),使用型号为C25P的超声探头。
1.4 治疗过程
1.4.1 术前准备 影像学检查评估肿瘤位置、大小、比邻结构,初步制订进针方案;完善血常规、血生化、凝血、心电图等检查,了解一般情况;出现黄疸的胰头部肿瘤患者给予经皮肝穿刺胆道外引流或胆道支架植入。
1.4.2 手术过程 (1)全麻后,将增强CT/MRI(层厚1 mm)导入RVS,寻找肿瘤周围特定血管或易辨别血管共同显示清晰的CT/MRI时相,进行肿瘤边缘标记,使用超声无菌探头于腹部进行肿瘤定位,根据肿瘤和血管走向将实时超声界面与CT/MRI界面进行联动,移动探头在多个层面进行解剖验证,发现错位时进行微调(图1)。(2)双重定位肿瘤,测量肿瘤大小,将参数导入IRE系统,制订布针方案。(3)选择最佳进针点,经皮穿刺进入腹腔,穿过胃壁或横结肠系膜至肿瘤边缘,避开重要血管及组织结构。使用15 cm单极消融电极针主针1根,辅针1~2根布针,电极针两两间相距1.5~2.0 cm,暴露消融电极1.5~2.0 cm。(4)采用直流(25 A)高压(1500~2500 V)电脉冲依次消融。每次消融由连续70~90 ms、7~10组(10次脉冲/组),共70~100次脉冲组成。(5)肿瘤体积大时,可退针继续消融或再次布针消融,直至肿瘤完全消融。

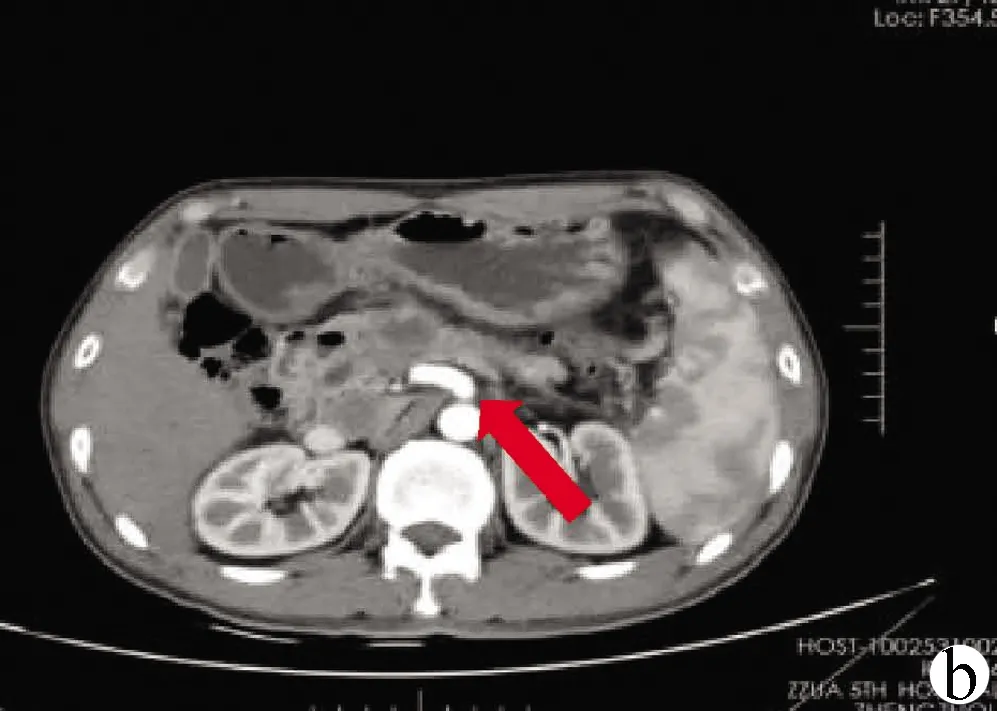
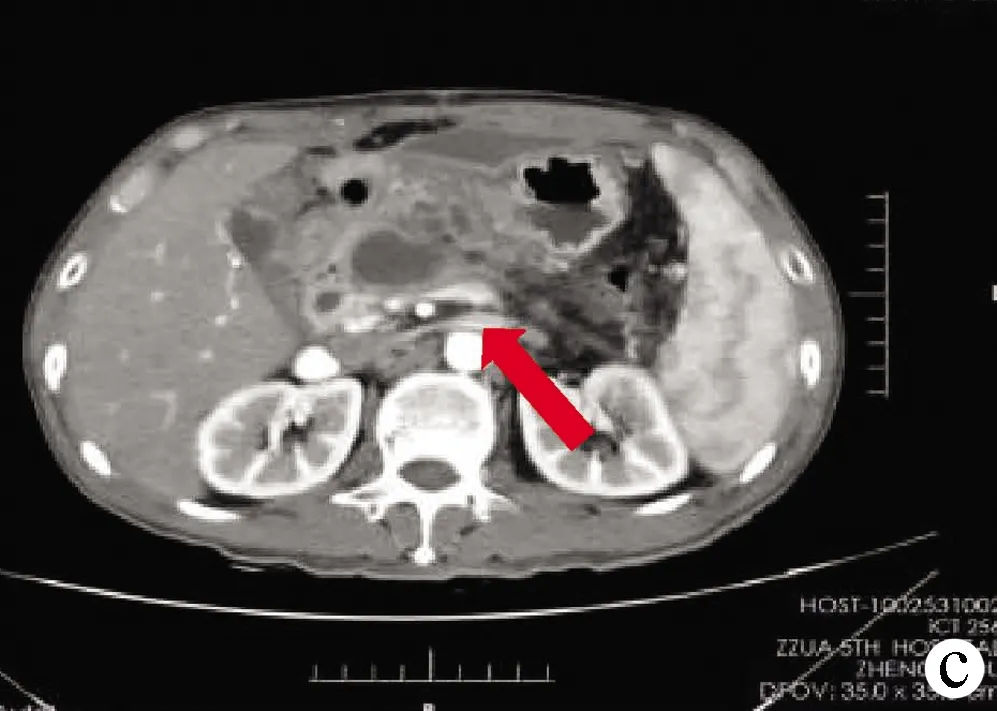
注:a,RVS对病灶精确定位后制订布针分案;b,术前CT可见肿瘤位于胰颈部,侵犯门静脉及脾静脉可能(箭头处);c,术后2周CT可见消融区域组织液化,密度降低(箭头处)。
1.4.3 术后治疗 术后监测生命体征,出现不适对症处理。联合组患者于术后2周开始全身化疗。化疗方案为静脉注射吉西他滨1000 mg/m2(第1、8天,每3周重复),同时口服替吉奥,40~60 mg/d,2次/d,持续14 d,每3周重复,术后接受4~6个疗程化疗。对照组化疗方案同上。
1.5 治疗后评价
1.5.1 安全性评价 (1)观察术中患者各项生命体征指标;(2)观察消融区域周围大血管及组织有无损伤及出血;(3)比较术前1 d与术后1、3、7、14、30 d的血淀粉酶及心肌酶指标;(4)使用Clavien-Dindo分级标准对围手术期并发症进行诊断分类。
1.5.2 疗效性评价 (1)比较2组治疗前与治疗后7、14、30、60、90 d的CA19-9水平变化;(2)评估2组患者治疗前及治疗后3个月腹部增强CT,观察肿瘤控制情况,参照mRECIST标准[8]进行评价(表1);(3)使用Kaplan-Meier法对2组患者随访期内的生存状态进行分析。总生存期(OS)定义为从治疗之日起至死亡或最后1次随访时间;无进展生存期(PFS)定义为从治疗之日起至疾病进展时间或最后1次随访时间。2组自治疗后定期复查,前半年每个月复查1次,半年后2个月复查1次。总体随访时间6~28个月。
1.6 伦理学审查 本研究经由郑州大学第五附属医院伦理委员会批准,批号:KY2020002。所有患者均知情同意。

表1 mRECIST评价标准
1.7 统计学方法 采用SPSS 21.0软件进行统计分析。不符合正态分布的计量资料以M(P25~P75) 表示,2组间比较采用Mann-WhitneyU秩和检验,组内比较采用Wilcoxon秩和检验;计数资料2组间比较采用Fisher精确检验;Kaplan-Meier法分析患者随访期内的生存状态。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入LAPC患者27例,其中联合组12例,年龄47~80岁;对照组15例,年龄48~71岁。2组患者性别、年龄、肿瘤部位/最大直径/分期比较差异均无统计学意义(P值均>0.05)(表2)。
2.2 安全性评价 联合组患者均成功完成纳米刀消融,术中、术后生命体征平稳。术中超声显示消融区域周围大血管血流动力学稳定。术后所有患者心肌酶指标一过性升高,7 d内恢复正常。术前所有患者血淀粉酶均正常。术后1 d,9例患者血淀粉酶升高,术后7 d基本恢复正常,术前与术后7、14 d、1个月血淀粉酶值差异无统计学意义(P值均>0.05)(表3)。围手术期不良反应及并发症:低热3例次,腹痛4例次,恶心、呕吐3例次,轻度胰腺炎2例次。Clavien-DindoⅠ级9例次、Ⅱ级3例次。
2.3 有效性评价 2组患者治疗前CA19-9水平均高于正常值,组间比较差异无统计学意义(P=0.382)。联合组治疗后整体CA19-9水平持续下降,比较联合组治疗前与治疗后1、2、3个月CA19-9水平,差异有统计学意义(P值均<0.05);对照组治疗后整体CA19-9水平呈短暂下降随后上升,比较治疗前与治疗后1、2、3个月CA19-9水平,差异均无统计学意义(P值均>0.05)(表4)。
比较2组治疗前与治疗后3个月腹部增强CT检查结果,参照mRECIST标准对2组肿瘤控制情况进行评价,联合组RR、DCR均高于对照组,差异有统计学意义(P值分别为0.021、0.043)(表5)。

表2 2组患者一般资料比较
在中位随访期(13个月)内,联合组中位PFS、中位OS均高于对照组,差异有统计学意义(10个月 vs 5个月、18个月 vs 10个月,P值分别为0.014、0.034)(图2)。
3 讨论
射频消融是LAPC局部消融治疗的常用手段,但存在热扩散对肿瘤周围重要组织损伤,出现腹腔出血、胰瘘、胆道或十二指肠热灼伤、静脉血栓等严重并发症的问题[3,9]。IRE的原理为利用跨细胞膜磷脂双分子层上的电梯度,释放高压直流电(1000~3000 V)的短脉冲(90个脉冲),导致细胞膜上出现不可修复的纳米级小孔,最终导致细胞死亡,胆管、血管的表面主要为纤维结缔组织,IRE不会对其造成严重损害,且不受热沉效应的影响,适用于LAPC的消融治疗[3,11]。IRE在控制局部病变之后仍需联合化疗,其作用为:(1)可以控制无法判断的微观远处转移;(2)IRE可改善胰腺肿瘤致密的组织结构使化疗有更明显的辅助作用[2]。目前IRE消融治疗LAPC主要有3种方式:开腹、腹腔镜下引导和经皮穿刺。在经皮穿刺消融治疗LAPC时,无论是超声或CT引导,都各有其优缺点。超声引导的优点为可实时监测消融针的走向,避免损伤肿瘤周围血管及组织,但胰腺是腹膜后器官,超声定位时易受胃肠气体干扰,易造成定位不准。CT引导的优势为视野广泛、组织结构清晰且能够观察到消融范围及消融后病灶变化,缺点是没有超声的实时性,需多次穿刺才能使消融针到达理想位置,对于LAPC患者来说,无疑会增加损伤病灶周围重要组织的风险[11]。RVS的优势为既有超声的实时性又有CT的视野广及组织高辨识度,可双重精准定位肿瘤。本研究结合2种技术优势应用于LAPC的消融治疗,从安全性及疗效性评估其临床价值。

表3 联合组术前与术后不同时间点心肌酶指标、血淀粉酶水平变化比较

表4 2组治疗前后不同时间点CA19-9水平变化比较

表5 2组患者治疗后3个月mRECIST标准评价肿瘤治疗效果
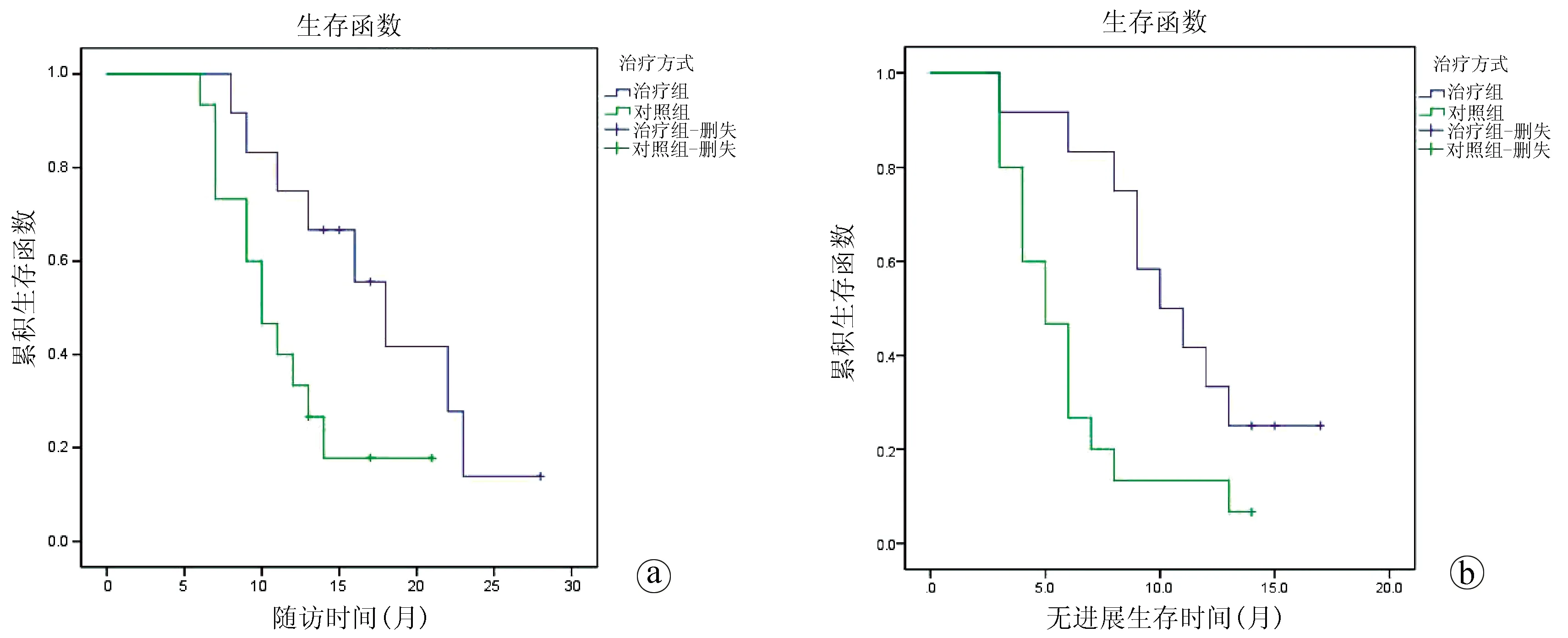
注:a,OS; b, PFS。
安全性方面,联合组患者围手术期内无心律失常及心功能障碍,所有患者术后心肌酶指标呈一过性升高,考虑系IRE原理为高频电脉冲对心肌正常电活动造成一过性影响。术后9例患者出现血淀粉酶一过性升高,2例患者出现轻度胰腺炎症状,给予禁食、生长抑素及抑酸治疗后症状缓解。术后未见腹腔出血、上消化道出血、门静脉血栓、胆道狭窄等严重并发症。既往有研究[13-14]分别对20例、21例LAPC患者行经皮穿刺纳米刀消融治疗,术后均未出现严重并发症,本研究结果与其相似。Scheffer等[15]对25例LAPC患者经皮穿刺纳米刀消融治疗后出现十二指肠溃疡大出血、胆道梗阻及肠系膜上动脉栓塞等严重并发症,其认为IRE消融后会改变消融区域正常解剖结构,组织水肿压迫胆道造成梗阻,建议对未出现胆道梗阻的胰头部肿瘤预防性行胆道支架植入,IRE与十二指肠溃疡出血并未有相关的确定因素。笔者团队[16]曾对IRE消融治疗LAPC术后并发症进行分析,考虑上消化道出血原因可能与下列因素有关:(1)肿瘤侵犯十二指肠壁或胃窦,消融后组织坏死脱落,造成肠壁或胃壁正常结构破坏而引发出血;(2)肿瘤距离十二指肠较近,消融治疗时电脉冲刺激诱发应激性溃疡出血。因此,临床上对肿瘤贴近十二指肠的患者术后应特别注意。国外有报道[17],开腹消融与经皮穿刺消融术后并发症发生率为36%、24%,围手术期病死率为2%、0,似乎经皮穿刺的安全性更高一些。本研究联合组术后未出现严重并发症,考虑与下列因素有关:(1)精细的术前评估;(2)RVS的精确定位及引导穿刺,避开肿瘤周围重要组织结构,防止穿刺造成机械损伤;(3)对靠近十二指肠的肿瘤边缘消融时确保电极针距十二指肠壁>5 mm,防止诱发十二指肠出血;(4)IRE不会对血管、胆管等造成严重损害。总的来说,RVS引导下经皮穿刺纳米刀消融治疗LAPC安全性高。
在有效性方面,联合组治疗后CA19-9水平呈下降趋势,而对照组治疗后CA19-9水平呈短暂下降随后上升,较术前无统计学差异;联合组治疗后3个月RR、DCR以及中位PFS、OS均明显优于对照组。在Belfiore等[13]的研究中,18例患者在9.1(6~14)个月的随访期间均无疾病进展及复发,平均生存期为12.9个月。在Scheffer等[15]的研究中,12个月的中位随访期间患者中位OS为17个月,中位局部进展时间为12个月,本研究结果与上述报道相似。但Martin等[18]的研究中,中位PFS、OS为12.4、24.9个月,与本研究结果有差异,考虑与其部分患者接受了局部切除+边缘强化的治疗方式有关。一项多中心临床研究[19]中,74例接受IRE的LAPC患者1、3年PFS为69.1%、48.7%,1、3年OS为97.2%、53%,其高生存结果与入组标准严格及化疗方案有关,报道中提出TS-1(进口替吉奥胶囊)的辅助化疗方案患者OS、PFS明显高于吉西他滨组。总的来说,RVS引导下纳米刀消融治疗LAPC疗效肯定。
综上所述,RVS引导下经皮穿刺纳米刀消融治疗LAPC安全性高、疗效肯定,为不耐受开腹或拒绝开腹消融的患者提供了一种全新的治疗选择。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献说明:苏东朝负责收集数据、撰写论文;李晓勇负责设计课题,指导写作思路并修改论文;杨金宇负责提供影像融合系统操作指导;陈升阳、胡水全、仝昊等负责数据汇总及数据分析。陈艳军负责提供科研基金及写作指导。

