HBV相关肝细胞癌患者血清N-糖组图谱改变与肝组织糖基转移酶表达变化的关系
曹 曦,孙艳玲,陈翠英,肖义炜,向宽辉,刘学恩,庄 辉
1 北京大学医学部基础医学院 病原生物系和感染病中心,北京 100191;2 解放军总医院第五医学中心 肝病医学中心肝病外科,北京 100853;3 江苏先思达生物科技有限公司,南京 210000
HBV慢性感染是肝细胞癌 (HCC) 发生的最常见病因,HCC的发病率和病死率在恶性肿瘤中分别占第6位和第4位,严重威胁着人类健康[1]。HCC细胞异常增殖可使血清糖蛋白N-糖链组成和结构发生改变,因此,血清糖蛋白的N-聚糖可作为HCC诊断标志物和HCC治疗的分子靶点[2]。N-聚糖改变的基础在于肝细胞内糖基转移酶活性的变化,其中多数糖基转移酶表达与肝脏功能密切相关。当肝细胞发生癌变时,某些糖基转移酶基因被激活,其表达异常增加,或基因表达受抑制而含量下降,从而导致一些蛋白质异常糖基化修饰。大量研究[3]表明,这种异常糖基化修饰与肿瘤细胞恶性侵袭行为密不可分。笔者前期研究[4]发现,与健康对照相比,HBV相关HCC(HBV-HCC)患者血清中N-聚糖图谱发生一系列特征改变,其中二天线N-聚糖峰1(peak1,NGA2F)丰度升高;三天线N-聚糖峰9(peak9, NA3Fb)丰度特异性升高;其他三天线和四天线N-聚糖峰(peak10 NA3Fc、peak11 NA4、peak12 NA4Fb)丰度也有不同程度的升高。但目前HBV-HCC患者血清N-聚糖变化机制尚未完全阐明。本研究中,通过检测HBV-HCC患者癌组织与癌旁组织中8种重要的糖基转移酶基因(包括岩藻糖基转移酶FUT3、FUT4、FUT6、FUT7、FUT8和N-乙酰氨基葡萄糖转移酶Gn-TⅢ、Gn-TⅣa、Gn-TⅤ)表达水平变化并比较其差异,探索HBV-HCC患者血清N-聚糖变化的可能机制。
1 材料与方法
1.1 肝组织标本和血清标本的收集 收集解放军总医院2018年9月—2019年11月HBV-HCC行手术患者的肝癌和癌旁组织及正常肝组织标本,同时采集血清标本,置于-80 ℃冰箱保存。患者符合以下入选标准: (1)均为感染HBV的HCC患者;(2)排除HAV、HCV、HDV、HEV等肝炎病毒感染;(3)患者术后病理标本均经医院病理科确诊为HCC,肝癌诊断符合原发性肝癌诊疗规范(2019年版)[5]。同时收集HCC患者临床资料。另外选取20例健康成年人血清作为对照。
1.2 DSA-FACE法检测HBV-HCC患者血清N-聚糖图谱 应用SPSS 20.0软件从34例HCC患者中随机选择8例HCC患者血清标本作为HCC试验组,20例健康成年人血清标本作为对照组。采用DSA-FACE法检测和分析血清N-聚糖图谱[6],具体步骤如下:
(1)寡糖的释放:取3 μl血清,加入含有2 μl 10 mmol/L NH4HCO3缓冲液和3 μl去离子水的PCR反应板中, 反应板放入PCR仪器,95 ℃加热5 min 后冷却至4 ℃,然后加入3 μl PNGaseF(2.2 U/μl),37 ℃孵育3 h,之后加入100 μl去离子水终止反应,标记为D板。
(2)标记寡糖:从D板吸取10 μl溶液加入一新的PCR反应板中,开盖在60 ℃条件下烘干90 min,加入3 μl标记溶液(20 mmol/L APTS∶1 mol/L NaCNBH3=1∶1),90 ℃反应2 h,加入100 μl去离子水终止反应,标记为L板。
(3)去唾液酸:从L板中取2 μl溶液加入一新的PCR反应板,加入0.25 μL 100 mmol/L NH4Ac(pH=5.0)、0.2 μl 唾液酸酶(2.5 U/μl)和1.55 μl去离子水, 震荡混匀后42 ℃孵育4 h,加40 μl去离子水终止反应,标记为DE板。
(4)DNA 测序仪上机检测:取DE板10 μl溶液加入ABI测序仪专用96孔板,放入ABI 3500 测序仪进行N-聚糖图谱分析,数据经 GeneMapper 软件分析。
1.3 荧光定量PCR法检测患者癌组织与癌旁组织中的糖基转移酶mRNA表达水平 冻存的肝组织放入超声震荡仪研磨后,用Trizol试剂提取总RNA,用Nano Drop One检测总RNA的浓度和纯度。将总RNA逆转录为cDNA后,用荧光定量PCR仪(ABI 7500 FAST)进行cDNA扩增,反应体系为20 μl。反应条件为:(1)95 ℃ 30 s;(2)95 ℃ 5 s,60 ℃ 34 s共40个循环;(3)溶解曲线:95 ℃ 15 s,60 ℃ 1 min, 95 ℃ 15 s。
以RPS11作为内参基因,目的基因的相对表达量用2-△△CT表示。癌组织和癌旁组织糖基转移酶mRNA相对表达量检测分析的对照均是正常肝组织。 FUT3、FUT4、FUT6、FUT7、FUT8、Gn-TⅢ、Gn-TⅣa和Gn-TⅤ基因的特异引物由生工生物工程股份有限公司合成,引物序列见表1。
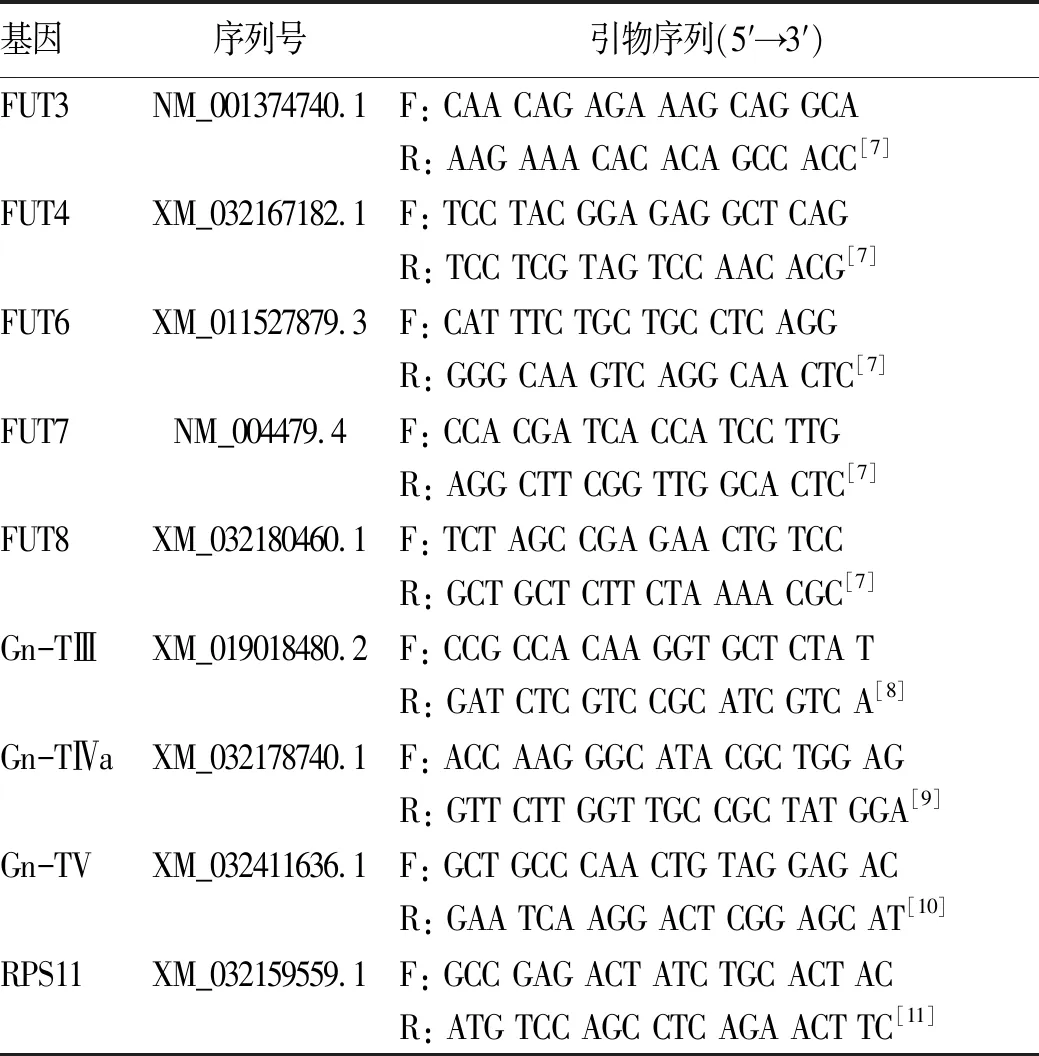
表1 荧光定量PCR检测糖基转移酶基因引物序列表
1.4 蛋白印迹法检测癌组织和癌旁组织中FUT8、Gn-TⅤ和Gn-Ⅳa的蛋白表达水平 冻存的肝组织放入超声震荡仪研磨后,用含cOmplete蛋白酶抑制剂的RIPA裂解液提取蛋白,用BCA蛋白试剂盒来测定蛋白浓度。电泳分离不同分子量蛋白后,15 V恒压下用半干转电转仪将蛋白转移至PVDF膜,于5%的脱脂奶粉中室温封闭1 h,加入抗-FUT8(1∶1000)、抗-Gn-TⅣa(1∶1000)、抗-Gn-TⅤ(1∶1000)、抗-β-actin(1∶4000)一抗,4 ℃过夜,TBST溶液洗膜3次,分别加入抗鼠或抗兔的二抗(1∶5000),室温下孵育2 h,TBST溶液洗膜3次,加入增强型ECL化学发光试剂,凝胶成像仪扫描显影的条带,ImageJ软件分析条带灰度。以β-actin作为内参,目的蛋白的相对表达量用目的蛋白灰度值与内参蛋白灰度值的比值来表示。

2 结果
2.1 HBV-HCC患者临床特征 34例HBV-HCC患者临床特征见表2。
2.2 HBV-HCC患者血清N-聚糖图谱特征 应用DSA-FACE法分析HCC试验组8例HBV-HCC患者与对照组20例健康成年人血清N-聚糖图谱(图1),其特征改变与笔者前期研究发现的特征改变相同[4]。
与对照组相比,HCC试验组患者三天线N-聚糖峰9(peak9,NA3Fb)丰度明显升高(t=-2.514,P<0.05);血清二天线N-聚糖峰1(peak1,NGA2F)和四天线N-聚糖峰(peak11 NA4、peak12 NA4Fb)的丰度在两组间差异无统计学意义(P值均>0.05)。

表2 34例HBV-HCC患者临床特征
2.3 癌组织与癌旁组织8种糖基转移酶mRNA表达水平比较 癌组织中FUT8、Gn-TⅣa和Gn-TⅤ基因mRNA表达水平显著高于癌旁组织(1.50±0.34 vs 0.65±0.11,t=-2.354,P=0.022; 2.90±0.47 vs 1.68±0.19,t=-2.403,P=0.019; 3.57±0.64 vs 1.33±0.16,t=-3.384,P=0.001),差异均有统计学意义。FUT3、FUT4、FUT6、FUT7和Gn-TⅢ mRNA的表达水平在癌组织与癌旁组织间比较差异均无统计学意义(P值均>0.05)(图2)。
进一步比较了HCC试验组中8例患者癌组织与癌旁组织中8种糖基转移酶mRNA表达水平。与癌旁组织相比,8例HCC试验组患者癌组织中Gn-TⅤ mRNA表达明显升高(Gn-TⅤ:5.26±1.70 vs 1.49±0.33,t=-2.173,P=0.047);Gn-TⅢ、Gn-TⅣa、FUT4 和FUT8 mRNA表达在癌组织与癌旁组织间无显著性差异(Gn-TⅢ:1.03±0.46 vs 1.55±0.62,t=0.663,P=0.518;Gn-TⅣa: 5.15±1.50 vs 2.39±0.46,t=-1.752,P=0.102; FUT4: 1.56±1.12 vs 0.81±0.27,t=-0.653,P=0.524; FUT8: 2.61±1.26 vs 1.01±0.41,t=-1.213,P=0.245)。
2.4 癌组织和癌旁组织FUT8、Gn-TⅣa和Gn-TⅤ基因的蛋白表达水平比较 选取mRNA表达有显著性差异的3个糖基转移酶基因FUT8、Gn-TⅣa和Gn-TⅤ作为蛋白印迹实验的检测因子。结果如图3所示,癌组织中FUT8与Gn-TⅤ的蛋白表达水平显著高于癌旁组织(0.70±0.11 vs 0.083±0.017,t=9.555,P=0.001; 1.33±0.19 vs 0.60±0.15,t=5.097,P=0.007);Gn-TⅣa的蛋白表达水平在癌组织与癌旁组织间比较差异无统计学意义(0.52±0.24 vs 0.24±0.11,t=1.833,P=0.141)。

注:a,血清中12种N-聚糖丰度比较;b,12种N-聚糖结构。Peak1-Peak12图引自文献[4],Peak1: 二天线无半乳糖基核心ɑ-l,6岩藻糖基化N聚糖(NGA2F);Peak2: 二天线无半乳糖基核心ɑ-l,6岩藻糖基化平分型N聚糖(NGA2FB);Peak3/Peak4: 二天线核心ɑ-l,6岩藻糖基化单支链半乳糖基N聚糖(NG1A2F);Peak5: 二天线N聚糖(NA2);Peak6: 二天线核心ɑ-l,6岩藻糖基化N聚糖(NA2F);Peak7: 二天线平分型核心ɑ-l,6岩藻糖基化N聚糖(NA2FB);Peak8: 三天线N聚糖(NA3);Peak9: 三天线支链ɑ-l,3岩藻糖基化N聚糖(NA3Fb);Peak9’: 三天线核心ɑ-l,6岩藻糖基化N聚糖(NA3Fc);Peak10: 三天线支链ɑ-l,3岩藻糖基化与核心ɑ-l,6岩藻糖基化N聚糖(NA3Fbc);Peak11: 四天线N聚糖(NA4);Peak12: 四天线支链ɑ-l,3岩藻糖基化N聚糖(NA4 Fb)。

注:*,P<0.05,**,P<0.01。图2 癌组织与癌旁组织中8种糖基转移酶mRNA表达水平比较

注:**,P<0.01图3 癌组织与癌旁组织糖基转移酶FUT8、Gn-TⅣa和Gn-TⅤ的蛋白表达水平比较
3 讨论
HCC患者血清中常出现大量异常糖基化N-糖蛋白,分离糖蛋白的N-聚糖链进行表达图谱分析,可发现支链与核心岩藻糖基化N-聚糖和多天线N-聚糖含量增加,这些N-聚糖与HCC发生发展密切相关,可作为筛查和诊断HCC的特异性标志[12]。研究[4,13]发现在HBV-HCC患者血清中支链岩藻糖基化三天线N-聚糖(peak9, NA3Fb)丰度显著升高,且核心岩藻糖基化二天线N-聚糖(peak1,NGA2F)、核心岩藻糖基化平分型二天线N-聚糖(peak2,NGA2FB)、支链与核心岩藻糖基化三天线N聚糖(peak10,NA3Fc)、四天线N-聚糖(peak11,NA4)和支链岩藻糖基化四天线N-聚糖(peak12,NA4Fb)丰度也有不同程度的升高(N-聚糖结构如图4)。本研究通过对HBV-HCC患者癌组织与癌旁组织相关糖基转移酶基因表达检测分析,探寻HCC患者特异性血清N-聚糖变化的可能机制。
糖基转移酶Gn-TⅤ与Gn-TⅣa催化形成三天线及三天线以上N-聚糖的N-乙酰葡糖胺(GlcNAc)糖链结构[14-15],而Gn-TⅢ催化合成N-聚糖的平分型GlcNAc结构,Gn-TⅢ与Gn-TⅤ、Gn-TⅣa有拮抗作用(图4)[16]。本研究发现,在癌组织中Gn-TⅤ与Gn-TⅣa mRNA表达水平显著高于癌旁组织(P<0.05),蛋白印迹实验也显示,在癌组织中Gn-TⅤ蛋白表达显著高于癌旁组织(P<0.05)。而Gn-TⅢ mRNA表达水平在癌组织与癌旁组织间无统计学差异(P=0.711)。本研究结果可以解释HCC试验组患者血清中N-聚糖变化:与对照组相比,8例HCC患者血清中三天线N-聚糖(peak9)丰度显著升高(P<0.05),而且这8例HCC患者癌组织Gn-TⅤ表达水平显著高于癌旁组织(P<0.05)。说明HCC患者血清中多天线N-聚糖丰度升高可能与糖基转移酶Gn-TⅤ高水平表达密切相关,促进含GlcNAc多分支(三天线及以上)N-聚糖的合成(图4)。
以往研究[4,13]表明,在HBV-HCC患者血清中核心岩藻糖基化N-聚糖(peak1、peak2、 peak10)丰度较高。本研究发现,在癌组织中核心岩藻糖基转移酶FUT8 mRNA与蛋白表达水平显著高于癌旁组织(P<0.05)。FUT8表达上调会导致核心岩藻糖基化修饰结构的N-聚糖增加,可能与癌细胞高转移潜能有关[17]。另外,AFP是临床上最常用的HCC血清学检测指标,有研究[18]发现HCC患者血清中AFP经FUT8催化作用下可形成核心岩藻糖基化AFP(AFP-L3),其与肿瘤的发展速度、肿瘤大小和肿瘤转移密切相关,且诊断HCC效力优于AFP。除了α-1,6核心岩藻糖基化N-聚糖,α-1,3分支岩藻糖基化N-聚糖的丰度在HBV-HCC患者血清也特异性升高。α-1,3分支岩藻糖基化结构是三天线N-聚糖(peak9)中Lewis X结构形成的关键[4],参与合成α-1,3分支岩藻糖基化结构且与HCC密切相关的糖基转移酶有FUT3、FUT4、FUT6、FUT7[19]。本研究显示,在34例HCC患者癌组织与癌旁组织间FUT3、FUT4、FUT6和FUT7 mRNA表达水平没有显著性差异(P>0.05),不能解释血清N-聚糖水平异常改变。结合以往研究报道分析FUT基因表达的检测结果,可能因为多种岩藻糖基转移酶参与合成α-1,3分支岩藻糖基化结构,而目前对于这些酶相互作用机制尚未明确,较难判断岩藻糖基转移酶中那一种亚类起主导作用。本研究主要检测8种与HCC密切相关的糖基转移酶基因表达,初步阐述HBV-HCC患者血清中N-聚糖变化的可能机制。但对于不同糖基转移酶之间相互作用的具体机制以及其他血清N-聚糖(如异常唾液酸化修饰的N-聚糖等)变化机制,还有待于进一步研究。
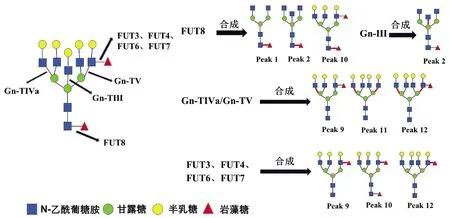
图4 HBV相关HCC患者血清特异变化N-聚糖与8种糖基转移酶之间的关系
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:曹曦完成实验和数据分析,撰写论文;孙艳玲、肖义炜、向宽辉参与收集标本和分析数据;陈翠英参与修改论文;刘学恩、庄辉负责课题设计,指导撰写文章并最后定稿。

