荞麦、燕麦、豌豆复配对糖尿病大鼠血糖的影响
尹雪倩,张晓玄,文 婧,刘思奇,刘欣然,周若宇,王军波
(北京大学公共卫生学院营养与食品卫生学系,北京 100191)
糖尿病是世界重要的公共卫生问题,据国际糖尿病联盟估计,2019年全球20~79岁成人中,约4.63亿患有糖尿病,患病率达9.3%,而中国是糖尿病患病人数最多的国家[1]。目前糖尿病的治疗方式主要包括饮食、药物、运动、健康教育和血糖监测,其中饮食治疗是糖尿病治疗的基石。谷物是碳水化合物的主要来源,以谷物进行饮食干预,是一种具有较高成本效益,几乎无副作用的治疗和预防糖尿病的方法。
研究发现,许多杂粮具有改善高血糖的效果,如荞麦和燕麦在糖尿病动物及人群中具有降血糖作用[2-4],也有动物实验提示豌豆也具有类似作用[5]。然而,中国人均杂粮摄入量不足15 g,且种类较为单一[6],适口性及烹饪困难可能是限制杂粮摄入的重要原因[7-8]。多种杂粮复配可减少杂粮感官性状的缺陷,提高适口性及可加工性,有利于提高人群的杂粮摄入。本实验室前期将荞麦、燕麦及豌豆经体外模拟口腔及胃肠消化后,得到三种杂粮的体外消化产物,之后利用正交实验设计研究三种杂粮体外消化产物的不同复配方案对胰岛素抵抗HepG2细胞葡萄糖利用的影响,得到荞麦∶燕麦∶豌豆质量比为6∶1∶1的复配方案。本研究拟在动物水平对该复配方案进行验证。
1 材料与方法
1.1 杂粮复配方案
燕麦为坝莜1号(河北),荞麦为大三棱(内蒙古),豌豆为中豌系列(河北),均购自山西东方亮生命科技有限公司。将三种杂粮干燥、磨粉后制成相应的杂粮粉,将荞麦粉、燕麦粉、豌豆粉以质量比为6∶1∶1混合后制成复配式杂粮粉(buckwheat-oat-pea composite flour,BOP)。
1.2 实验动物
健康SPF级雄性SD大鼠,体质量(180±20) g,由北京大学医学部实验动物科学部提供[生产许可证号:SCXK(京)2016-0010],饲养于屏障环境内[使用许可证号:SYXK(京)2016-0041],大鼠自由饮水、摄食,室温(25±1)℃,相对湿度50%~60%,明暗每12 h交替。动物喂养及实验按照《北京市实验动物管理条例》执行,并经北京大学生物医学伦理委员会审核通过(批准号:LA2019362)。
1.3 主要试剂及仪器
链脲佐菌素购自西格玛奥德里奇(上海)贸易有限公司,柠檬酸-柠檬酸钠缓冲液购自宝如亿(北京)生物技术有限公司,盐酸二甲双胍片购自中美上海施贵宝制药有限公司,血糖试剂盒购自北京百奥泰康生物技术有限公司,胰岛素放射免疫分析试剂盒购自北京北方生物技术研究所,其余试剂均为分析纯。
血糖试纸及血糖仪购自艾康生物技术有限公司,AU480全自动生化仪购自美国贝克曼库尔特有限公司,XH-6080 γ放射免疫计数器购自西安核仪器厂。
1.4 实验设计
将杂粮添加入饲料中进行干预,通过查阅文献,换算后得到荞麦及燕麦降血糖的有效剂量约为大鼠饲料添加量的10%(质量分数)[4,9-13],因而确定BOP干预低、中、高剂量组的杂粮添加剂量分别为3.3%、10%、30%(均为质量分数)。
64只大鼠适应性喂养7 d后,按空腹血糖和体质量随机分为8组,每组8只,即:空白对照组,模型对照组,二甲双胍组,荞麦组,燕麦组和低剂量(BOP-L)、中剂量(BOP-M)、高剂量(BOP-H)三个BOP组。空白对照组饲喂AIN-93M配方饲料,其他组饲喂高脂饲料(供能比为:碳水化合物35%,蛋白质20%,脂肪45%),其中,荞麦组、燕麦组、BOP-L组、BOP-M组、BOP-H组饲料中分别含10%荞麦粉、10%燕麦粉、3.3%的BOP、10%的BOP和30%的BOP,杂粮在添加时调整了饲料中营养素的比例,使各组高脂饲料中三大供能营养素的含量和比例均保持一致。饲料由北京博泰宏达生物技术有限公司提供。
分组后按对应饲料饲喂30 d,然后除空白对照组外,其余各组大鼠分两次腹腔注射30 mg/kg链脲佐菌素(溶解于pH=4.5的柠檬酸钠缓冲液中)诱导糖尿病,两次注射间隔7 d,以末次注射后第5天模型对照组血糖曲线下面积(glucose area under curve,GAUC)显著高于空白对照组视为造模成功[14]。造模成功后,二甲双胍组每天以盐酸二甲双胍灌胃(按照药品说明书确定剂量,灌胃周期为4周,第1周剂量为每天100 mg/kg,第2周剂量为每天150 mg/kg,第3周和第4周剂量为每天200 mg/kg),其余各组灌胃等剂量蒸馏水,然后继续喂养28 d。
1.5 检测指标及方法
1.5.1一般指标 每日观察大鼠毛色、精神状态、日常活动等一般状态。每周称量体质量,分笼记录进食量和饮水量,并计算单位体质量进食量、单位体质量饮水量及食物利用率。第10周时,每组随机选取6只大鼠,置于独立代谢笼内测量24 h尿量。
1.5.2空腹血糖及葡萄糖耐量 每周测定空腹血糖:大鼠禁食5 h(8:00~13:00),尾静脉采血,使用血糖仪测定。每两周进行葡萄糖耐量实验:大鼠禁食5 h(8:00~13:00),尾静脉采血,使用血糖仪测定空腹血糖值(0 h),经口给予2.0 g/kg葡萄糖后于0.5、1、2 h测定血糖值,计算GAUC,GAUC=(0 h血糖+0.5 h血糖×2+1 h血糖×3+2 h血糖×2)/4。
1.5.3胰岛素及胰岛素抵抗指数 喂养结束后,隔夜禁食12 h,股动脉采血,3 000 r/min离心10 min获得血清,检测空腹血清血糖、胰岛素,并计算稳态模型胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR),HOMA-IR=20×空腹血清血糖(mmol/L)×胰岛素(mIU/L)/22.5。
1.6 统计学分析
2 结果
2.1 BOP对糖尿病大鼠体质量的影响
如图1所示,第5周注射链脲佐菌素后,造模大鼠出现体质量下降,第7~10周,模型对照组大鼠的体质量显著低于空白对照组(P<0.05)。实验过程中,与模型对照组相比,二甲双胍组大鼠的体质量没有显著变化(P>0.05),但其他干预组大鼠的体质量均显著增加(P<0.05)。注射链脲佐菌素前,BOP-L及BOP-H组大鼠的体质量高于燕麦组(P<0.05),但注射链脲佐菌素后,三个BOP组的体质量与荞麦组或燕麦组相比差异均没有统计学意义(P>0.05)。
2.2 BOP对糖尿病大鼠单位体质量进食量及饮水量、食物利用率、尿量的影响
为排除体质量对大鼠进食及饮水的影响,以单位体质量进食量和单位体质量饮水量评估各组大鼠进食及饮水状况。表1结果显示,注射链脲佐菌素前(1~4周),除空白对照组大鼠的单位体质量进食量更高外(P<0.01),其他组与模型对照组大鼠的单位体质量进食量和饮水量差异无统计学意义(P>0.05),这可能与空白对照组饲料能量密度较低有关。

表1 BOP对糖尿病大鼠单位体质量进食量、食物利用率、单位体质量饮水量及24 h尿量的影响Table 1 Effects of the BOP on the food intake/body weight,food utilization rate,water intake/body weight and 24 h urine volume of diabetic rats
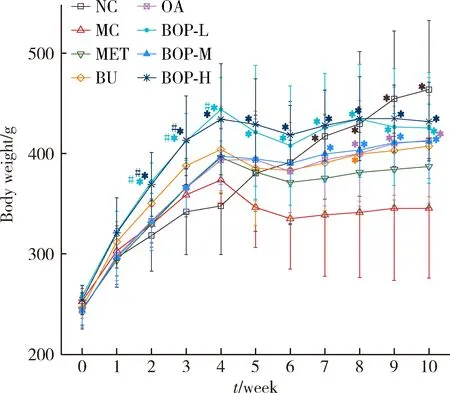
* P<0.05,compared with the MC group;# P<0.05,compared with the OA group.Abbreviations as in Table 1.图1 BOP对糖尿病大鼠体质量的影响Figure 1 Effect of the BOP on the body weight
注射链脲佐菌素后(5~10周),模型对照组大鼠的单位体质量进食量及饮水量增加,显著高于空白对照组(P<0.01)。此外,模型对照组大鼠的食物利用率及24 h尿量也高于空白对照组(P<0.001)。
与模型对照组大鼠相比,二甲双胍组、荞麦组、燕麦组及三个BOP组大鼠的单位体质量饮水量均显著降低,食物利用率显著提高(P<0.05),除BOP-H组外的其他干预组大鼠的单位体质量进食量及24 h尿量也显著降低(P<0.05)。未发现三个BOP组大鼠的单位体质量进食量和饮水量、食物利用率、24 h尿量与荞麦组或燕麦组的差异有统计学意义(P>0.05)。
2.3 BOP对糖尿病大鼠空腹血糖的影响
各组大鼠空腹血糖的变化见图2。第5周注射链脲佐菌素后,模型对照组的空腹血糖显著高于空白对照组(P<0.001),且一直维持高血糖至实验结束。与模型对照组相比,第9周时,二甲双胍组和燕麦组大鼠的空腹血糖降低(P<0.05);第10周干预结束时,二甲双胍组、荞麦组、燕麦组、BOP-L、BOP-M、BOP-H组大鼠的空腹血糖分别降低了 30.2%(P<0.05)、27.1%(P<0.05)、29.8%(P<0.05)、24.4%(P<0.05)、23.4%(P<0.05)和 16.1%(P=0.08),但BOP-H组与模型对照组大鼠空腹血糖的差异没有统计学意义。三个BOP组大鼠的空腹血糖与荞麦组或燕麦组的差异无统计学意义(P>0.05)。
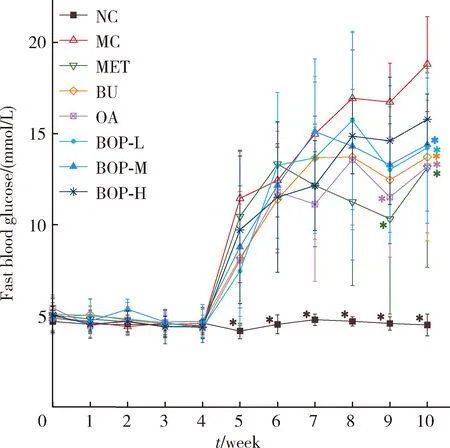
* P<0.05,compared with the MC group.Abbreviations as in Table 1.图2 BOP对糖尿病大鼠空腹血糖的影响Figure 2 Effect of the BOP on the fasting blood glucose of diabetic rats n=8)
2.4 BOP对糖尿病大鼠GAUC的影响
如图3所示,第6周造模结束后,模型对照组大鼠的GAUC显著高于空白对照组(P<0.001);第8周时,二甲双胍组大鼠的GAUC显著低于模型对照组(P<0.05);第10周时,二甲双胍组、荞麦组、燕麦组、BOP-M组大鼠的GAUC显著低于模型对照组(P<0.05)。三个BOP组大鼠的GAUC与荞麦组或燕麦组之间的差异无统计学意义(P>0.05)。
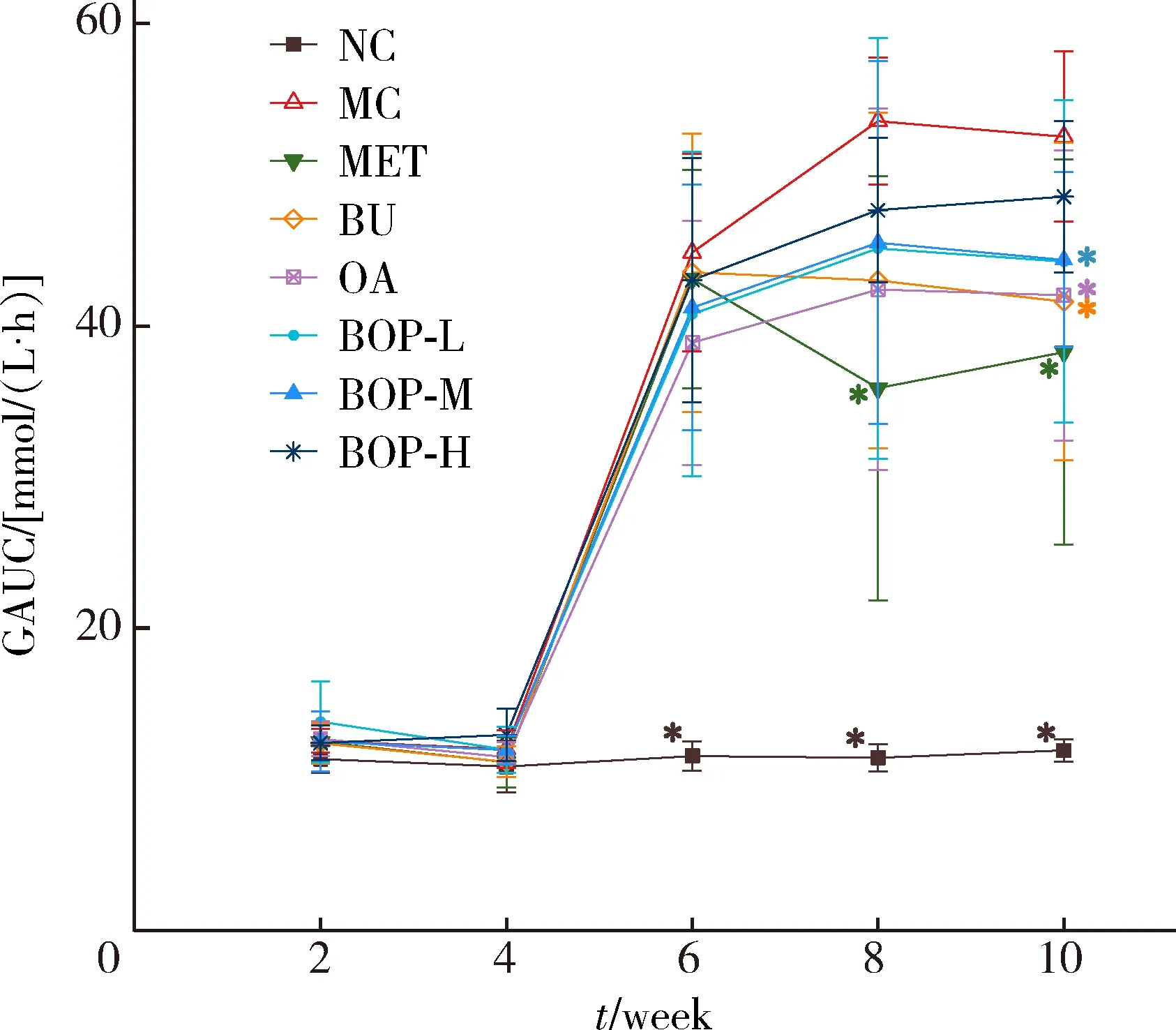
* P<0.05,compared with the MC group.GAUC,glucose area under curve;Other abbreviations as in Table 1.图3 BOP对于糖尿病大鼠GAUC的影响Figure 3 Effect of the BOP on the GAUC of
2.5 BOP对糖尿病大鼠胰岛素及HOMA-IR的影响
模型对照组与空白对照组之间、各干预组与模型对照组之间的血清胰岛素水平差异无统计学意义(P>0.05,表2)。

表2 BOP对糖尿病大鼠血清胰岛素的影响Table 2 Effect of the BOP on the insulin of
各组之间HOMA-IR的差异有统计学意义:模型对照组大鼠的HOMA-IR显著高于空白对照组(P<0.001),二甲双胍组、荞麦组、燕麦组、BOP-L、BOP-M、BOP-H组大鼠的HOMA-IR显著低于模型对照组(P<0.05),未发现三个BOP组大鼠的HOMA-IR与荞麦组或燕麦组的差异有统计学意义(P>0.05),如图4所示。
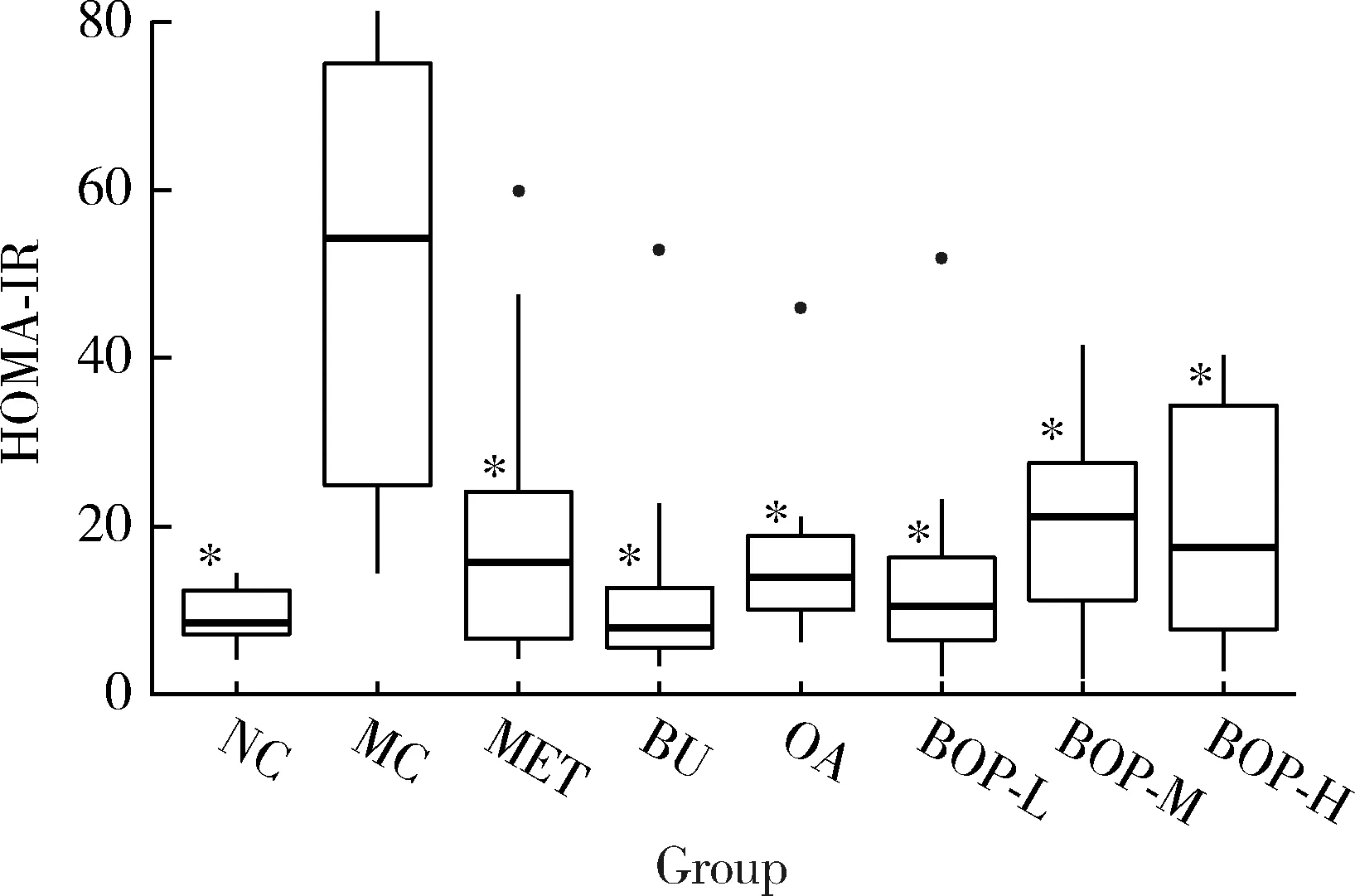
* P<0.05,compared with the MC group.HOMA-IR,homeostasis model assessment of insulin resistance;Other abbreviations as in Table 1.图4 BOP对糖尿病大鼠HOMA-IR的影响Figure 4 Effect of the BOP on the HOMA-IR
3 讨论
目前已有许多研究表明,单一杂粮对于改善糖代谢具有积极影响,但杂粮复配后对血糖干预的研究较少。Perez-Ramirez等[15]的研究发现,与普通燕麦-小麦饼干相比,燕麦-豆粉饼干可以提高糖尿病大鼠的胰岛素水平,但两种饼干对血糖均无明显影响。方海滨等[13]发现,薏米-燕麦膨化食品可以降低高糖高脂喂养大鼠的血糖水平,且具有良好的风味。本研究在前期的细胞实验基础上进行,采用饮食干预的方法研究荞麦、燕麦及豌豆复配后对糖尿病大鼠的影响,发现低、中剂量的BOP可以降低糖尿病大鼠的血糖和HOMA-IR,中剂量BOP还可以降低糖尿病大鼠的GAUC,具有辅助降血糖作用。
虽然与荞麦或燕麦相比,BOP对糖尿病大鼠并没有起到更好的血糖干预效果,但杂粮复配后有着单一杂粮没有的优势,如燕麦中含有较高的钙、锌及多不饱和脂肪酸,豌豆中含有丰富的蛋白质和赖氨酸[16],它们与荞麦复配后有更高的营养价值。同时,杂粮复配后还有利于提升加工性能和感官特性,如Beitane等[17]发现,豌豆与荞麦复配可以显著改善荞麦粉的亮度、颜色、黏度和形成时间;Angioloni等[18]发现,燕麦、黑麦、荞麦和小麦复配后可以改善单一杂粮面团粘结性差和过于坚硬的问题,提高了适口性和可加工性。齐婧等[19]利用荞麦、黄豆、小米进行谷物面条的研究,发现同时包含三种杂粮粉的面条感官品质最高,因而,杂粮复配后比单一杂粮具有更高的生产利用空间。
复配式杂粮降血糖的机制尚不明确。本研究中,荞麦、燕麦及BOP干预均降低了糖尿病大鼠的胰岛素抵抗水平,但对空腹血清胰岛素没有明显影响,表明BOP的降血糖效果并不是通过促进胰岛素分泌实现的,这与之前荞麦干预研究的结果相似[20-21]。也有研究表明燕麦可能具有促进胰岛素分泌的作用,糖尿病鼠的胰岛素水平明显降低[22-24],而本研究中模型对照组和空白对照组大鼠的胰岛素水平没有明显差异,这可能与糖尿病模型中胰岛素分泌受损伤的程度有关。以往研究发现,荞麦、燕麦还可能通过调节血脂、降低炎症及氧化应激水平等作用改善糖代谢[4,11,25-26],同时,荞麦和豌豆还可能通过PIK3/AKT等胰岛素作用通路发挥作用[26-27],故BOP降血糖的具体机制还需要进一步研究。
综上所述,BOP可以降低糖尿病大鼠的空腹血糖,改善糖耐量及胰岛素抵抗,减轻糖尿病症状,具有进一步开发利用的价值。

