纤维素降解菌的筛选与诱变育种
冯伟 冯雅琪 徐晶雪
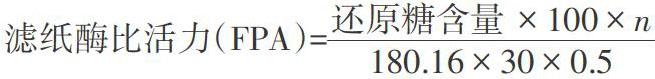


摘 要:纤维素占植物体干重的35%~50%,由于纤维素水解、利用较困难,若处理不当会造成环境污染。该研究以常年堆放秸秆的腐殖土壤和果树下土壤为试验材料,采用刚果红纤维素琼脂平板初筛、羧甲基纤维素(CMC)平板复筛,筛选出12株具有降解纤维素功能的菌株,其中4株具有较明显的透明圈,且羧甲基纤维素酶活力(CMC)和滤纸酶活力(FPA)较高。采用紫外线诱变育种得到3株CMC酶提高较多的突变株,其中突变株的CMC酶活较原始菌株提高最达到57.4%。
关键词:纤维素;纤维素酶;紫外线;诱变育种
中图分类号 X172文献标识码 A文章编号 1007-7731(2021)09-0041-03
Abstract: Cellulose accounts for 35%-50% of the dry weight of plant body. It is difficult to hydrolysis and utilize cellulose, and improper treatment of cellulose causes environmental pollution. Based on perennial piled straw soil under the humus soil and fruit trees of as experiment material, adopting Congo red cellulose AGAR plate screen at the beginning of carboxymethyl cellulose (CMC) tablet after screen got 12 strains screened out which has the function of cellulose degradation strains, including four strains has a clear, transparent circle and carboxymethyl cellulose (CMC) enzyme and enzyme filter paper (FPA) is higher. The CMC activity of three mutant strains was 57.4% higher than that of the original strain.
Key words: Cellulose; Cellulase; Ultraviolet (uv); Mutation breeding
资源与环境问题是21世纪人类面临的最主要挑战,利用可再生资源代替不可再生资源是应对这一挑战的唯一途径。纤维素是自然界中最丰富的天然可再生碳水化合物,其占植物体干重的35%~50%,是地球上分布最广、含量最多的有机物。但是,由于纤维素水解、利用都很困难,致使其利用具有一定的局限性[1]。因此,寻找具有高效纤维素酶的微生物是关键。
本研究通过对腐殖土壤中的纤维素降解菌进行筛选,筛选出具有降解纤维素作用的纤维素分解菌,并对其降解纤维素能力进行测定,最终分离出自然生长且具有高效降解纤维素作用的菌种,为利用微生物降解纤维素技术开发和利用纤维素资源提供候选菌株。
1 研究方法
1.1 培养基配制
1.1.1 选择培养基 KH2PO4 2g,(NH4)2SO4 1.4g,MgSO4·7H2O 0.3g,CaCl2 0.3g,FeSO4·7H2O 5mg,MnSO4 1.6g,ZnCl2 1.7g,CoCl2 1.7g,1%纤维素,pH 7.0,蒸馏水定容1000mL。
1.1.2 刚果红纤维素琼脂培养基 MgSO4 0.25g,KH2PO4 0.5g,琼脂20g,明胶2.0g,羧甲基纤维素钠1.88g(纤维素粉预先经1mmol/L盐酸冷处理12h,以水清洗无盐酸后用来配制培养基),刚果红0.2g,蒸馏水1000mL,pH7.0[2]。
1.1.3 CMC培养基 (NH4)2SO4 2g,KH2PO4 1g,MgSO4·7H2O 0.05g,NaCl 1g,羧甲基纤维素钠15~20g,蒸馏水1000mL,pH6.0,固体培养基加琼脂20g琼脂。
1.1.4 发酵(产酶)培养基 (NH4)3PO4 0.2g,MnSO4·7H2O 1.0mg,KH2PO4 0.8g,CaCl2 20mg,MgSO4·7H2O 0.9g,酵母膏1.0g,柠檬酸铁5mg,蛋白胨2g,维生素100μg,蒸馏水1000mL,pH自然。100mL发酵培养基,加入纤维素粉3g。
1.2 纤维素降解菌筛选
1.2.1 纤维素降解菌的初筛 称取土样10g加入50mL选择培养基中,30℃下摇床培养1d。将菌悬液采用稀释涂布法选择适宜稀释度接种于刚果红纤维素培养基上,在30℃培养3d后观察是否产生透明圈。
1.2.2 纤维素降解菌的复筛 挑取初筛得到的菌株三区划线接种到CMC培养基上,培养3d后挑取培养基上长出的单菌落再次接种到CMC培养基上,在30℃条件下培养3d后,先用1mg/mL的刚果红染色3min,再用浓度为0.9%NaCL进行冲洗,最后观察测定透明圈直径大小。将得到的具有透明圈菌株进行革兰氏染色[3]。
1.3 菌株纤维素酶活力测定
1.3.1 粗酶液制取 吸取1mL菌悬液加入发酵产酶培养基中,30℃发酵4d,用5层纱布对发酵培养基进行过滤,在4000r/min条件下离心15min,采集上清液即为粗酶液[4]。
1.3.2 羧甲基纖维素酶活力(CMC)测定 采用DNS法测定葡萄糖标准曲线。菌株酶力测定在试管中加入1.5mL 0.5% CMC-Na的柠檬酸缓冲液,然后再取0.5mL粗酶液加入其中,轻轻摇晃混合均匀,在50℃水浴锅中作用30min后取出立即按DNS法测定糖。
1.3.3 滤纸酶活力(FPA)的测定 在试管中加入1.5mL醋酸-醋酸钠缓冲液,再加入0.5mL酶液,缓慢摇动,混合均匀。将去淀粉滤纸(1cm×6cm)放入试管中,使溶液淹没滤纸,50℃水浴锅保温1h后,按DNS法测定糖[5]。
式中:180.16:葡萄糖分子量;0.5:酶原液的体积(mL);30:反应时间(min);n:酶液稀释倍数。
1.4 紫外诱变育种 在带有转子的培养皿中加入6mL菌悬液,用紫外灯(15W,30cm)分别照射1、2、3、4、5、6、7、8min后,分别吸取0.2mL稀释液涂布于纤维素刚果红培养基上,每个稀释度做3个平行。30℃下避光培养48h后计数,计算致死率,并绘制致死曲线以选择最佳诱变剂量,测定诱变后突变菌株酶活力。
2 结果与分析
2.1 初步筛选的纤维素降解菌 将采集的土壤样品制备成悬液涂布于刚果红纤维琼脂培养基中,得到12株产透明圈菌株,其中4株透明圈较明显,分别记为L1、L2、L3、L4,观察4株菌的菌落形态并进行革兰氏染色镜检,结果见表1。革兰氏染色结果显示4株均为革兰氏阳性菌。纯化培养过程中,菌株L4生长最快,L2、L3次之,L1生长最慢。
2.2 复筛出的菌株 挑取L1、L2、L3、L4这4株候选菌株重新接种,刚果红透明圈法测定4株菌株透明圈大小,结果表2所示。由表2可知,4种菌株均能够分解纤维素类物质,但透明圈直径大小差距不大。
2.3 菌株的酶活力
2.3.1 葡萄糖标准曲线 利用DNS法,在波长550nm条件下,线性关系方程为y=0.177x-0.128,相关系数R2=0.994(见图1)。
2.3.2 菌株的酶活力 4种菌株分别接种到发酵产酶培养基中摇瓶培养,酶活测定结果见表3,得到3株FPA值超过0.1U/mL的菌株,且CMC值也较高。
2.4 诱变育种
2.4.1 诱变时间 将紫外诱变的致死率见图2,3株产酶量较高的菌株当紫外线照射时间为2min时,各菌株致死率分在70%~80%,所以将紫外线照射时间定为2min。
2.4.2 突变菌株 取发酵培养3d后的突变菌株的培养液,对其CMC酶活力进行测定,并计算CMC酶活增长率。由表4可知,以HC值提高25%以上为筛选指标,紫外诱变共筛选到3株目标突变菌株L2-1、L3-1、L4-1分别对应原始菌株L2、L3、L4。
3 结论
本研究采取常年堆放秸秆的腐殖层土壤和果树下腐殖层土壤作为试验材料,利用选择培养基和刚果红纤维素培养基分离纯化其中纤维素降解菌,利用DNS法测定葡萄糖标准曲线,并用发酵产酶培养基进行菌株培养,培养3d后测定菌株酶活力,得到4株菌CMC酶活力较高菌株,酶活最高可达0.208 U/mL,FPA酶活最高可达0.152U/mL;经紫外诱变,其中3株突变株的CMC酶活力有较明显的提高,酶活力的最高提高率达57.4%。筛选得到高效降解纤维素菌株可以为纤维素的处理与加工及饲料生产等提供备选菌株。
参考文献
[1]佟硕秋,王嫱,林宗梅,等.纤维素降解菌研究进展[J].山东化工,2020,49(03):67,91.
[2]王勇,张育铭,朱洪磊,等.高效纤维素降解菌的筛选及产酶活力测定[J].江苏农业科学,2020,48(23):255-260.
[3]江高飞,暴彦灼,杨天杰,等.高温秸秆降解菌的筛选及其纤维素酶活性研究[J].农业环境科学学报,2020,39(10):2465-2472.
[4]张海艳,王文磊,韩锰.纤维素分解菌的筛选与鉴定[J].安徽农业科学,2020,48(15):1-3,8.
[5]李建樹,孙丽坤,韩向敏,等.高温纤维素降解微生物的筛选、鉴定及其酶活力测定[J].甘肃农业大学学报,2020,55(03):29-37.
(责编:张宏民)

