哺乳动物外周组织中5-羟色胺功能的研究进展
杜 玮,闫晓茹,张志飞,高慧杰,郑惠玲
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
5-羟色胺(5-hydroxytryptamine,5-HT)又名血清素,是一种生物胺和色氨酸衍生物。5-HT可分为神经元5-HT和外周5-HT,之前的研究主要集中在神经元5-HT对情绪和认知的调控作用上,但是近年来的研究表明外周5-HT在机体的稳态调节过程中也发挥着非常重要的作用[1-2]。
人体中约98%的5-HT存在于外周,乳腺、肠道、骨骼、胰岛等外周组织中均存在5-羟色胺能系统,都能进行5-HT生物合成、转运和分泌。约90%的外周5-HT来源于肠道,被储存在血小板中,经血液循环运达全身[3-4]。外周5-HT以自分泌和旁分泌的形式通过作用于不同组织和细胞表面的5-HT受体,进而调控机体代谢。现综合近年来国内外关于外周5-HT功能的相关研究,旨在为调控哺乳动物乳腺稳态、维持骨骼密度和能量稳态的相关研究提供依据。
1 5-HT的生物合成及代谢
1.1 5-HT的合成5-HT是一种进化过程中高度保守的单胺。动物体中的L-色氨酸先经色氨酸羟化酶(tryptophan hydroxylase,TPH)转化为5-羟色胺酸(5-hydroxytryptophan,5-HTP),然后经芳香族氨基酸脱羧酶(aromatic amino acid decarboxylase,AADC)脱羧形成5-HT[5]。TPH是5-HT生物合成过程中的限速酶,该酶在脊椎动物中存在两种亚型,由不同的基因TPH1和TPH2转录而来[2]。TPH2在神经元中表达,神经系统中合成的5-HT起着中枢神经递质的作用。TPH1在肠道、乳腺、胰岛等多种外周组织中表达,外周组织中合成的5-HT作为一种激素,可以通过自分泌和旁分泌途径影响止血、免疫反应、乳腺稳态、肠道生理和钙代谢等多种机体功能[6-8]。
1.2 5-HT的转运和代谢完整的5-羟色胺能系统包括了5-HT的合成、分泌、转运和代谢功能。5-HT的转运和代谢由5-羟色胺转运体(serotonin transporter,SERT)和囊泡单胺转运体(vesicular monoamine transporter,VMAT)来承担。SERT具有两大功能:第一是5-HT积累和再摄取,在不能合成5-HT的细胞如血小板中可以利用SERT聚集来自肠道合成的5-HT;SERT的第二个功能是清除细胞外分泌的5-HT,从而终止受体介导的5-HT信号传导[9]。抗抑郁药物5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRIs)就是通过抑制SERT从而延长5-HT在细胞外空间(尤其是突触)的停留时间来增加5-HT的生物活性。5-HT通过VMAT进入分泌囊泡,并被单胺氧化酶(MAO)降解,产生主要的非活性代谢产物5-羟基吲哚乙酸(5-HIAA),最终随尿液排出体外[10]。
2 5-HT受体
5-HT通过其受体发挥作用,5-HT的受体可以分为7个家族(5-HT1~7),这7个家族又分为14个亚型:5-HTR1A、1B、1D、1E、1F、2A、2B、2C、3A、3C、4、5a、6和7[11]。5-HT受体具有组织和细胞差异性,同一家族的不同受体亚型,其结构、相对分布、对各种激动剂和拮抗剂的敏感性也不相同。除5-HT3家族是配体-门控离子通道外,其他5-HT受体都是G蛋白偶联受体。其中5-HT1和5-HT5家族的受体是Gi/o耦合的,5-HT2家族是Gq/11耦合,5-HT4、5-HT6和5-HT7是Gs耦合的[12-13]。此外一些5-HT受体基因,如5-HTR2C和5-HTR7,在转录过程中可以通过可变剪接产生多种变体,这进一步增加5-HT受体的多样性。外周5-HT通过其受体发挥作用,5-HT受体的多样性决定了一个器官乃至整个机体中5-HT广泛的功能。
3 外周组织中5-HT的功能
3.1 乳腺在稳态条件下,乳腺泌乳是一个周期性的进程,在这个过程中乳腺导管被交替充满和排空。在乳腺中,通过神经内分泌途径传递的信号和腺体局部信号之间的复杂相互作用,可实现乳腺泌乳稳态[14]。催乳素(PRL)和催产素(OT)通过作用于分泌上皮细胞和肌上皮细胞,引起乳汁的合成、分泌和排出。这种神经内分泌反馈回路是调控泌乳期内稳态的主要外在机制[15]。与神经内分泌系统的调控相比,乳腺内固有的稳态调控机制在很大程度上仍是未知的。近年来的研究表明5-HT是一种乳腺稳态的调节因子。WEAVER 等[16]通过哺乳期乳腺特异性敲除TPH1的小鼠模型,发现乳腺是哺乳期循环5-HT产生的主要来源。乳腺5-HT已被证明具有两种稳态功能。首先,5-HT调节泌乳,并启动乳腺进入退化早期阶段。第二,5-HT是一种局部信号,可诱导甲状旁腺激素相关蛋白(PTHrP)表达,动员骨骼中的钙释放进入血液并转移到乳腺[9]。
3.1.1外周5-HT调节乳腺稳态 5-HT被认为是啮齿动物、反刍动物和人乳腺泌乳的自分泌/旁分泌调节因子。MATSUDA 等[17]在啮齿动物模型上的研究表明,PRL刺激小鼠乳腺组织中5-HT生物合成必需基因:TPH1和AADC的表达。孕期和哺乳期TPH1 mRNA表达升高,表明5-HT的生物合成增加。哺乳期母鼠的乳汁淤积可诱导体外培养的乳腺球细胞TPH1的表达,提示该基因是由腺泡中的乳汁充盈所控制的。5-HT抑制乳腺上皮细胞中β-酪蛋白基因表达,引起乳腺小泡萎缩[18]。相反,TPH1基因突变或抗5-HT药物可以导致分泌功能增强和腺泡扩张[17]。因此5-HT可以抑制乳腺乳汁合成,维持乳腺容积稳态。上皮紧密连接的建立和维持是泌乳所必需的生理事件之一。在分娩后不久,乳腺上皮细胞紧密连接的完整功能就建立起来了,并且在整个哺乳期它们都是闭合的。相反,紧密连接的开放被认为是乳腺退化的早期事件之一[19]。STULL等[15]发现5-HT通过位于基底外侧膜上的5-HTR7介导了紧密连接的开放从而使乳腺退化。因此,自分泌和旁分泌5-HT信号是调节乳腺内稳态和介导乳腺退化的重要因子。
在反刍动物中的研究表明,TPH1在牛的乳腺上皮细胞中表达且TPH1以PRL依赖的方式表达。在牛乳腺上皮细胞中鉴定出5种5-HT 受体亚型,包括5-HTR1B、5-HTR2A、5-HTR2B、5-HTR4和5-HTR7[20]。5-HTR1B亚型的突变已经被证明可以增加牛的产奶量[21]。PAI等[22]研究表明,5-HTR7受体敲除的母牛乳腺畸形,无法哺乳幼崽,难以从哺乳期过渡到干奶期。因此推测5-HT可以通过5-HTR1B和5-HTR7亚型受体调节奶牛的泌乳和乳腺的发育。人体的药理学研究表明服用SSRIs的产妇会出现乳腺分泌激活的延迟导致母乳喂养困难[23]。综上所述,在人、啮齿动物、反刍动物中5-HT作为泌乳的抑制剂,与PRL形成一个负反馈调节环路,两者共同调节哺乳期的乳腺稳态。
3.1.2外周5-HT调节乳腺钙代谢 进入哺乳期后,乳汁的合成迅速消耗母体循环中的钙,因此,必须从母体骨骼中动员钙以保持足够的循环钙浓度。循环钙浓度受包括维生素D、甲状旁腺激素(parathyroid hormone,PTH)、降钙素和甲状旁腺激素相关蛋白(parathyroid hormone related protein,PTHrP)在内的多种激素和代谢产物的精密调控[24]。哺乳期5-HT缺乏会导致小鼠乳腺的钙感应、转运和分泌功能受损,此外5-HT缺乏小鼠显示出较低的循环和乳腺PTHrP浓度,其股骨的骨细胞数量减少,表明其在哺乳期间动员骨钙的能力受损[25-26]。哺乳期5-HT通过5-HTR2B诱导乳腺上皮细胞中PTHrP的合成,从而引起骨动员增加循环钙浓度。因此5-HT将泌乳与全身钙代谢结合起来。图1以一种简化的方式说明了乳汁分泌驱动PTHrP的反馈回路。
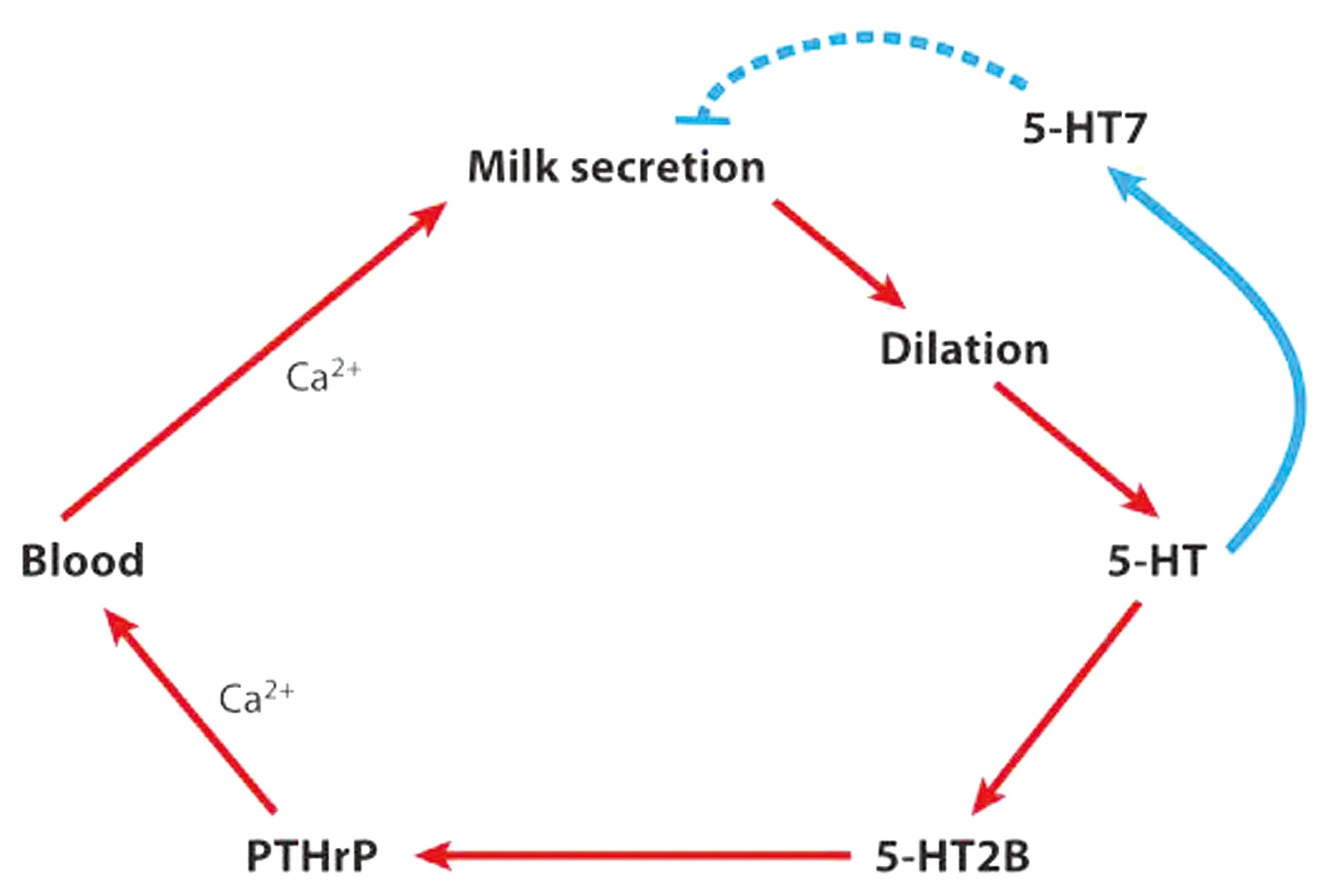
图1 5-HT调节乳腺泌乳[9]
3.2 骨骼骨骼受多种内在和外在信号因子共同调节其生长和转化,是一个高度动态的组织。骨骼系统通过成骨细胞(osteoblasts,OB)和破骨细胞(osteoclast,OC)的相互作用来维持其结构和功能,OB负责骨形成而OC负责骨吸收和钙动员[27]。多种激素、生长因子和细胞因子协同调控成骨细胞和破骨细胞的活性,共同维持骨密度[28]。近年来的研究表明5-HT也是骨组织动力学中的一个关键分子。临床上的数据也表明服用SSRIs治疗抑郁症的患者,他们发生骨折和骨质疏松的概率增加[29]。5-HT通过直接和间接的方式调控骨骼代谢。骨组织中除了含有肠源性5-HT外,自身的OB、OC、骨细胞都可以合成5-HT。
3.2.1肠源性5-HT对骨代谢的调控 肠源性5-HT是由L-色氨酸通过肠嗜铬细胞中TPH1合成的,合成后的5-HT进入血液在表达有SERT的血小板中聚集。肠源性5-HT是骨骼中5-HT的主要来源[30]。低密度脂蛋白受体相关蛋白5(LRP5)与骨形成的变化相关,LRP5缺失突变会导致骨质疏松,而功能获得性突变会导致高骨量综合征[31]。LRP5-/-小鼠十二指肠中的TPH1表达升高,血液中5-HT含量增加,骨密度降低。因此LRP5可通过调控TPH1的表达影响5-HT含量,从而调控骨形成。YADAV等[30]进一步的研究表明,5-HT通过前成骨细胞表面的5-HTR1B受体抑制成骨细胞的增殖(图2)。在正常生理条件下,叉头框蛋白O1(FOXO1)在成骨细胞细胞核内与转录激活子4(activating transcription factor 4,ATF4)和cAMP反应元件结合蛋白(cAMP response element-binding protein,CREB)相互作用,维持成骨细胞的正常增殖。FOXO1与ATF4的结合促进了FOXO1调节转录靶点的表达,而与CREB的结合抑制了FOXO1调节转录靶点的表达[32]。血液循环中5-HT水平增加破坏了FOXO1与CREB的相互作用,有利于ATF4-FOXO1异二聚体的形成,这导致细胞周期进程基因被抑制,成骨细胞增殖活性下降,骨形成被抑制[32]。

图2 肠源性5-HT调节成骨细胞增殖[30]
3.2.2骨源性5-HT对骨代谢的调控 近年来的研究表明,成骨细胞、破骨细胞和骨细胞中均表达TPH1、SERT、5-HTRs,这说明骨骼中存在5-羟色胺能系统。骨细胞中产生的5-HT能够以自分泌和旁分泌的形式作用于细胞膜表面的5-HT受体进而调节骨细胞的增殖和活性。骨源5-HT可以通过5-HTR2B促进成骨细胞增殖而通过5-HTR1B抑制成骨细胞增殖[33]。5-HT可以由破骨细胞前体在NF-κB配体(RANKL)存在的情况下合成,破骨细胞前体内TPH1表达的下调会导致骨吸收减少,从而增加骨密度[33]。CHABBI等[34]使用TPH1持续失活的小鼠,发现破骨细胞可以局部产生5-HT,其通过增加成骨细胞的活性同时减少破骨细胞的产生促进骨形成。
3.2.3PTHrP对骨代谢的调控 骨骼接受来自乳腺释放的信号因子调节骨代谢,乳腺上皮细胞中产生的5-HT通过位于细胞膜表面的5-HTR2B受体促进细胞内PTHrP的表达。乳腺产生的PTHrP进入血液循环中,在骨组织中与位于OB表面的PTHrP受体(PTH1R)结合,诱导OB分泌RANK配体(RANKL)。RANKL与OC表面的RANK受体结合促进骨吸收,释放钙离子进入血液循环中[35]。啮齿动物和反刍动物上的研究表明,产前5-HT/5-HTP治疗可以维持母体产后血液中的钙浓度,降低了产后低血钙症的发生率,使母体由围产期顺利过渡到哺乳期[36-37]。
3.3 肝脏肝脏是人体重要的脂质代谢器官,脂肪酸、甘油三酯、胆固醇的合成分解以及胆汁分泌等脂类代谢活动都是在肝脏中进行的。当体内摄入过多能量时,肝脏中出现异常的脂质聚集从而引发非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD),这是一种常见的肝脏疾病[38]。此外肝脏也能够通过糖异生的方式参与葡萄糖代谢,调节体内的血糖水平。糖异生的增加会导致血糖水平升高,导致2型糖尿病(type 2 diabetes mellitus,T2DM)的发生。
3.3.1外周5-HT调节肝脏脂代谢 许多研究表明外周5-HT能够调节肝脏中的脂质代谢。CHOI等[39]发现TPH1和TPH2在8周龄C57BL/6J小鼠肝脏中不表达,但检测到了SLC6A4(编码SERT)、MAOA(单胺氧化酶A)和5-HTRs基因的表达,这表明肝细胞可以转运和代谢5-HT但不能合成5-HT。此外肝脏是肠源性5-HT经门静脉第一个遇到的器官,这时门静脉血中游离5-HT的浓度较高,足以对肝脏的内分泌产生影响[40]。研究表明肠道特异性TPH1敲除(TPH1-GKO)小鼠可以抑制高脂饲喂引起的肝脏脂肪变性,因此肠源性5-HT的产生与NAFDL的发生有关。此外肝脏特异性敲除5-HTR2A(5-HTR2A-LKO)小鼠以及选择性5-HTR2A拮抗剂治疗的小鼠与野生型相比肝脏中脂肪生成相关基因的表达减少,抑制了高脂饲喂引起的肝脏脂肪变性[39]。因此,肠源性5-HT是由肠-肝内分泌轴通过5-HTR2A直接调节肝脏脂质代谢。
3.3.2外周5-HT调节肝脏糖异生 早在1992年就有研究表明,外周5-HT可以促进肝脏中的糖异生。ZABALA等[41]通过给大鼠注射5-HT,上调了肝脏中糖异生过程中关键酶磷酸烯醇式丙酮酸羧化酶的表达。SUMARA等[42]进一步的研究表明在肝细胞中肠源性5-HT信号可以通过增加果糖1,6-二磷酸酶(FBPase)和葡萄糖-6-磷酸酶(G6Pase)这两种糖异生限速酶的活性,从而促进了糖异生。在特异性敲除5-HTR2B小鼠肝细胞中,糖异生的活性受到抑制,因此5-HT可能通过5-HTR2B参与糖异生的调控。此外,肝细胞内的肠源性5-HT信号传导以葡萄糖转运蛋白2(Glut2)依赖的方式抑制葡萄糖摄取,从而进一步有利于维持血糖水平。因此,抑制肠源性5-HT的合成可以改善高脂饮食引起的葡萄糖不耐受。使用抑制肠源性5-HT合成的小分子制剂或者使用选择性5-HTR2B拮抗药物可能有助于改善T2DM。
3.4 胰岛胰岛素是由胰腺β细胞分泌的,受血糖水平调控,进食后血糖水平升高可使胰岛素分泌增加5~10倍[43]。除血糖外,血脂、细胞因子和激素都能影响胰岛素分泌。T2DM是一种以胰岛素分泌缺陷和胰岛素敏感为特征的代谢性疾病[44]。
研究表明包括胰腺β细胞在内的一些胰岛细胞中表达有合成、包装和分泌5-HT所必需的所有基因。β细胞表达TPH的两种亚型TPH1和TPH2,β细胞也表达VMAT2,它的作用是将5-HT装入分泌囊泡的转运体中[45]。ZHANG等[46]发现T2DM患者血浆中5-HT水平较高,且5-HTR2C在糖尿病小鼠胰岛中的表达明显增加。5-HTR2C激动剂mCPP对Min-6细胞和胰岛细胞的胰岛素分泌有明显的抑制作用,5-HTR2C拮抗剂SB242084或RNA干扰5HTR2C可逆转这种抑制作用;提示胰腺β细胞中5-HTR2C表达增加可能抑制胰岛素分泌。
3.4.1外周5-HT参与妊娠适应 妊娠期为满足代谢需求,母体胰岛β细胞的数量和葡萄糖刺激胰岛素分泌(glucose-stimulated insulin secretion,GSIS)均增加[47]。妊娠期间在PRL的刺激下,胰岛中TPH1、TPH2的两种亚型表达水平显著升高[48]。胰岛产生的5-HT以自分泌/旁分泌方式发挥作用,在妊娠期间通过5-HT配体-门控离子通道受体(5-HTR3)增加GSIS[48]。5-HT可以引起的通道开放激活了内向电流并使膜去极化。葡萄糖也能使β细胞去极化:糖酵解增加的ATP导致ATP敏感的K+通道关闭,由此产生的去极化通过电压门控的Ca2+通道引起Ca2+内流,从而触发胰岛素颗粒胞吐[49]。因此,通过5-HTR3激活去极化使β细胞对葡萄糖刺激更敏感。在妊娠中期胰岛5-HT通过Gαq-偶联受体5HTR2B诱导β细胞增殖、增加β细胞质量,在妊娠末期通过Gαi-偶联受体5HTR1D降低β细胞质量[50]。总之5-HT参与了β细胞对妊娠的适应,这些适应性过程的失败会导致妊娠期糖尿病的发生。
3.4.25-HT调控胰岛素分泌 肥胖会导致胰岛素抵抗,从而增加身体对胰岛素的需求。随着胰岛素需求的增加,胰腺β细胞质量和胰岛素分泌增加[51]。当β细胞不能补偿胰岛素抵抗时,就会产生T2DM[52]。KIM等[53]研究了在高脂饮食诱导的胰岛素抵抗状态下5-HT在胰岛素分泌中的作用。与妊娠期胰岛5-HT合成显著增加不同的是HFD并未提高胰岛内5-HT合成或血液5-HT水平。在HFD诱导的胰岛素抵抗状态下5-HTR3敲除(5-HTR3A-KO)小鼠和TPH1β细胞特异性敲除(TPH1β-KO)小鼠均表现出葡萄糖不耐受。5-HT处理可改善TPH1β-KO胰岛的胰岛素分泌,但不能改善5-HTR3A-KO胰岛的胰岛素分泌。这进一步证实了5-HTR3在5-HT调控GSIS过程中的关键作用,5-HTR3有望成为治疗T2DM的潜在靶点。
4 总结与展望
动物体内的多种外周组织都能进行5-HT的生物合成、转运和分泌。外周5-HT作为一种激素通过自分泌或旁分泌的形式作用于不同的受体,参与了机体稳态的调控。在畜牧业生产中,机体代谢紊乱会损害动物的生产性能,降低养殖业的经济效益。总结和分析外周5-HT在乳腺、骨骼、肝脏和胰岛中的作用(图3),旨在为调控哺乳动物机体稳态提供依据。随着对外周5-HT及其受体功能研究的深入,5-羟色胺能制剂将成为防治泌乳紊乱、低血钙症、骨质疏松、能量代谢失衡等疾病的有效药物。

图3 不同外周组织中5-HT的功能

