添加叔丁醇钾对Mg(NH2)2-2LiH体系储氢性能的影响
冯文钦 李 超*,,2 刘凯元 蔡明源 范美强*,
(1中国计量大学材料与化学学院,杭州 310018)
(2硅材料国家重点实验室,浙江大学材料科学与工程学院,杭州 310027)
0 引 言
氢能以其清洁高效、来源广泛、能量密度高等诸多优点被认为是理想的二次能源。制约氢能实现大规模应用的关键技术壁垒是如何实现安全、高效、低成本的储氢。与高压气态储氢和液态储氢技术相比,固态储氢技术具备安全性好和储氢密度高2大优势,因此得到国内外专家的广泛关注[1-2]。目前已开发出的高容量固态储氢材料包括MgH2、NaAlH4、LiBH4、Mg(BH4)2、Li3N、Li2MgN2H2、NH3BH3等[3-12]。2002年,Chen等[12]发现Li3N可以可逆储存质量分数11.4%的H2。后续诸多学者对金属氮氢体系储氢材料做了大量研究工作。Xiong和Luo等[13-14]通过调整Li-N-H体系中的金属原子发现,Li2MgN2H2可以吸收并可逆储存质量分数5.6%的H2,其吸放氢反应如方程式(1)所示:
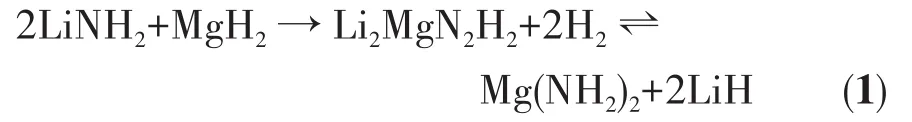
通过热力学计算发现Mg(NH2)2-2LiH体系储氢材料获得105Pa平衡氢压时所对应的反应温度为90℃,该温度已基本满足车载储氢材料的应用要求[15]。但在实际操作中,由于存在较高的动力学壁垒,Mg(NH2)2-2LiH样品需要在130℃以上才开始放氢,200℃左右才有较高的放氢速率[16]。
为了改善该体系的吸放氢动力学性能,诸多学者在降低颗粒尺寸、纳米限域、催化改性等方面做了大量的研究工作[17-35]。从该体系的放氢产物Li2MgN2H2出发,通过球磨方法调整样品的颗粒尺寸,发现样品颗粒尺寸的下降将显著降低该体系吸放氢反应的动力学壁垒[17]。Xia等[19]通过模板法制备获得了纳米限域的Li2MgN2H2,碳骨架约束下的纳米Li2MgN2H2在105℃的低温条件下即可完成可逆吸放氢。在催化改性方面,目前研究发现对Mg(NH2)2-2LiH体系有催化改性效果的添加剂包括过渡金属及其化合物、碳基材料、金属硼氢化物、碱金属基化合物及以上几类物质的复合物等[20-35]。其中,碱金属基化合物中的K基化合物对该体系的催化改性尤为明显。Wang等[28]发现将KH部分替代LiH得到的Mg(NH2)2-1.9LiH-0.1KH可在80℃开始放氢,其放氢峰值温度也仅为132℃,较原始样品降低了50℃。后续研究发现,KF、KOH、K2ZnH4等K基化合物也对该体系有较好的催化改性作用[32-34]。值得注意的是,前期关于K基催化改性剂对该体系的催化改性研究集中在含钾的无机化合物,而有机钾盐对该体系的催化改性研究未见报道。另外,在金属硼氢储氢体系中,Gu等[36]将含Ti有机化合物四乙醇钛(Ti(OEt)4)添加至Ca(BH4)2中,实现在吸放氢过程中原位引入纳米TiO2催化剂和多孔结构,从而使Ca(BH4)2的吸放氢热力学和动力学性能得到显著改善。考虑到K基添加剂对Mg(NH2)2-2LiH体系的催化改性作用,我们也希望通过添加有机钾盐,实现类似Ca(BH4)2添加四乙醇钛后的效果。叔丁醇钾(C4H9OK)是最常见的有机钾盐之一。叔丁醇根上3个甲基的诱导效应,会使其比其他醇钾具有更强的碱性和活性,因此其作为催化剂也在化工医药等方面具有广泛应用。
基于以上的文献报道和分析,我们以含钾有机化合物C4H9OK为添加剂,系统研究了其对Mg(NH2)2-2LiH体系储氢性能的影响。研究发现,C4H9OK的添加显著改善了Mg(NH2)2-2LiH体系的吸放氢性能。通过球磨制备的Mg(NH2)2-2LiH-0.08C4H9OK样品在70℃左右开始放氢,较原始样品降低了60℃。C4H9OK的添加降低了样品放氢反应的表观活化能和反应焓变,改善了放氢反应的动力学和热力学性能。130℃完全放氢后的样品可在50℃开始吸氢,150℃时已基本氢化完全。C4H9OK在Mg(NH2)2-2LiH体系吸放氢过程中起到了良好的催化改性作用。
1 实验部分
1.1 实验原材料及样品制备
所用原材料氢化锂(LiH,98%,Alfa Aesar)、镁粉(Mg,99%,Sinopharm)、C4H9OK(98%,Macklin)均为商业购买并直接使用。氨基镁(Mg(NH2)2)为实验室自主合成,具体合成步骤:首先在氩气气氛手套箱中将4 g镁粉装入带阀门的球磨罐中,接着向球磨罐中充入NH3并球磨72 h,然后再将球磨后的样品置于7×105Pa氨压条件下300℃煅烧,最终合成氨基镁。Mg(NH2)2-2LiH-xC4H9OK(x=0、0.03、0.05、0.08、0.1,代表C4H9OK的物质的量对应数值,即0、0.03、0.05、0.08、0.1 mol)样品通过机械球磨法制备而得,具体为将相应物质的量的Mg(NH2)2、LiH、C4H9OK置于球磨罐中并以500 r·min-1球磨24 h,为防止球磨过程中的放氢,球磨在5×106Pa氢压条件下进行。由于实验所需试剂会与空气中的O2和H2O发生反应,因此实验操作过程中的装样和处理等均在充满氩气的手套箱(MBRAUM)中进行,手套箱内部氧和水的含量(体积分数)均在10-6以下。
1.2 储氢性能测试
采用自制的程序控温脱附装置(TPD)进行放氢定性测试,其中载气为高纯氩气,气流量为20 mL·min-1,每次测试所用的样品量为30 mg,升温速率为1~5 ℃·min-1。另外还有一台质谱仪(MS,Hiden-QIC-20)与TPD相连接,可检测脱附气体中的组成成分。吸放氢定量测试在实验室自制的Sieverts型气-固反应装置上进行,放氢测试前要对装置进行抽真空处理,吸氢测试则在8×106Pa氢压下进行。随温放氢和随温吸氢测试的升温速率分别为2和1℃·min-1,等温吸放氢测试则是以10℃·min-1的加热速率快速升温至预定温度并保温处理,吸放氢测试的样品质量为100~120 mg。采用Netzsch DSC200F3热分析仪对样品进行差示扫描量热(DSC)测试,每次测试的样品用量约为5 mg,所用的载流气为高纯氩气,升温速率为2℃·min-1。
1.3 成分结构表征
材料的物相结构在X射线衍射仪(XRD,Rigaku MiniFlex 600)上进行测试分析,辐射源为Cu靶Kα射线,X射线波长为0.154 nm,功率为40 kV×40 mA,扫描的角度范围2θ=10°~90°,步长为0.05°。为防止测试样品与空气接触,测试过程中采用了自制透明密闭罩隔离空气。FTIR测试所用仪器为Bruker Tensor 27型傅里叶变换红外光谱仪,测试模式采用透射模式。将样品粉末与KBr粉末以1∶30的质量比混合研磨均匀,称取约100 mg混合粉末,用压片机压制成直径为13 mm的小圆片进行测试。测试时扫描波数设置为400~4 000 cm-1,分辨率为4 cm-1,数据取16次扫描的平均值。
2 结果与讨论
2.1 Mg(NH2)2-2LiH-xC4H9OK的放氢性能
为了探究不同C4H9OK添加量对Mg(NH2)2-2LiH体系放氢性能的影响,对球磨后的Mg(NH2)2-2LiH-xC4H9OK(x=0、0.03、0.05、0.08、0.1)样品做了TPD-MS测试,结果如图1所示,其中图1a为H2信号,图1b为NH3信号。H2信号显示,原始样品Mg(NH2)2-2LiH的放氢曲线仅有一个单峰,起始放氢温度、放氢峰值温度、放氢结束温度分别为130、187、235℃,这与之前的报道一致[32]。当添加C4H9OK之后,样品的放氢曲线明显向低温方向偏移且变为一条包含3个放氢峰的复杂曲线。当C4H9OK的添加量由0.03 mol逐渐增加到0.08 mol时,样品的起始放氢温度和最强放氢峰的峰值温度逐渐降低到了70和145℃,较原始样品分别降低了60和42℃;进一步增大C4H9OK的添加量到0.1 mol,样品的起始放氢温度不再继续降低,最强放氢峰值温度仍略有降低到143℃。对于放氢结束温度,添加C4H9OK后的样品也有明显的降低,当添加量到0.08 mol时,放氢结束温度降至210℃,较原始样品降低25℃。样品在加热过程中的NH3释放情况如图1b所示,Mg(NH2)2-2LiH原始样品加热到150℃后可检测出较为明显的NH3信号,NH3释放与H2释放的温度区间基本吻合。当样品添加C4H9OK后,在整个加热过程中已基本检测不到NH3的信号,说明添加C4H9OK可以有效地抑制副产物NH3的释放,这将有利于提高材料在吸放氢循环过程中的稳定性。
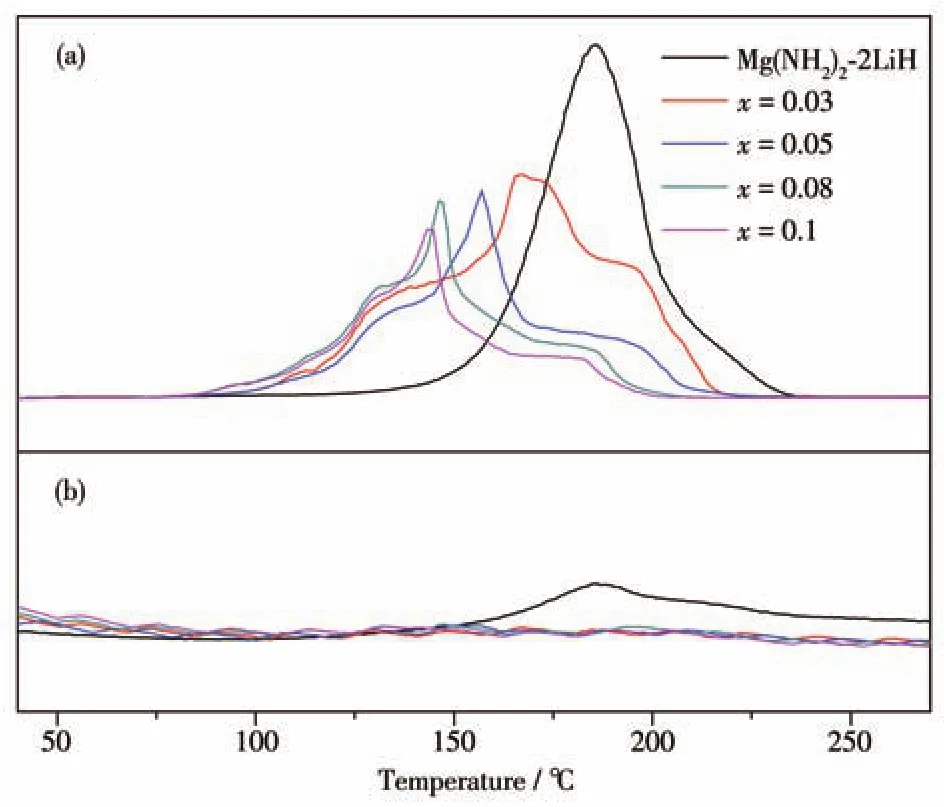
图1 Mg(NH2)2-2LiH-xC4H9OK样品的TPD-MS曲线:(a)H2信号;(b)NH3信号Fig.1 TPD-MS curves of Mg(NH2)2-2LiH-xC4H9OK samples:(a)H2 signal;(b)NH3 signal
图2为Mg(NH2)2-2LiH-xC4H9OK(x=0、0.03、0.05、0.08、0.1)样品的体积放氢曲线。Mg(NH2)2-2LiH原始样品的起始放氢温度为130℃,加热至250℃的放氢容量(质量分数,下同)为5.43%。随着C4H9OK的添加量由0.03 mol增加到0.08 mol,样品的放氢温度较原始样品逐渐降低,放氢容量也逐渐降低至4.84%。Mg(NH2)2-2LiH-0.08C4H9OK样品的起始放氢温度仅为70℃,140℃时即可释放2%的H2,而原始样品释放相同氢气量所需温度达185℃。继续增加C4H9OK的添加量至0.1 mol,样品的放氢温度较添加0.08 mol C4H9OK的样品无明显降低,但放氢容量进一步降低至4.67%,较原始样品降低约14%。5个样品的放氢温度规律与图1曲线中表现出的放氢温度规律相吻合,放氢容量随C4H9OK添加量的增大而逐渐降低。综合考虑样品的放氢温度、放氢量和抑制放氨情况可知,0.08 mol C4H9OK的添加量为最佳的添加比例。Mg(NH2)2-2LiH-0.08C4H9OK样品的起始放氢温度和放氢结束温度分别低至70和210℃,放氢容量可达到4.84%。因此,后续集中对Mg(NH2)2-2LiH-0.08C4H9OK样品进行了放氢动力学、热力学和可逆性的研究。
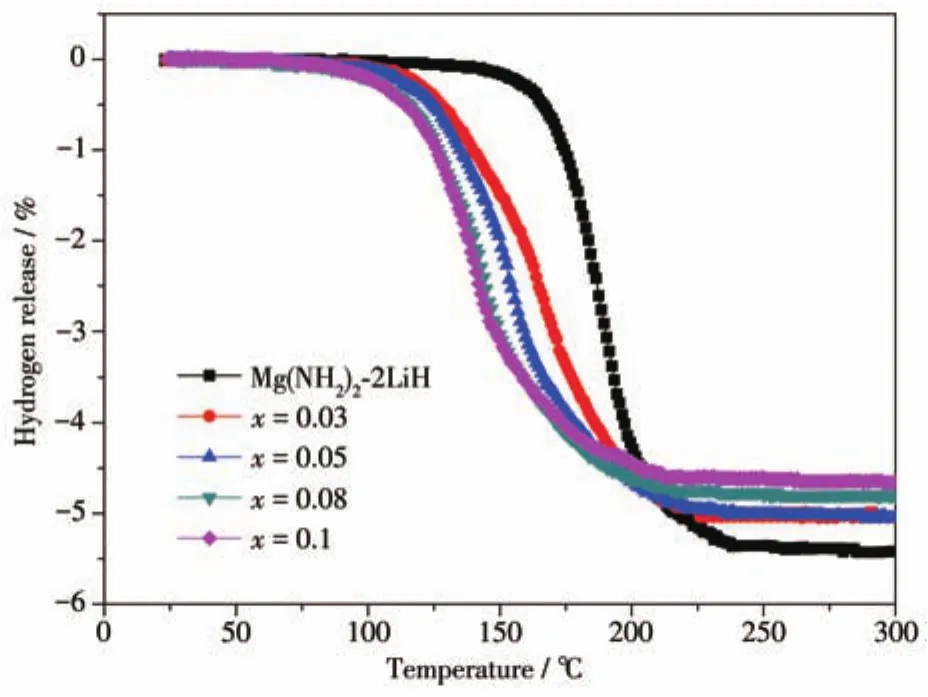
图2 Mg(NH2)2-2LiH-xC4H9OK样品的体积放氢曲线Fig.2 Volumetric release curves of Mg(NH2)2-2LiH-xC4H9OK samples
2.2 Mg(NH2)2-2LiH-0.08C4H9OK的放氢动力学和热力学
为考察添加0.08 mol C4H9OK后样品的放氢动力学性能,我们对Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK样品做了110~150℃的等温放氢测试,结果如图3所示。显然,添加C4H9OK后,Mg(NH2)2-2LiH体系的放氢动力学性能得到显著提高。Mg(NH2)2-2LiH-0.08C4H9OK样品在较低温度110℃下360 min内可以放出约2.4%的H2,而相同条件下,Mg(NH2)2-2LiH原始样品基本无H2放出。当温度上升至130℃时,Mg(NH2)2-2LiH-0.08C4H9OK样品的放氢速率进一步提高,该样品可在100 min内释放出3.31%的H2,而原始样品相同条件下仅释放出0.23%的H2。当放氢温度进一步升高至150℃时,Mg(NH2)2-2LiH-0.08C4H9OK样品在50 min内迅速放出3.82%的H2,而原始样品在该温度下即使保温360 min,放氢量也只达到3.73%。对Mg(NH2)2-2LiH-0.08C4H9OK和Mg(NH2)2-2LiH两个样品在150℃的放氢曲线进行放氢速率分析,即计算2条曲线初始阶段的斜率发现,二者的放氢速率分别为0.134%·min-1和0.013%·min-1,添加0.08 mol C4H9OK样品的放氢速率达到了Mg(NH2)2-2LiH原始样品的10倍。

图3 Mg(NH2)2-2LiH(a)和Mg(NH2)2-2LiH-0.08C4H9OK(b)样品的等温放氢曲线Fig.3 Isothermal dehydrogenation curves of Mg(NH2)2-2LiH(a)and Mg(NH2)2-2LiH-0.08C4H9OK(b)samples
一般情况下,储氢材料操作温度取决于其反应动力学和热力学,二者分别可由表观活化能(Ea)和反应焓变描述。在对Mg(NH2)2-2LiH体系的研究中,普遍采用Kissin ger法计算样品在放氢过程中的Ea[15-16,26],具体如方程式(2)所示:
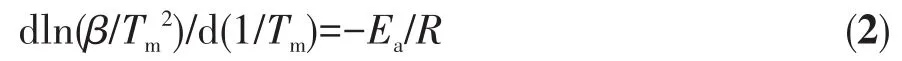
其中,β代表升温的速率,Tm代表反应峰值温度,R是理想气体常数。对样品在不同升温速率下(1~5℃·min-1)做TPD测试,可获得不同升温速率下的放氢反应峰值温度,通过数据拟合即可求得Ea的数值。图4为Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK样品在不同升温速率下的TPD曲线及其相应的Kissinger曲线。由图可知,原始样品的TPD曲线上显示一个峰值温度,经数据拟合计算得到Mg(NH2)2-2LiH样品的Ea为112.2 kJ·mol-1。这与之前报道的结果相吻合[33]。Mg(NH2)2-2LiH-0.08C4H9OK样品的TPD曲线与图1所示的MS曲线相似,放氢过程包含3个放氢峰。经拟合计算,3个放氢峰对应的Ea分别为 90.6、111.4 和 92.3 kJ·mol-1。第一步和第三步反应的Ea较原始样品分别降低了19.25%和17.74%,第二步反应的Ea较原始样品略有降低。整体而言,Ea的降低是Mg(NH2)2-2LiH-0.08C4H9OK样品放氢温度得以降低、反应动力学性能提高的主要原因之一。

图4 Mg(NH2)2-2LiH(a、b)和Mg(NH2)2-2LiH-0.08C4H9OK(c、d)样品在不同升温速率下的TPD曲线及其Kissinger曲线Fig.4 TPD curves and Kissinger plots of Mg(NH2)2-2LiH(a,b)and Mg(NH2)2-2LiH-0.08C4H9OK(c,d)samples
图5为Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK样品的DSC曲线。与原始样品相比,添加C4H9OK样品的放氢过程中的吸热曲线变为包含3个吸热峰的较复杂曲线,说明放氢反应历程发生了一定的变化。另外,Mg(NH2)2-2LiH-0.08C4H9OK样品的放氢吸热峰明显向低温方向偏移,进一步印证了添加C4H9OK后样品放氢温度的降低。Mg(NH2)2-2LiH-0.08C4H9OK样品在190~230℃之间出现了一个较为明显的放热峰,该放热峰可能是源于放氢产物Li2MgH2H2由立方相到正交相的晶型转变,其他K基添加剂体系中也发现了相似的情况[29],该结果也会在后面的结构分析中得到进一步验证。对Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK两个样品的放热峰做积分处理,得到二者放氢过程中的热效应分别为(1 060±10.6)和(919±9.2)J·g-1,其对应的放氢反应焓变分别为(39.3±0.4)和(38.3±0.4)kJ·molH2-1(生成1 mol H2对应的焓变)。添加0.08 mol C4H9OK样品的放氢反应焓变较原始样品有一定的降低,这也是Mg(NH2)2-2LiH-0.08C4H9OK样品放氢反应温度降低的原因之一。综上所述,Mg(NH2)2-2LiH-0.08C4H9OK样品的放氢反应活化能和反应焓变均有不同程度的降低,说明该体系的放氢反应动力学和热力学性能均有一定的提高和改善,从而使该体系放氢反应温度降低、储氢性能得以改善。
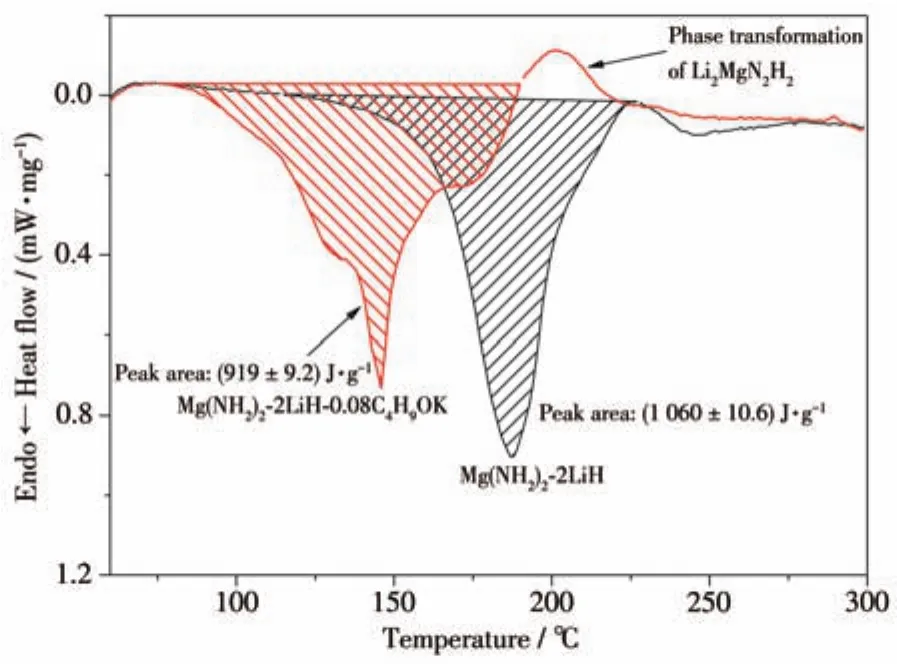
图5 Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK样品的DSC曲线Fig.5 DSC curves of Mg(NH2)2-2LiH and Mg(NH2)2-2LiH-0.08C4H9OK samples
2.3 Mg(NH2)2-2LiH-0.08C4H9OK的可逆及循环储氢性能
为了进一步研究C4H9OK的添加对该体系吸氢性能的影响,首先将Mg(NH2)2-2LiH-0.08C4H9OK样品在130℃条件下完全放氢,然后对放氢样品在8×106Pa氢压下做吸氢测试。作为吸氢参比样,Mg(NH2)2-2LiH样品先在180℃条件下做完全放氢处理;为了避免因放氢温度不同引起颗粒尺寸大小不同的影响,又对放氢后的Mg(NH2)2-2LiH样品进行了24 h的高能球磨处理。图6为Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK样品的200℃下的随温吸氢曲线和120℃下的等温吸氢曲线。
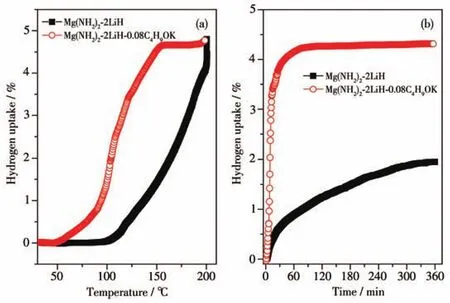
图6 Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK样品的随温吸氢曲线(a)和120℃下的等温吸氢曲线(b)Fig.6 Variable temperature hydrogenation(a)and isothermal hydrogenation(b)curves of Mg(NH2)2-2LiH and Mg(NH2)2-2LiH-0.08C4H9OK samples at 120℃
由图6a可知,Mg(NH2)2-2LiH原始样品的起始吸氢温度约为100℃,而Mg(NH2)2-2LiH-0.08C4H9OK样品的起始吸氢温度仅为50℃,较原始样大幅降低了50℃。随着温度逐渐升高,添加0.08 mol C4H9OK的样品在150℃时的吸氢量(质量分数,下同)即达到接近饱和氢化的4.65%,而相同温度条件下原始样品的吸氢量仅为1.36%。进一步将操作温度升高至200℃并保温2 h,Mg(NH2)2-2LiH-0.08C4H9OK样品的吸氢量略微增加至4.75%,Mg(NH2)2-2LiH逐渐升高至4.80%。对比图2所示的首次放氢容量,在此条件下,Mg(NH2)2-2LiH-0.08C4H9OK已基本实现完全可逆化吸氢,而原始样品的可逆吸氢量约为88%。由此可见,C4H9OK的添加显著降低了样品的氢化操作温度,极大改善了Mg(NH2)2-2LiH体系的吸氢性能。
为了进一步探究添加C4H9OK对Mg(NH2)2-2LiH体系吸氢动力学的影响,对完全放氢后的Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK两个样品又分别做了120℃的等温吸氢测试,实验结果如图6b所示。在8×106Pa氢压和120℃的条件下,原始Mg(NH2)2-2LiH样品的吸氢较为缓慢,在360 min内的吸氢量为1.95%;然而在相同的氢压和温度下,Mg(NH2)2-2LiH-0.08C4H9OK样品在50 min内就可以快速吸收4.11%的H2,360 min的吸氢量为4.32%。通过分析计算Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK两条吸氢曲线线性部分的斜率,可得2个样品的吸氢速率分别为0.042%·min-1和0.46%·min-1,即Mg(NH2)2-2LiH-0.08C4H9OK样品的吸氢速率约为原始样品的11倍。C4H9OK的添加显著提高了Mg(NH2)2-2LiH体系的吸氢动力学性能。
图7为Mg(NH2)2-2LiH-0.08C4H9OK样品10次吸放氢循环过程中的体积放氢曲线和循环容量图。循环条件为170℃保温2 h下进行放氢测试,150℃保温2 h下进行吸氢测试。如图所示,样品在第一次循环时效果最好,在加热阶段即有3.83%的放氢量,保温2 h后的最终放氢量为4.38%。第二次循环时,样品的放氢曲线向高温方向偏移,升温阶段的放氢量降低至1.72%,保温后的最终放氢量为4.14%。第三次循环时放氢曲线又向高温方向略有偏移,最终的放氢量为3.60%。后面的第四至第十个循环,样品的放氢曲线基本重合,最终放氢容量也基本保持在质量分数3.55%左右。由此可见,Mg(NH2)2-2LiH-0.08C4H9OK样品在该循环条件下,前3次循环过程中样品的放氢反应温度逐渐向高温偏移,放氢容量也逐渐由4.38%降低至3.60%,后7个循环中样品表现出良好的循环稳定性,储氢容量保持在3.55%左右。前3个循环放氢性能变差的原因主要为球磨的样品颗粒尺寸较小,样品中的缺陷较多,在吸放氢循环反应过程中样品颗粒尺寸会略有增大,缺陷也会逐渐减少,从而使反应动力学性能略有变差。当颗粒尺寸达到一个稳定状态后,样品表现出良好的循环稳定性。
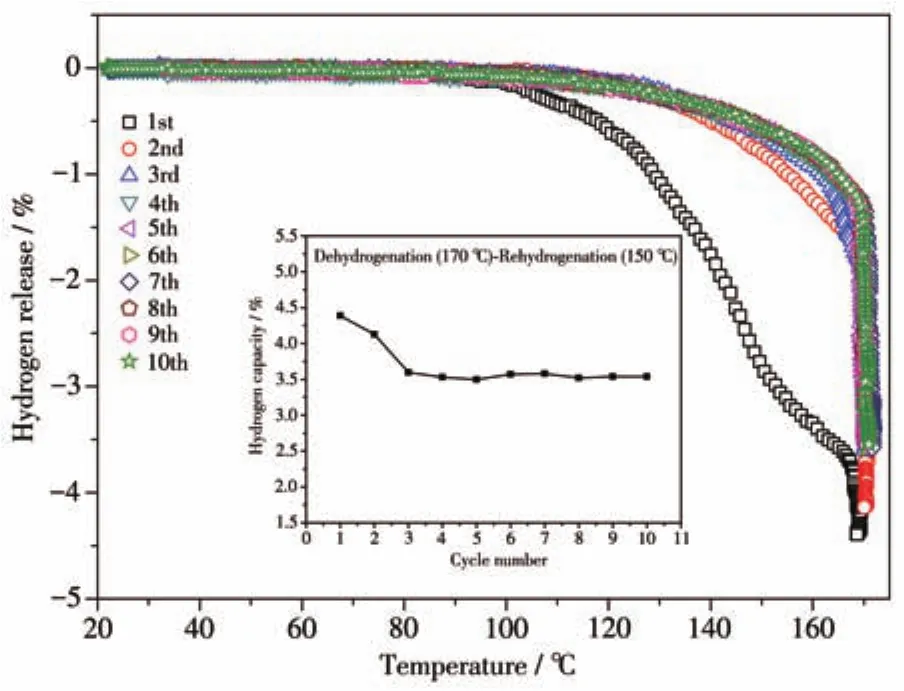
图7 Mg(NH2)2-2LiH-0.08C4H9OK样品可逆循环过程中的体积放氢曲线和循环容量图Fig.7 Volumetric release curves and cycling capacities for the reversible hydrogen storage of Mg(NH2)2-2LiH-0.08C4H9OK sample
2.4 C4H9OK在放氢过程中的作用机制
图8为Mg(NH2)2-2LiH-0.08C4H9OK样品在不同放氢阶段的XRD图和FTIR谱图。对于球磨后的样品,在XRD图上2θ为38.2°、44.4°、64.6°处检测到了LiH的衍射特征峰,FTIR谱图上在3 272、3 328 cm-1处检测到Mg(NH2)2的N—H键吸收特征峰。此外,FTIR谱图中2 854、2 890、2 920、2 955 cm-1处也有4个明显的FTIR吸收峰,该吸收位置属于C—H键伸缩振动的吸收范围,因此认为此处的4个FTIR吸收峰与C4H9OK相关。对C4H9OK本身做FTIR测试(图9)发现,其在 2 854、2 890、2 920、2 955 cm-1处的FTIR吸收峰与球磨后的Mg(NH2)2-2LiH-0.08C4H9OK样品完全一致,而Mg(NH2)2-2LiH原始样品在这4个波数处没有FTIR吸收。由此可知,球磨后C4H9OK本身并未发生变化。XRD图中未检测到Mg(NH2)2和C4H9OK的衍射特征峰,原因是Mg(NH2)2球磨后会变为无定形态,C4H9OK的添加量太少且高能球磨也会导致其非晶化。综上可知,球磨后的Mg(NH2)2-2LiH-0.08C4H9OK样品仍然为Mg(NH2)2、LiH和C4H9OK三相。

图8 Mg(NH2)2-2LiH-0.08C4H9OK样品在不同放氢阶段的XRD图(a)和FTIR谱图(b)Fig.8 XRD patterns(a)and FTIR spectra(b)of dehydrogenated Mg(NH2)2-2LiH-0.08C4H9OK samples at different stages
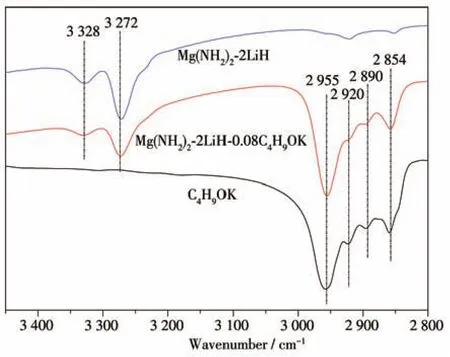
图9 C4H9OK粉末、球磨后的Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK样品的FTIR谱图Fig.9 FTIR spectra of the C4H9OK,as-milled Mg(NH2)2-2LiH and Mg(NH2)2-2LiH-0.08C4H9OK samples
当温度上升至100℃时,Mg(NH2)2-2LiH-0.08C4H9OK样品的FTIR和XRD图上的吸收峰和衍射峰位置与球磨后的样品基本一致,无明显变化。当样品加热至130℃时,XRD图在30.3°和51.0°处出现了Li2Mg2N3H3的衍射特征峰,FTIR谱图同样在3 191 cm-1处检测到了Li2Mg2N3H3的FTIR吸收特征峰。当升温至145℃时,XRD图中30.3°和51.0°处的Li2Mg2N3H3的特征峰明显增强,同时在60.7°处出现了Li2Mg2N3H3的另一个衍射特征峰,而LiH的衍射峰消失了;FTIR谱图上Mg(NH2)2吸收特征峰消失了,取而代之的是在3 259、3 312 cm-1处检测到了LiNH2的FTIR特征峰,Li2Mg2N3H3的吸收特征峰偏移至 3 189 cm-1。在该过程中,2 854、2 890、2 920、2 955 cm-1处C4H9OK的FTIR特征峰并无明显变化。因此,该阶段的放氢反应如方程式(3)所示,C4H9OK起催化改性的作用。
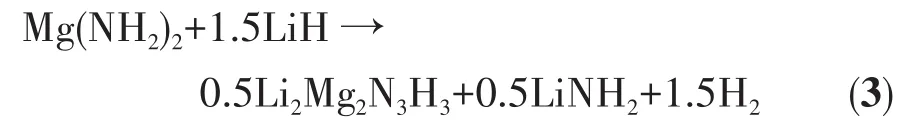
当温度处于145~180℃之间时,XRD图上没有新的衍射特征峰出现,FTIR结果显示,LiNH2在3 259、3 312 cm-1处的吸收特征峰随温度升高有所减弱,Li2Mg2N3H3的吸收特征峰继续红移至3 179 cm-1处,该FTIR吸收峰与立方相Li2MgN2H2相接近。这说明Li2Mg2N3H3与LiNH2和剩余的LiH已经开始发生反应生成Li2MgN2H2,如反应式(4)所示。值得注意的是,该阶段C4H9OK对应的4个FTIR吸收峰仍无明显变化,说明在该反应的初始阶段C4H9OK仍起到催化改性作用。在180℃前的放氢阶段,C4H9OK中K元素的存在可弱化氨基物/亚氨基物内部的N—H键和Li—N键,这将有利于放氢反应过程中原子/离子的重排、迁移和传递等,从而加快放氢反应的进行,改善材料的放氢反应动力学性能。
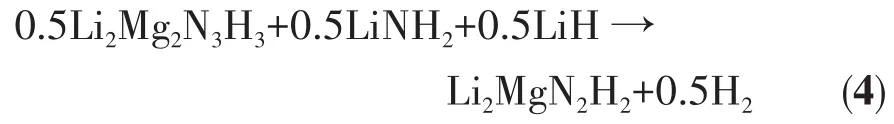
当样品继续升温至210℃时,XRD图和FTIR谱图较180℃时的有较大区别。XRD图上主要有17.5°、30.7°、42.6°、50.9°、61.0°、75.5°六个特征衍射峰,均属于立方相Li2MgN2H2。此时FTIR谱图上N—H键的最强峰在3 174 cm-1处,该峰为立方相的Li2MgN2H2的吸收特征峰,此结果也与XRD数据相吻合。另外,XRD图中21.4°处有一个较为明显的衍射特征峰,该峰为Li3K(NH2)4的最强衍射峰。FTIR谱图上3 256、3 296、3 312 cm-1处出现了新的FTIR吸收峰,这些峰也属于Li3K(NH2)4[32];同时,C4H9OK在2 854、2 890、2 920、2 955 cm-1处的吸收峰明显减弱。以上情况说明,该阶段C4H9OK已经开始分解,其中K元素最终以Li3K(NH2)4的形式存在。
当温度继续升高至250℃时,XRD图上占主导地位的是正交相 Li2MgN2H2,同时在 12.3°和 21.4°处检测到了Li3K(NH2)4的衍射峰。FTIR谱图显示,3 174 cm-1处立方相的Li2MgN2H2的FTIR吸收峰消失,在3 161、3 183 cm-1处检测到正交相Li2MgN2H2的FTIR吸收峰,结果与XRD相符合,而C4H9OK的FTIR吸收峰已基本消失。这说明在这一阶段放氢主产物Li2MgN2H2发生了由立方相向正交相的晶型转变,该结果也与图5中的DSC测试结果相吻合。同时,C4H9OK已基本完全分解并参与反应最终生成Li3K(NH2)4。
综合可知,整个放氢过程的主反应为Mg(NH2)2与LiH首先反应生成Li2Mg2N3H3和LiNH2,Li2Mg2N3H3、LiNH2继续与剩余的LiH反应生成Li2MgN2H2。在此过程中,180℃前较低温度阶段C4H9OK并未发生明显变化,其起到了催化改性的作用,当温度进一步升高时,C4H9OK将会分解并参与放氢反应最终生成Li3K(NH2)4。
3 结论
详细研究了添加不同量C4H9OK对Mg(NH2)2-2LiH体系吸放氢性能的影响,其中添加量为0.08 mol时表现出最佳催化改性效果。Mg(NH2)2-2LiH-0.08C4H9OK样品的放氢容量为4.84%,其起始放氢温度和放氢峰值温度分别为70和145℃,较原始样品分别降低了60和42℃。150℃条件下,Mg(NH2)2-2LiH-0.08C4H9OK样品在50 min内即可迅速放出质量分数3.82%的H2,表现出极好的放氢动力学性能。该体系的表观活化能和反应焓变降低、放氢反应动力学和热力学性能的改善是样品放氢温度降低的原因。对于130℃放氢后的Mg(NH2)2-2LiH-0.08C4H9OK样品,随温条件下可在50℃开始吸氢,150℃时接近完全氢化;120℃等温条件下可在50 min内快速吸收4.11%的H2,表现出良好的可逆吸氢性能。机理分析发现,180℃之前,C4H9OK对Mg(NH2)2-2LiH体系的放氢起催化改性作用,进一步升高温度后,C4H9OK将会分解并参与放氢反应最终生成Li3K(NH2)4。
- 无机化学学报的其它文章
- Synthesis and Characterization of Palladium Nanoparticles with High Proportion of Exposed(111)Facet for Hydrogenation Performance
- Syntheses,Crystal Structures,Luminescence and Catalytic Activity of Manganese(Ⅱ)and Cadmium(Ⅱ)Coordination Polymers Based on 2,3-Dihydroxy-terephthalic Acid
- Scale-Up Strategy to Develop Highly-Effective Co-N-C@KB Composites as Sulfur Host for Lithium-Sulfur Battery
- Self-Assembled Zn2+,Co2+ and Ni2+ Complexes Based on Coumarin Schiff Base Ligands:Synthesis,Crystal Structure and Spectral Properties
- Synthesis,Characterization,and X-ray Crystal Structure Analysis of Cu(Ⅰ)/Cu(Ⅱ)Complexes of Phenanthridine and Triphenylphosphine
- 荧光猝灭型硼氟二吡咯类Cu2+探针的合成及其生物细胞成像的应用

