磁性Fe3O4负载Schiff碱材料的合成及其吸附Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)的性能
贾东旭 黄湘湘 胡椿奎 费灵燕 尤浪浪 吕春欣*,,2 钟 伟*,
(1嘉兴学院生物与化学工程学院,嘉兴 314001)
(2中国科学院仿生材料与界面科学重点实验室(理化技术研究所),北京 100190)
在我国现代工业快速发展的同时,水资源的污染情况却日益加重。其中,重金属元素作为废水中的主要成分之一,其污染情况日趋严重。重金属具有剧毒、难降解等特点,进入环境后会对生态环境和人类健康造成不利的影响[1-3],目前已成为全球性的环境问题。针对当前水体重金属污染的严峻形势,如何减轻水体中重金属污染问题,减轻重金属对人体的危害,寻找高效去除水中重金属离子的方法成为亟待解决的问题[4]。重金属离子的处理方法主要包括化学沉淀法、电解法、离子交换法、膜分离法和吸附法[5-6]。其中,吸附法因具有简单、高效、不易造成二次污染、吸附效果好等优点而被广泛应用[7-11]。随着环境分子科学的不断发展,近年来有不少学者已经将纳米Fe3O4的研究扩展到污染水体中的重金属离子吸附。Fe3O4及功能化Fe3O4磁性纳米材料以优越的磁性分离和吸附特性在废水中重金属离子净化方面表现出卓越的性能[12-14]。另一方面,超顺磁Fe3O4材料因其表面积大、吸附效率高、成本低、分离方便等优点引起了科学家们的广泛关注[15-17]。如关晓辉等利用纳米Fe3O4与浮游球衣菌进行复合后,对提高水溶液中的Pb(Ⅱ)和Cu(Ⅱ)吸附起到很好效果[18]。但Fe3O4纳米颗粒由于易团聚、暴露在空气中容易被氧化等缺陷严重影响其稳定性,从而限制了其在金属离子去除和分离中的应用[19]。为了克服以上缺点,通常采取在Fe3O4粒子表面包裹适当的物质,以提高其稳定性。包裹剂包括SiO2、碳、氧化石墨烯、壳聚糖等[20-21]。其中,由于SiO2具有良好的热稳定性和化学稳定性,因此被广泛应用于包裹磁性Fe3O4以满足实际应用中的需求[22]。例如Masjedi等合成Fe3O4@SiO2@GLYMO(S)-en(GLYMO=Glycidoxypropyl-trimethoxysilane,en=ethylenediamine)核壳磁微球,其可高效吸附水溶液中的Pb(Ⅱ)和Cd(Ⅱ)[23]。
Schiff碱配体是由胺基和活性羰基缩合而成,由于Schiff碱中存在可以提供孤电子对的—C=N—键,使Schiff碱配体具有较强的配位能力[24-25]。因此,采用Schiff碱配体功能化Fe3O4@SiO2表面,结合二者的优势,为构建高效的吸附剂提供可行性。例如Moradinasab等利用水杨醛形成的Schiff碱修饰Fe3O4@SiO2去除 Cu(Ⅱ)、Zn(Ⅱ)和 Ni(Ⅱ)[26]。Niu 等采用共沉淀法合成了磁性纳米Fe3O4,随后通过与正硅酸乙酯的溶胶-凝胶化反应得到SiO2表面包覆的Fe3O4,之后分别采用均相法和开相法,通过与三乙氧基氨丙基硅烷和水杨醛的反应合成了磁性Fe3O4负载Schiff碱吸附材料[27-28],研究了吸附材料对水体中Pb(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)和Ag(Ⅰ)的去除能力,证明了磁性Fe3O4负载Schiff碱功能材料在去除水中重金属污染领域具有较广的发展空间。Setoodehkhah等利用水溶性Schiff碱功能化Fe3O4@SiO2,得到可溶性的吸附材料,可以高效去除水溶液中的Pb(Ⅱ)和Cu(Ⅱ)[29]。因此,制备出高效且经济的磁性Fe3O4负载Schiff碱吸附剂材料仍然是广泛研究的热点。
分别采用均相法和开相法合成Schiff碱功能化Fe3O4材料用于去除水中Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ),系统研究了合成方法、pH值、离子浓度和Schiff碱上取代基的结构不同对吸附性能的影响,并研究了吸附材料的再生性能,以期通过探索获得经济、高效的重金属污水净化剂。
1 实验部分
1.1 试剂与仪器
实验所用的试剂均为分析纯,所用水均为去离子水。三氯化铁六水合物、二氯化铁四水合物、二氯化镉二水合物、硝酸铅、硅胶、2-羟基-3-甲氧基苯甲醛、5-氟水杨醛、5-硝基水杨醛、3-氨丙基三乙氧基硅烷(APTES)和3-乙氧基水杨醛购自阿拉丁试剂有限公司;2-羟基-5-甲氧基苯甲醛、硫酸铜五水合物购自九鼎化学科技有限公司;水杨醛购自国药集团化学试剂有限公司;甲苯购自临安青山化工试剂厂;氢氧化钠和乙醇购自上海麦克林生化科技有限公司。Fe3O4和Fe3O4@SiO2采用文献方法合成[27,30]。所有药品和试剂不经任何处理直接使用。
实验中使用的仪器型号如下:NEXUS470红外光谱仪(Thermo Nicolet,扫描范围为400~4 000 cm-1,分辨率为0.5);D8 Advance型X射线粉末衍射仪(Bruker-AXS),采用Cu靶Kα射线,入射波长为0.154 06 nm,工作电压为40 kV,工作电流为30 mA,扫描范围2θ=5°~80°,扫描速率为6(°)·min-1;Inspect F50扫描电子显微镜(SEM,美国FEI公司,喷金测试,加速电压5 kV);SHA-B水浴恒温振荡仪(常州国华,温度30 ℃,频率75 r·min-1);Thermo ice3500原子吸收光谱仪(德国,石墨炉)。
1.2 磁性Fe3O4负载Schiff碱吸附材料Fe3O4@SiO2-HE和Fe3O4@SiO2-HO的合成
通过开相法和均相法共合成12种磁性Fe3O4负载Schiff碱吸附材料,即Fe3O4@SiO2-HE系列(开相法)和Fe3O4@SiO2-HO系列(均相法),并采用FTIR、XRD和SEM对所得材料进行全面表征。
1.2.1 Fe3O4@SiO2-NH2的合成
将2 g Fe3O4@SiO2加入三颈烧瓶中,加入45 mL甲苯,超声分散1 h,使Fe3O4@SiO2均匀分散在甲苯中。机械搅拌下加入2.5 mL APTES,N2保护70℃下搅拌反应8 h,反应结束后,磁性分离,并将产品放入索式提取装置中分别用甲苯和乙醇提取12 h,最后将产物置于真空干燥箱中60℃下烘干,得到Fe3O4@SiO2-NH2。
1.2.2 开相法合成Fe3O4@SiO2-HE
将2.5 mL水杨醛和15 mL无水乙醇加入三颈烧瓶,随后加入1.5 g Fe3O4@SiO2-NH2,将反应混合物超声1 h使之分散均匀。N2保护下70℃反应8 h,反应完成后,磁性分离,并将产品放入索式提取装置中分别用甲苯和乙醇提取12 h,最后将产物置于真空干燥箱中60℃烘干得到Fe3O4@SiO2-HE-1(图1)。按照上述Fe3O4@SiO2-HE-1的合成方法,分别用3-乙氧基水杨醛、2-羟基-5-甲氧基苯甲醛、2-羟基-3-甲氧基苯甲醛、5-氟水杨醛、5-硝基水杨醛替代水杨醛即可得到Fe3O4@SiO2-HE-2、Fe3O4@SiO2-HE-3、Fe3O4@SiO2-HE-4、Fe3O4@SiO2-HE-5、Fe3O4@SiO2-HE-6。

图1 Fe3O4@SiO2-HE的开相法合成路线图Fig.1 Synthesis route of Fe3O4@SiO2-HE via heterogeneous method
1.2.3 均相法合成Fe3O4@SiO2-HO
在N2保护下,将1.5 mL水杨醛和3.5 mL无水乙醇置于三颈烧瓶中,加热回流,随后逐滴加入3.5 mL APTES并继续反应3 h,得到功能化硅烷偶联剂。随后加入2 g Fe3O4@SiO2,再加入25 mL甲苯,超声分散均匀,并于70℃下机械搅拌反应6 h。反应完成后,磁性分离,并将产品放入索式提取装置中分别用甲苯和乙醇提取12 h,最后将产物置于真空干燥箱中60℃烘干得到Fe3O4@SiO2-HO-1(图2)。按照上述Fe3O4@SiO2-HO-1的合成方法,分别用3-乙氧基水杨醛、2-羟基-5-甲氧基苯甲醛、2-羟基-3-甲氧基苯甲醛、5-氟水杨醛、5-硝基水杨醛替代水杨醛,即可得到 Fe3O4@SiO2-HO-2、Fe3O4@SiO2-HO-3、Fe3O4@SiO2-HO-4、Fe3O4@SiO2-HO-5、Fe3O4@SiO2-HO-6。

图2 Fe3O4@SiO2-HO的均相法合成路线图Fig.2 Synthesis route of Fe3O4@SiO2-HO via homogeneous method
1.3 Fe3O4@SiO2-HE和Fe3O4@SiO2-HO吸附性能研究
1.3.1 吸附性能测试
分别称取20 mg的Fe3O4@SiO2-HE系列和Fe3O4@SiO2-HO系列产品置于锥形瓶中,加入20 mL 2 mmol·L-1的重金属离子溶液,在pH=6、30 ℃下振荡12 h,用磁铁分离溶液与吸附剂。取一定量的上层溶液置于容量瓶中定容,然后用原子吸收分光光度法测定溶液中重金属离子的浓度,采用式(1)进行计算。

式中q为吸附剂的饱和吸附量(mmol·g-1),c0为吸附前重金属离子的浓度(mmol·mL-1),c为原子吸收分光光度计测得的金属离子的浓度(mmol·mL-1),V为溶液的体积(mL),m为吸附剂的质量(g)。
1.3.2 离子浓度对吸附性能的影响
取20 mg吸附剂Fe3O4@SiO2-HE-2和20 mL不同离子浓度(1~5 mmol·mL-1)的Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)溶液超声混合均匀。混合物在pH=6、30℃条件下振荡、摇匀12 h,测定金属离子浓度。吸附容量按式(1)计算。
1.3.3 pH对吸附性能的影响
取20 mg吸附剂Fe3O4@SiO2-HE-2和20 mL 2 mmol·L-1不同 pH 值(1.0~6.0)的 Cu(Ⅱ)、Pb(Ⅱ)和 Cd(Ⅱ)溶液超声充分混合。混合物在30℃下振荡、摇匀12 h,测定金属离子浓度。吸附容量按式(1)计算。
1.3.4 吸附剂的再生性能研究
称取20 mg Fe3O4@SiO2-HE-2吸附剂加入到20 mL 2 mmol·L-1Pb(Ⅱ)溶液中,在pH=6、30 ℃下振荡、摇匀12 h,磁性分离,得到上层清液。抽滤得到配位Pb(Ⅱ)后的吸附剂于60℃的烘箱中烘8 h,准确称取一定量吸附Pb(Ⅱ)的吸附剂用20 mL质量分数5%硫脲-0.5 mol·L-1硝酸溶液30℃振荡解吸6 h,磁性分离,保留上层清液并抽滤,将吸附剂分离出来后在60℃的烘箱中干燥8 h后称重。用上述同样的方法再生循环3次,计算再生率,得到Fe3O4@SiO2-HE-2的再生效果。
2 结果与讨论
2.1 Fe3O4@SiO2-HE和Fe3O4@SiO2-HO系列材料的表征
2.1.1 FTIR
由图3可知,在Fe3O4的谱图中,Fe—O在586 cm-1处出现了特征振动吸收峰。与活化硅胶反应后,由于Si—O—Si的伸缩振动,在1 096 cm-1处出现了强吸收峰,3 430 cm-1处羟基的吸收峰大大增强,说明SiO2成功地包裹了Fe3O4。对于Fe3O4@SiO2-NH2,2 922和2 850 cm-1处出现的新的吸收峰属于亚甲基带的不对称和对称吸收,说明氨丙基被成功地引入到Fe3O4@SiO2上。1 461和1 402 cm-1处的吸收峰归属为—C=N—键的特征峰;1 200 cm-1处为—OC2H5的特征吸收峰;1 250 cm-1处则为—OCH3的特征吸收峰;1 355 cm-1处为C—F键的吸收峰,1 540和1 330 cm-1是—NO2的特征吸收峰。
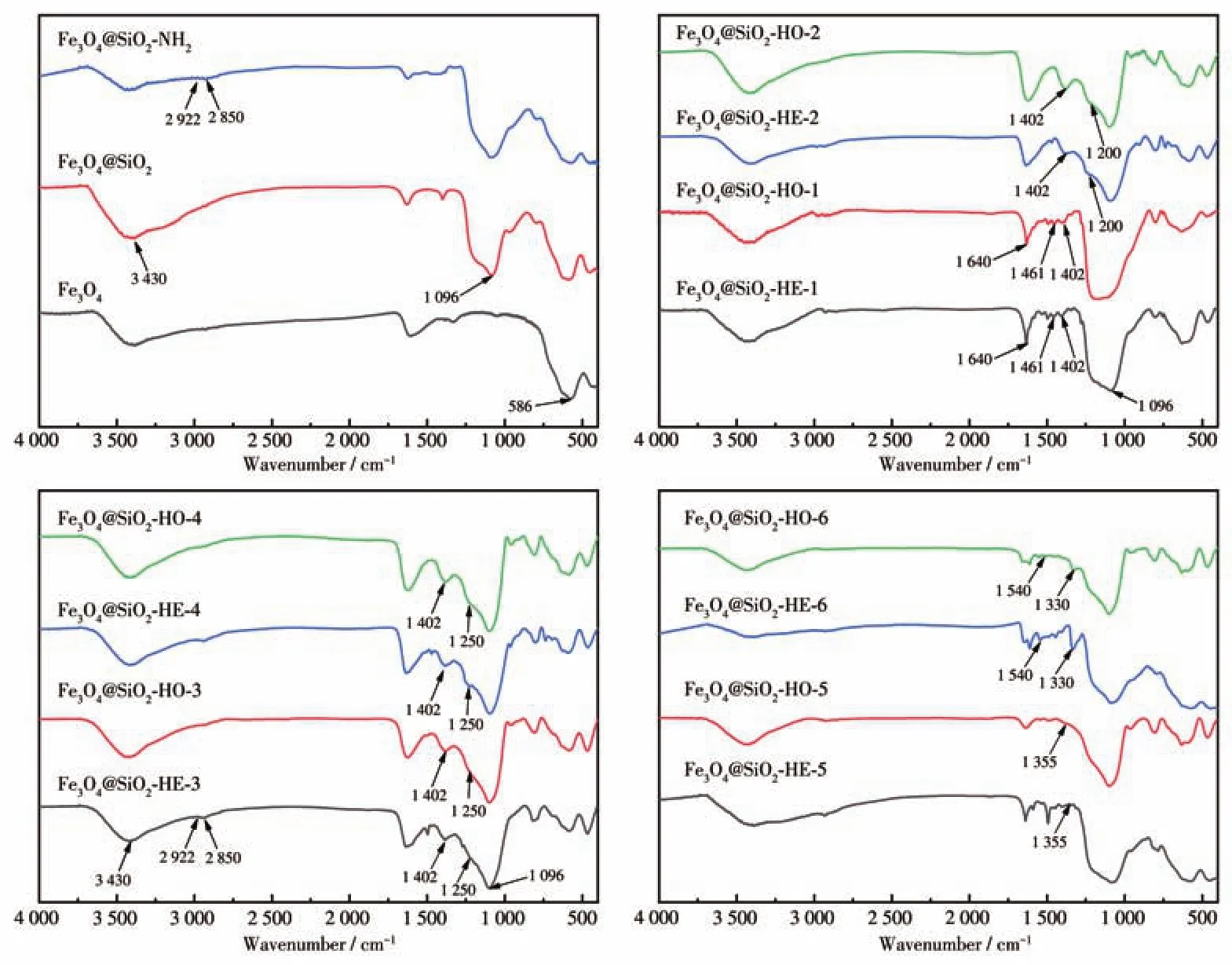
图3 样品的FTIR谱图Fig.3 FTIR spectra of the samples
2.1.2 XRD表征
由图4可以看出,Fe3O4的XRD图在2θ为30.1°、35.4°、43.1°、53.5°、57.2°和62.7°处出现特征峰,分别对应 Fe3O4的(220)、(311)、(400)、(422)、(511)和(440)晶面。除此之外,在Fe3O4的XRD图中未观察到其他峰,表明产物为纯净的面心立方Fe3O4的结晶相。图4下方2个图中位于约22°处的衍射峰属于SiO2的非晶态衍射峰。功能化后,Fe3O4的特征峰的位置没有改变,这表明引入Schiff官能团不会影响Fe3O4的晶体结构。
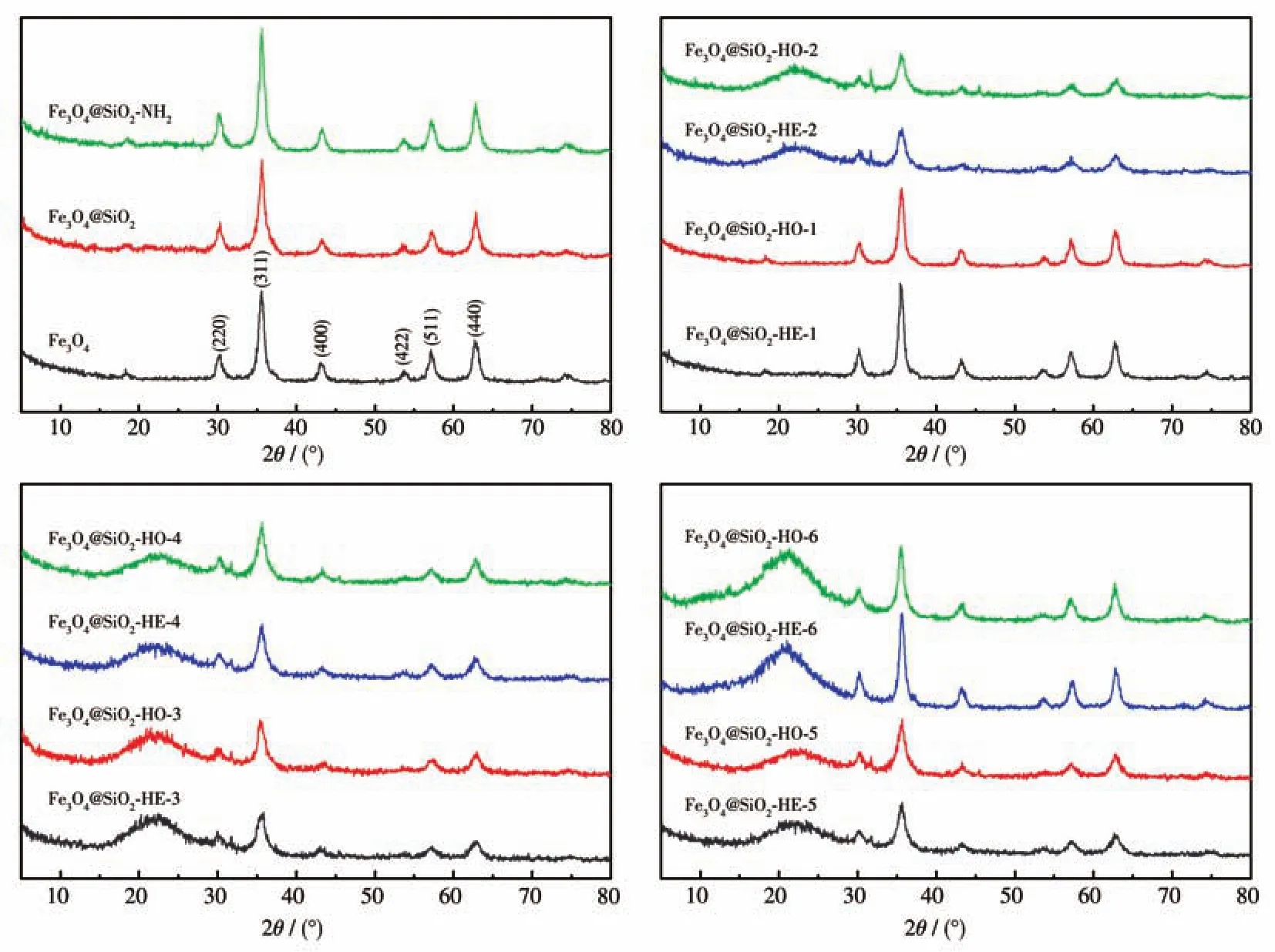
图4 样品的XRD图Fig.4 XRD patterns of the samples
2.1.3 SEM和比表面积表征
我们选取了吸附性能较好的Fe3O4@SiO2-HE-2和Fe3O4@SiO2-HO-2进行了SEM形貌表征。由图5可以看出,通过开相法与均相法都成功合成了尺寸不一的块状磁性Fe3O4负载Schiff碱吸附材料Fe3O4@SiO2-HE-2和Fe3O4@SiO2-HO-2。我们进一步选用Fe3O4@SiO2-HE-2进行了N2吸附-脱附测试(图6)。由图可以看出,此等温线属于IUPAC分类中的Ⅳ型,在p/p0=0.50~0.90时吸附量有一突增,表明样品中存在明显的介孔结构。从孔径分布图中可以看出孔径分布均匀,主要集中在10 nm左右,比表面积为141 m²·g-1。说明Fe3O4@SiO2-HE-2具有较小的粒径和较大的比表面积,有利于对金属离子进行吸附。

图5 Fe3O4@SiO2-HE-2(a)和Fe3O4@SiO2-HO-2(b)的SEM图Fig.5 SEM images of Fe3O4@SiO2-HE-2(a)and Fe3O4@SiO2-HO-2(b)
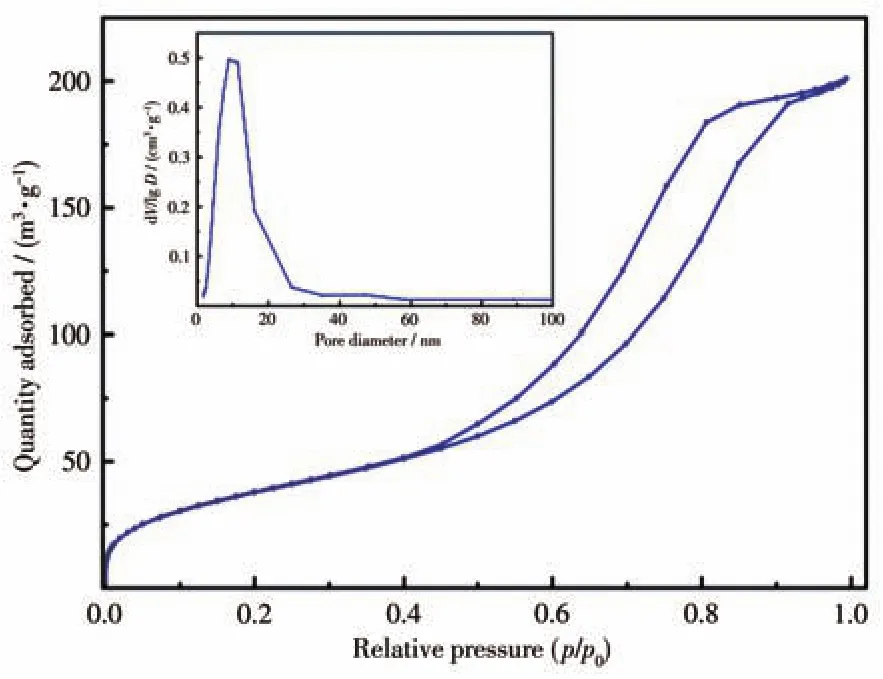
图6 Fe3O4@SiO2-HE-2的N2吸附-脱附等温线Fig.6 N2 adsorption-desorption isotherm of Fe3O4@SiO2-HE-2
2.2 吸附性能研究
Fe3O4@SiO2-HE和Fe3O4@SiO2-HO系列材料对Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)均表现出良好的吸附性能(图7),前者的吸附量明显高于后者,说明开相法得到的吸附材料的吸附性优开。Fe3O4@SiO2-HE-2吸附效果最佳,对离子的吸附量大小顺序为Pb(Ⅱ)>Cd(Ⅱ)>Cu(Ⅱ)。从图中可以看出,水杨醛衍生物所含基团的电子性对吸附材料的吸附性能影响较大。供电子基团使得配体的电子云密度增大,金属更容易与配体进行配位,从而使吸附材料的吸附性能增强。相反,吸电子基团使得配体的电子云密度降低,导致金属与配体的配位相对较弱,使吸附材料的吸附性能降低[31]。在制备的一系列磁性Fe3O4负载Schiff碱吸附材料中,采用开相法、以3-乙氧基水杨醛为底物合成得到的Fe3O4@SiO2-HE-2吸附性能最佳。
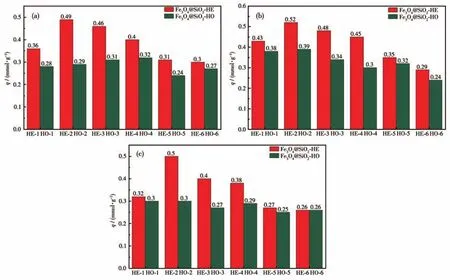
图7 磁性Fe3O4负载Schiff碱吸附材料对金属离子Cu(Ⅱ)(a)、Pb(Ⅱ)(b)和Cd(Ⅱ)(c)的饱和吸附量Fig.7 Saturation adsorption capacity of Cu(Ⅱ) (a),Pb(Ⅱ) (b),and Cd(Ⅱ) (c)of Schiff base functionalized magnetic Fe3O4
2.3 离子浓度对吸附性能影响
从图8a可以看出,Fe3O4@SiO2-HE-2对Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)的吸附容量随着离子浓度增加而增加。在浓度较高的条件下,Fe3O4@SiO2-HE-2对3种金属离子的吸附量大小顺序为Pb(Ⅱ)>Cd(Ⅱ)>Cu(Ⅱ),浓度越大差开越明显,这是由于在高初始浓度条件下,金属离子与吸附剂相互作用的机会增加,因此吸附剂的吸附效果就越明显。

图8 离子浓度(a)和pH(b)对Fe3O4@SiO2-HE-2吸附量的影响Fig.8 Effects of ion concentration(a)and pH(b)on the adsorption capacity of Fe3O4@SiO2-HE-2
2.4 pH值对吸附性能的影响
由图8b可以看出,在pH=1~6的范围内,Fe3O4@SiO2-HE-2对Cu(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)的吸附能力随着溶液pH值的增大而增大,且对这3种离子的最大吸附量均在pH=6。相比较而言,Fe3O4@SiO2-HE-2对Cu(Ⅱ)的吸附受pH变化的影响较大,而对Pb(Ⅱ)和Cd(Ⅱ)的吸附在pH=4~5之间有一个明显的突跃,表明这类吸附材料只有在弱酸性的介质中才能较好地吸附Pb(Ⅱ)和Cd(Ⅱ)。在低pH条件下,—N=C和—OH官能团由于大量H+的存在而被质子化,带正电荷的官能团与金属离子之间的静电排斥使Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)无法与吸附剂接触配位,导致吸附量偏低。随着溶液pH值的升高,H+浓度下降,官能团的质子化程度降低,导致有效结合位点增加,吸附容量也相应增加[32-33]。而当pH>6时,Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)会被水解产生氢氧化物沉淀,不适合做吸附研究。因此,Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)的最佳吸附pH值均为6。
2.5 吸附机理
图9是吸附剂Fe3O4@SiO2-HE-2吸附前后的FTIR谱图。从图中可以看出,1 402 cm-1处的吸收峰属于—C=N—基团,3 430 cm-1处为羟基吸收峰,吸附后的Fe3O4@SiO2-HE-2在1 402和3 430 cm-1处吸收峰变弱,说明—C=N—基团和羟基与Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)发生了配位作用。该结果也表明这类材料对金属离子的吸附是通过吸附材料含有的官能基团与金属离子配位实现的。
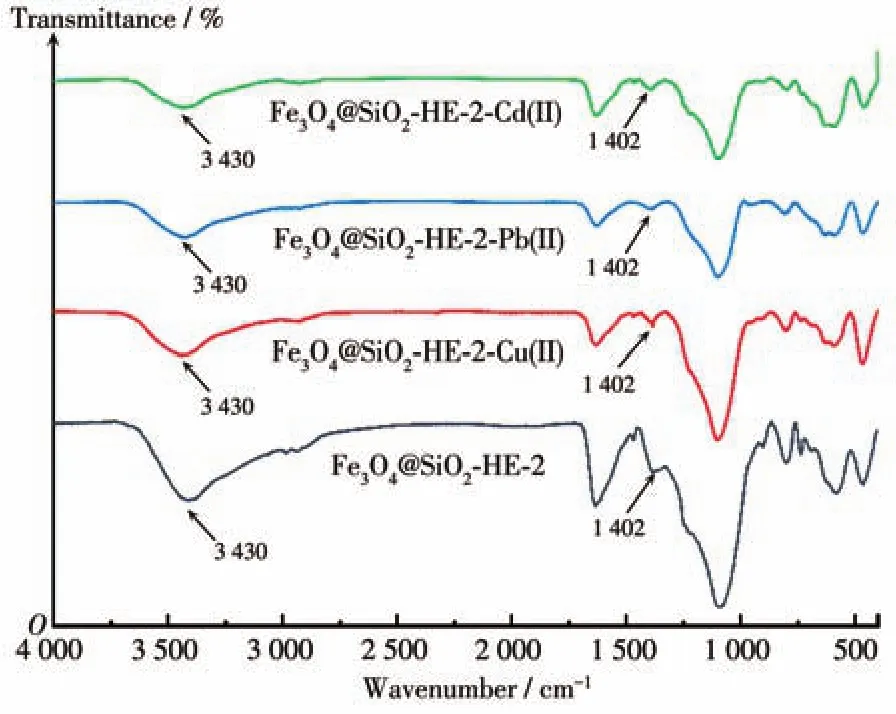
图9 Fe3O4@SiO2-HE-2在吸附前后的FTIR谱图Fig.9 FTIR spectra of Fe3O4@SiO2-HE-2 before and after adsorption
2.6 再生性能
采用吸附效果最佳的Fe3O4@SiO2-HE-2,以2 mmol·L-1Pb(Ⅱ)溶液为研究对象,用5%硫脲-0.5 mol·L-1硝酸溶液为洗脱剂对其吸附和再生性能进行研究。4次吸附-脱附后的吸附效果如图10所示,4个使用周期的再生率分别为95.4%、92.3%、90.1%和89.4%,表明该吸附剂具有良好的稳定性和再生性能,具有潜在的工业应用价值。
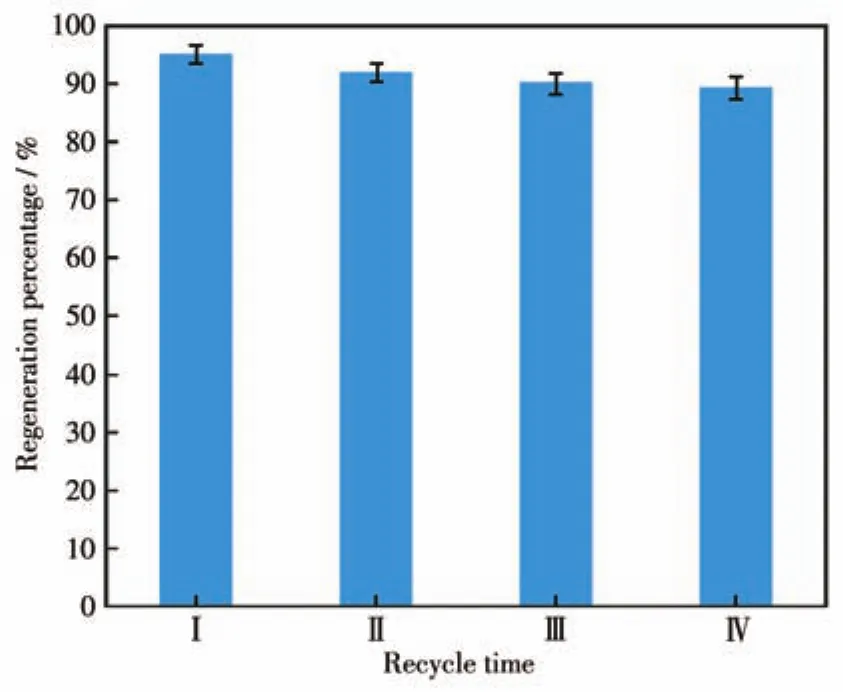
图10 Fe3O4@SiO2-HE-2的再生性能图Fig.10 Regeneration property of Fe3O4@SiO2-HE-2
3 结论
(1)采用开相法合成得到的磁性Fe3O4负载Schiff碱吸附材料对Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)的吸附效果优于均相法,并在pH=1~6范围内,随着pH值的增大,吸附效果越来越好。随着溶液中离子浓度的增大,吸附量随之增大。
(2)水杨醛衍生物上取代基的不同对材料的吸附效果影响较大,给电子基团取代的水杨醛合成的吸附材料的吸附效果要优于吸电子基团取代的。最佳吸附材料Fe3O4@SiO2-HE-2对3种离子的吸附效果为Pb(Ⅱ)>Cd(Ⅱ)>Cu(Ⅱ)。
(3)合成得到的吸附材料对3种金属离子都具有较好的吸附效果。通过实验筛选出最佳吸附材料Fe3O4@SiO2-HE-2,可重复使用4次,表现出优良的再生性能。
综上所述,采用开相法,利用给电子基团取代的水杨醛功能化Fe3O4,合成得到的磁性Fe3O4负载Schiff碱碱吸附材料对水体中重金属离子Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)具有良好的吸附效果,在去除废水中重金属离子的应用方面提供了参考和借鉴,对促进磁性材料在重金属离子吸附中的应用具有重要意义,将拓展铜、铅和镉离子吸附材料的研究领域。该研究可应用于污水处理中铜、铅和镉离子的分离富集、重金属资源再利用等领域,具有潜在的经济和社会效益价值。
- 无机化学学报的其它文章
- Synthesis and Characterization of Palladium Nanoparticles with High Proportion of Exposed(111)Facet for Hydrogenation Performance
- Dielectric Phase Transition Induced by Halogen Substitution Based on 1,4-Diazabicyclo[2.2.2]octane-Derivatives
- 不同晶体生长活化能对SrZrO3∶Ce发光性能及微观组织影响
- 炭球修饰g-C3N4材料的制备及其可见光光催化性能
- Er3+掺杂 Li2O-SrO-ZnO-Bi2O3玻璃中 Er3+离子在1.53 μm处的荧光发射特性
- 3-((5-(3-吡啶基)-2-(1,3,4-噁二唑基))硫代)-2,4-戊二酮Cu(Ⅱ)/Zn(Ⅱ)/Mn(Ⅱ)配合物的合成及其晶体结构

