精浆甘油三酯含量对猪精液保存效果的影响
甘麦邻,刘 麟,郑 婷,赵 雪,郭宗义,沈林園,潘红梅,张 亮,王金勇*,朱 砺*
(1.四川农业大学动物科技学院,四川成都 611130;2.四川农业大学畜禽遗传资源发掘与创新利用四川省重点实验室,四川成都 611130;3.重庆市畜牧科学院,重庆 402460)
养猪业是我国畜牧业的支柱产业,长期以来我国的生猪饲养量和猪肉消费量均是世界第一[1-2]。近年来,随着我国养猪业的快速发展和种猪联合育种工作的需要,猪的人工授精技术快速发展和迅速普及[3]。此外,“非洲猪瘟”疫情仍在持续,猪精液的冷冻保存作为一种重要遗传资源保存手段,可以对濒危地方猪资源和优秀公猪资源进行有效保存[4]。在猪精液保存过程中,精子活率容易受到各种因素的影响[5]。精液中的脂类物质主要来源于前列腺,正常情况下可作为精子能量的储存库[6]。甘油三酯(TG)是精液脂类中的重要成分之一[7],在人类[8]和动物生殖领域的研究发现TG 含量与精液量、精子活率和生殖道感染等指标密切相关[9]。
猪精液由于脂质含量和组分特征与其他哺乳动物相差较大,导致其对低温特别敏感,相关长期保存技术仍不成熟[10]。本实验旨在探究猪精液中TG 含量对猪精液常温和冷冻保存的影响,以期为相关研究提供参考。
1 材料与方法
1.1 实验材料 12 头3~5 岁大白公猪来自四川某公猪站,饲养管理一致,采精频率每周2次。常温稀释液(AndroPRO Plus),冷冻基础液(Androhep®CryoGuard Cooling &Freezing Extender)和解冻液(Androhep®CryoGuard Thaw Extender)(Minitube,德国)、新鲜鸡蛋、甘油(索莱宝科技有限公司,北京)、0.25 mL 细管(IMV,法国)。
1.2 实验方法
1.2.1 常温保存 选取同一采精人员同一天采精的9 头公猪,每个样本3 个重复。采精后取中段精液经纱布过滤后,在无菌、避光条件下使用专用精液稀释液1:2 稀释,置于17℃保温箱保存。分别于保存0、24、48、96、144 h 检测精子保存效果。
1.2.2 计算冻精总量 精子总数=精液密度×精液量。本研究拟设计冷冻精液密度为4 亿/mL,因此冻精总量=总精子数÷4 亿/mL,并以此计算后续冷冻稀释液各组分的用量。
1.2.3 冷冻保存 将17℃恒温保存过夜的稀释精液,在预冷好的17℃离心机中2 300 ×g 离心5 min,弃上清;沉淀按8 亿/mL 的浓度加入冷冻稀释液Ⅰ(冷冻基础液:新鲜蛋黄=4:1),吹匀后置于4℃平衡2.5 h;平衡结束后按1:1 比例加入冷冻稀释液II(冷冻稀释液I 加入终浓度6%的甘油,提前预冷到4℃),待加入II 液后45 min 左右开始液氮熏蒸;精液细管在距液氮液面高度5 cm 左右(温度-80~-120℃)熏蒸8 min 后投入液氮,冷冻精液细管分别装入标记好的拇指管和布袋中置于液氮罐保存备用;解冻时从液氮中取出细管,以42℃水浴16 s 的解冻方式进行解冻,然后以1:9 加入解冻液,37℃孵育10 min 检测活率。
1.3 检测指标及方法
1.3.1 生化指标检测 取中段精液稀释前的原精,在17℃环境3 000 ×g 离心5 min,取精浆,检测TG、过氧化氢(H2O2)、总抗氧化能力(T-Aoc)、果糖(Fructose)、锌(Zn)、总蛋白(TP)、总氨基酸(TAA)、白蛋白(ALB)含量和酸性磷酸酶(ACP)活性,检测试剂盒均使用索莱宝公司(北京)生产试剂盒,按照说明书进行操作。
1.3.2 精液质量检测 将猪专用精子计数板置于37℃载物台预热,再将精液样品缓慢注入计数待检计数室,使之均匀流入整个计数室,再在显微镜下观察并使用精子自动分析系统(AndroVision,Minitube,德国)分析精子活率、活力、快速前进运动精子数和慢速运动精子数。常温保存时间从稀释稳定后开始算起;冷冻保存时间从完成冷冻操作后投入液氮中开始算起。
1.4 统计分析 精子计数和分析系统使用AndroVision。所有结果均表示为“平均值± 标准差”。运用SPSS 22.0 软件对数据进行相关性分析和单因素方差分析,显著性检验采用T 检验方法。P<0.05 时记为显著,P<0.1时记为存在趋势。
2 结果
2.1 不同保存方法对猪精子活率、活力和运动指标的影响 如图1 所示,常温稀释的精液在17℃恒温保存,精子活率、活力、快速前进运动精子和慢速前进运动精子均随时间推移而下降,至144 h 时精子活率、活力和慢速前进运动精子比例均低于0 h(P<0.05),但144 h时仍有66.6%的活率和50.22%的活力,依旧维持在较高水平。而冷冻保存精子在42℃,16 s 条件下解冻后活率为45.46%,活力为34.99%,低于常温保存的各个时间段组(P<0.05)。
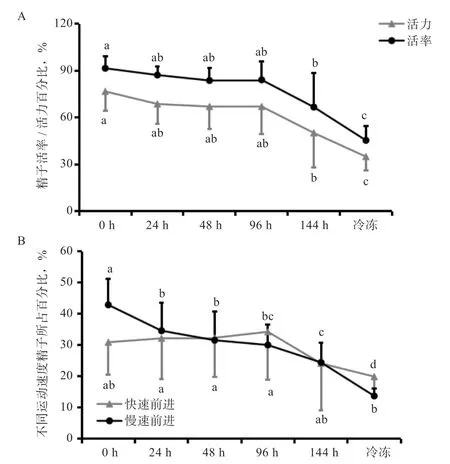
图1 猪精液不同保存方式精子指标变化
2.2 精浆TG 含量与猪精液保存指标的相关性分析 本研究中猪精浆TG 含量平均值为(0.66±0.30)mmol/L(最小值0.23 mmol/L,最大值1.00 mmol/L)。从表1可以看出,精浆中TG 含量与稀释保存0 h 和144 h 后的精子活率、活力、快速前进运动精子和慢速前进运动精子均不相关(P>0.05),但精浆中TG 含量与猪精液冷冻保存后的活率显著负相关(P<0.05),精浆TG 含量与冷冻保存后的精子活力、快速前进运动精子和慢速前进运动精子存在负相关的趋势(P<0.1)。
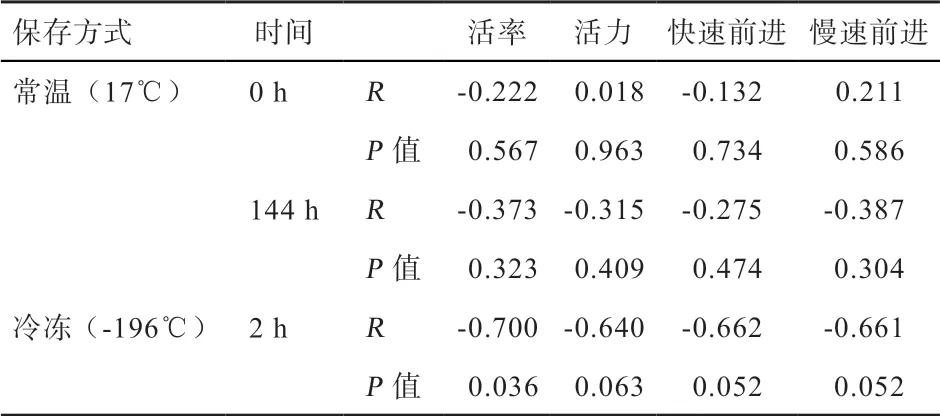
表1 精液TG 含量与猪精子指标的相关性分析 %
2.3 精浆中高、低TG 的生化指标分析 为进一步分析精浆TG 水平对猪精液保存效果的影响,选取相近日龄的大白公猪6 头,其中精浆高TG 和低TG 公猪各3 头(图2-A),两组的TG 含量相差3.18 倍,在同一天采集精液,检测发现高TG 组精浆中果糖、H2O2、TP 含量显著或极显著高于低TG 组,ALB 也存在相同趋势(P<0.1),其余生化指标无显著差异。
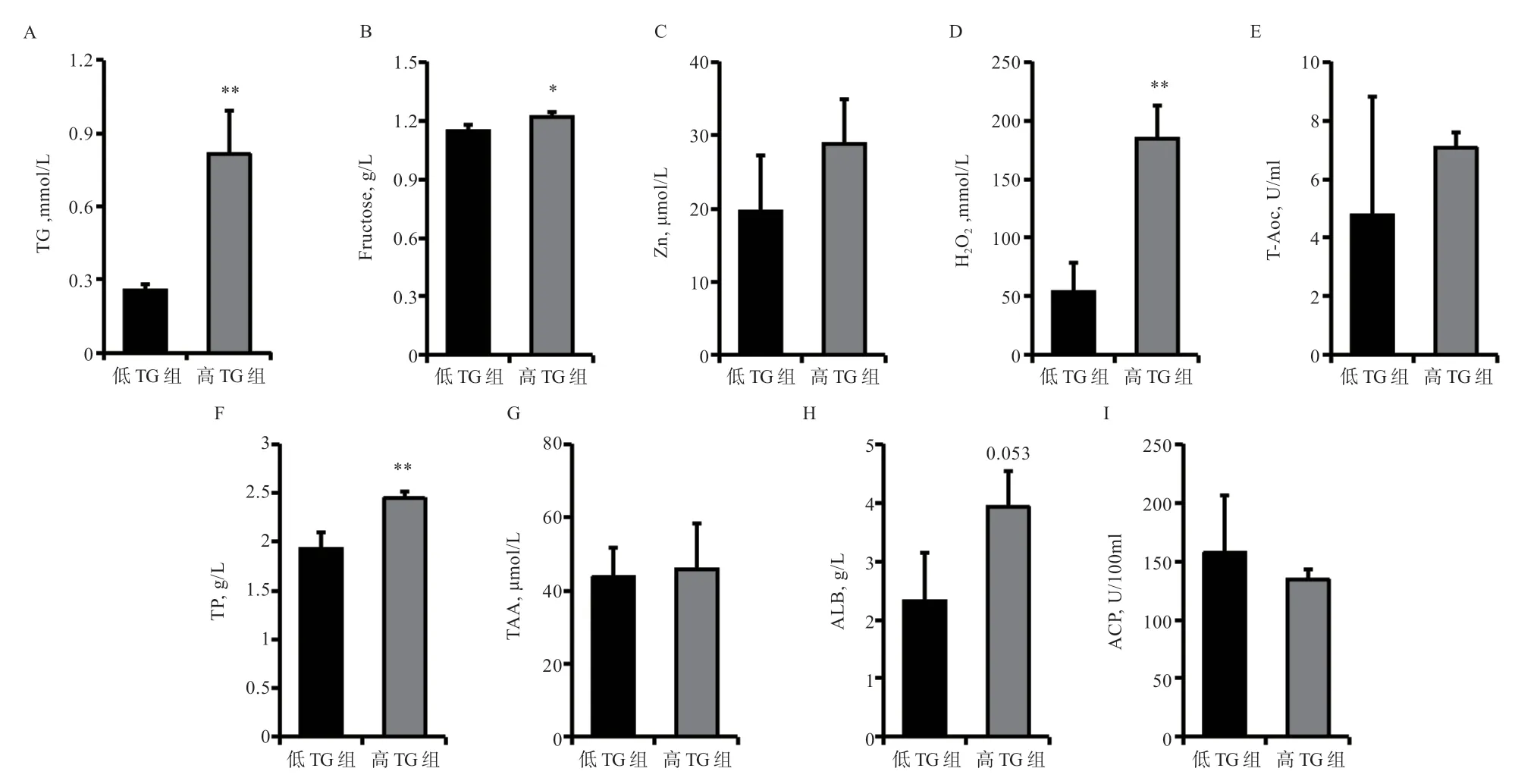
图2 猪精浆不同TG 含量对精浆生化指标的影响
2.4 精浆高TG 组和低TG 组不同保存方式下精子指标差异 如图3 所示,精液稀释并在17℃恒温箱中缓慢降温至17℃稳定后立即检测,发现精浆高TG 组的精子活力高于低TG 组(P<0.05),精子活率、快速前进运动精子和慢速前进运动精子均无显著差异。17℃保存144 h 后,高TG 组与低TG 组各项指标均无显著差异。液氮冷冻保存后,高TG 组精子活力和快速前进运动精子与低TG 组无显著差异,但高TG 组精子活率低于低TG 组(P<0.05),且慢速运动精子数与低TG 组相比有降低趋势(P<0.1)。
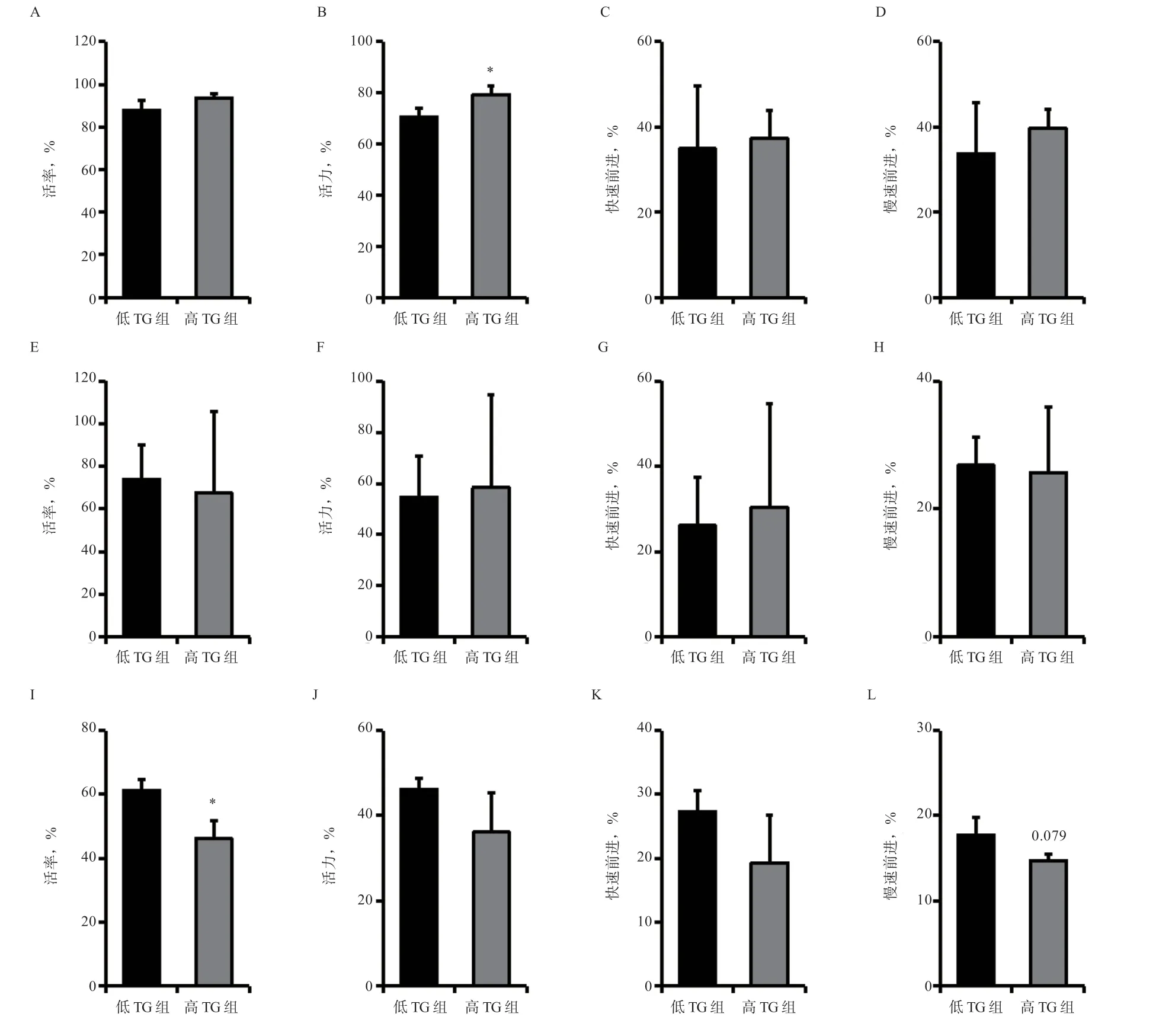
图3 猪精浆不同TG 含量对不同保存方式精子指标的影响
精浆高TG 组和低TG 组精液在常温保存0 h 和144 h 及冷冻-解冻后测得H2O2含量均无显著差异,但常温保存144 h 与0 h 相比,精浆高TG 组精液H2O2含量上升4.50 倍,而精浆低TG 组精液H2O2含量仅较0 h上升2.37 倍。
冷冻-解冻精液检测结果表明,高TG 组精子活率、活力下降均超过50%,高于低TG 组(P<0.01)。两组间快速前进运动精子和慢速前进运动精子下降比率未达显著水平。
3 讨 论
3.1 精浆TG 含量对猪精液常温保存的影响 猪精液常温保存技术目前应用较为普及[11],在养猪生产中被大面积推广使用,大多数常温保存技术可以有效保存3~5 d[12]。本研究也发现,常温保存3~5 d 对精子活率和活力无显著影响,在保存144 h(7 d)后精子活率和活力才显著下降。
动物精子与精囊腺、前列腺和附睾的分泌物共同构成精液。精浆中的脂类主要来源于前列腺,其功能是作为精子的能量物质。在人医临床检测中,TG 含量的高低常被用于辅助鉴别前列腺异常[13]。本研究发现,精浆中TG 含量与稀释保存0 h 和144 h 后的精子活率、活力、快速前进运动精子和慢速前进运动精子均不相关。精浆果糖是精囊腺功能的特征性标记物,也是精子能量代谢的重要来源,经糖酵解和线粒体呼吸作用产生的ATP 为精子供能[14]。精液中活性氧(ROS)作为生理过程中信号传导元素,在精子获能中起重要作用,适量的ROS 是调节正常精子功能(如精子获能、精卵融合等)所必需的,起到介导细胞内信号转导和蛋白质磷酸化等重要生理生化功能[15],但过量的ROS 会引起精子质膜、DNA 损伤,导致精液质量下降,H2O2是精液中ROS 的重要组成成分[16]。研究发现,精浆蛋白与男性生育力息息相关,它可以影响精子的成熟、获能、受精并反映前列腺、精囊腺的功能[17]。本研究发现,高TG 组精浆中果糖、H2O2、TP 含量显著高于低TG 组,且高TG 组原精中精子活力显著高于低TG 组,可能是高TG 组精液的果糖和蛋白等能量物质较丰富,而短时间内H2O2未对精子造成损伤。
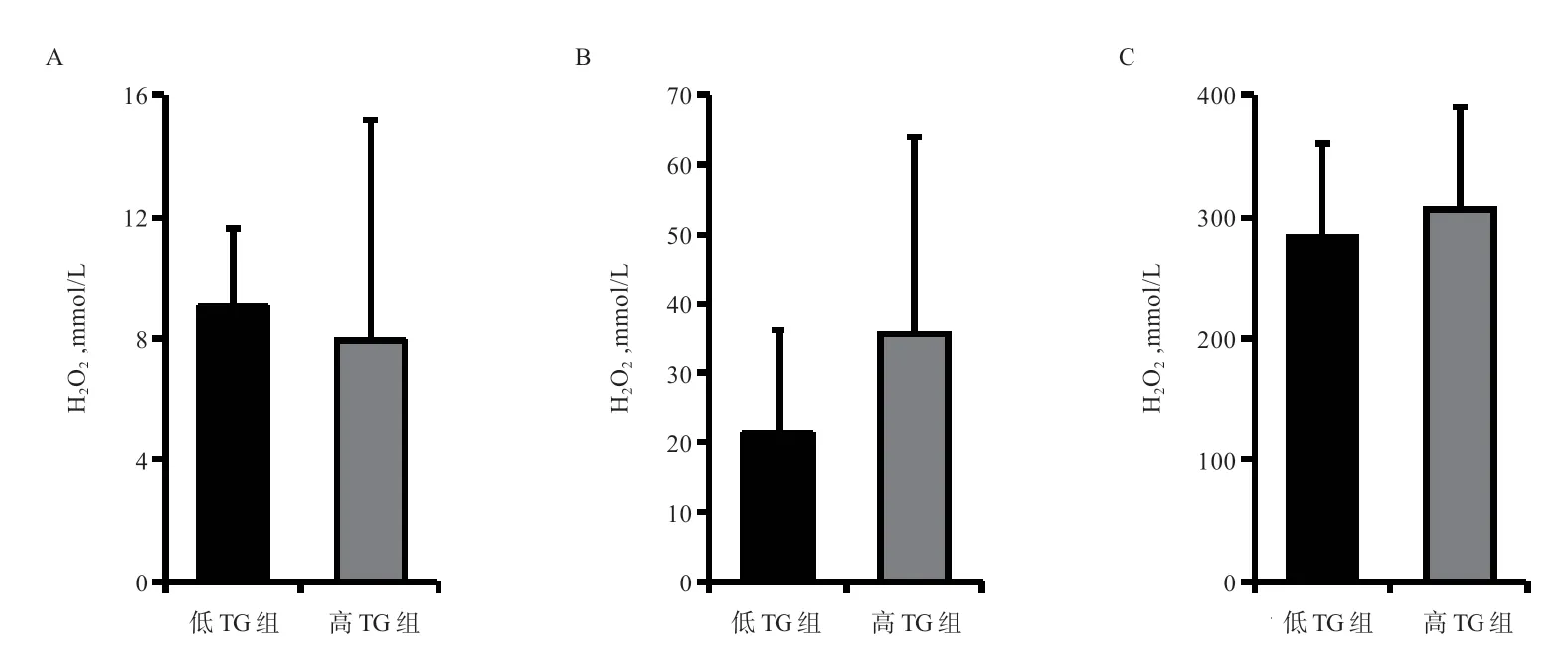
图4 猪精浆不同TG 含量对不同保存方式精液H2O2 含量的影响
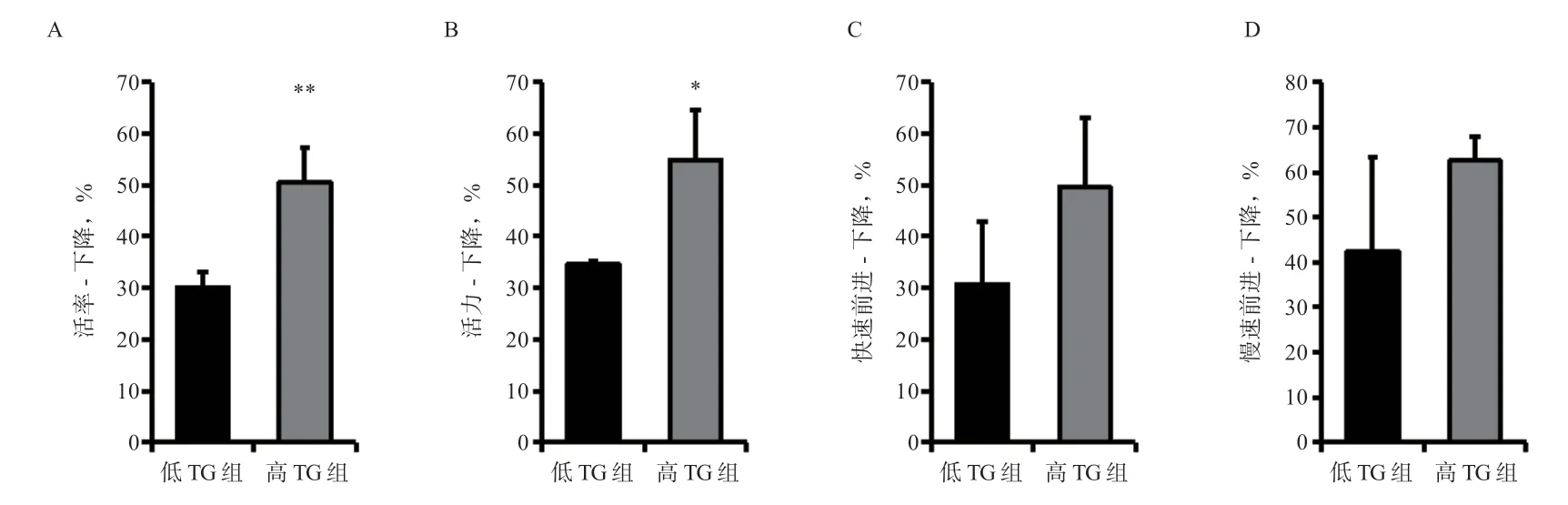
图5 猪精液冷冻保存后精子指标下降比率
在常温(17℃)保存猪精液时通常不会去除精浆[18],此外,常规离心并不能完全去除精浆,且副性腺分泌物在体内对精子已经产生了影响,猪精液保存过程中精浆分泌物对精子的作用还会产生持续影响。精浆中的脂类物质在保存过程中会发生氧化,而精浆中的过氧化氢也会进一步加剧氧化过程,产生大量ROS[19]。本研究也发现,在精浆中高TG 组精子活力显著高于低TG 组,且精子活率、快速前进运动精子和慢速前进运动精子均略高于低TG 组。但随着保存时间的延长,各项精子指标变化不大,仅精子活率和慢速前进运动精子数略低于低TG 组。此外,17℃保存144 h 后检测结果表明,高TG 组精液H2O2含量较保存0 h 上升4.50 倍,而低TG组精液H2O2含量仅上升2.37 倍。可以预见,随着常温保存时间的进一步延长,高TG 组精液质量下降的速度高于低TG 组。
3.2 精浆TG 含量对猪精液冷冻保存的影响 由于猪精液中精子密度较低,且猪精子质膜结构和组分特征与其他哺乳动物存在较大差异[20]。长期以来,猪精液的冷冻保存和推广使用一直未取得突破性进展。精液中的副性腺分泌物通常能为精子提供能量和保护,但这些精浆组分是否会对精液冷冻后的精子质量造成影响还知之甚少。
猪精液冷冻保存和复苏,经历了从液态—固态—液态的变化,因此初始的精子损害会被进一步放大[21]。本研究发现,精浆TG 含量与精液冷冻复苏后的精子活率呈显著负相关。尽管新鲜精液中高TG 组具有更高的活力,但冻存后其活力显著下降,慢速前进运动精子数也有下降趋势,且高TG 组精液冻存后的精子活率和活力下降比例也显著高于低TG 组。由于猪精液冷冻保存会以离心方式去除精浆,一方面在离心之前精浆脂质已经对精子造成损害,另一方面精子表面可能附着了脂质成分,对保存过程的精子造成了持续伤害。
精浆成分主要是副性腺的分泌物,而这些分泌过程受生理、营养和管理等因素的影响,因此可通过相应的营养和管理手段达到适当调节的目的[22]。由于常温保存和冷冻保存均与猪直接交配的生理过程和环境不同,因此推测常温短期保存可不必考虑精浆TG 水平,而常温长期保存和冷冻保存应在优先考虑新鲜精液质量的基础上,通过检测精浆TG 含量,选择低TG 水平的精液用于保存。目前,关于影响猪精浆TG 含量的环境和遗传因素的研究报道均比较缺乏,还有待于进一步探究。在后续研究中可通过干预影响猪精浆TG 含量的因素,进一步调控猪精浆TG 水平,以利于猪精液的长期保存。
4 结 论
本研究结果表明,精浆TG 水平对猪精液冷冻保存存在不利影响,而对常温保存精液影响较小。在猪精液的常温保存过程中可以不必考虑精浆TG 水平,而冷冻保存时选择精子活力和活率高且TG 含量较低的精液可以取得更好的保存效果。猪精浆TG 水平可以作为一个预估猪精液冷冻价值的潜在指标,但其作用机制和内在规律还有待于在大样本和分子及超微结构层次做更深入研究。

