不同增氧方式对鲟鱼养殖水体微生物菌落结构的影响
朱开兴 黄丽娥 饶秋华 宋永康 黄薇
摘 要:比较研究鲟鱼养殖过程中应用微纳米曝气增氧机和水车式增氧机两种增氧方式的效果,采用高通量测序技术分析不同增氧方式对养殖水体中的优势菌群结构和潜在病原微生物之间的影响,以及溶解氧浓度与潜在病原微生物相对丰度的相关性。结果表明:微纳米曝气增氧机和水车式增氧机增氧方式的鲟鱼养殖水体中的优势菌群结构基本一致,且两种增氧方式下的鲟鱼养殖水体中均检测出9种潜在病原微生物(属水平)。其中潜在病原微生物Acinetobacter、Aeromonas、Clostridium、Flavobacterium、Mycobacterium、Pseudomonas在微纳米曝气增氧机中的相对丰度要低于水车式增氧机的养殖水体,但差异不显著(P≥0.05)。相关性分析结果显示,潜在病原微生物Parachlamydia、Rickettsia与养殖水体中的溶解氧浓度呈显著正相关(P<0.05)。
关键词:微纳米曝气增氧机;水车式增氧机;鲟鱼养殖;微生物群落结构
中图分类号:S 965 文献标志码:A 文章编号:0253-2301(2021)03-0011-05
DOI: 10.13651/j.cnki.fjnykj.2021.03.003
Abstract: The effects of two oxygenation methods including micronano aerated aerator and waterwheel aerator in the process of sturgeon culture were compared and studied in this paper, and the highthroughput sequencing technology was used to analyze the effects of different oxygenation methods on the structure of dominant bacteria and potential pathogenic microorganisms in the aquaculture water, and the correlation between the concentration of dissolved oxygen and the relative abundance of potential pathogenic microorganisms was also analyzed. The results showed that the structure of dominant bacteria in the sturgeon aquaculture water under the micronano aerated aerator and the waterwheel aerator was basically the same, and nine kinds of potential pathogenic microorganisms (genus level) were detected in the sturgeon aquaculture water under the two kinds of aeration. Among them, the relative abundance of potential pathogenic microorganisms Acinetobacter, Aeromonas, Clostridium, Flavobacterium, Mycobacterium and Pseudomonas in the micronano aerated aerator was lower than that in the aquaculture water with waterwheel aerator. But the difference was not significant (P≥0.05). The results of correlation analysis showed that the potential pathogenic microorganisms Parachlamydia and Rickettsia were significantly positively correlated with the dissolved oxygen concentration in the aquaculture water (P<0.05).
Key words: Micronano aerated aerator; Waterwheel aerator; Sturgeon culture; Microbial community structure
養殖水体是水生动物赖以生存的环境,对鱼类的健康生长起着至关重要的作用[1-2]。养殖水域环境中生存着大量的细菌菌群,对于养殖疾病的控制与发生、水域环境的物质代谢、水质调控及生态系统稳定等起着重要的影响作用[3]。崔丙健等[4]认为,存活于养殖环境中的病原菌尽管只占微生物群落的很少一部分,但在一定条件的刺激下会大量增殖,最终可能导致水产疾病的暴发流行。同时有研究显示,鱼病的发生几率及发病类型与养殖环境中的细菌数量呈显著的正相关[5]。随着研究的深入,人们已经认识到理解养殖水体中的菌群结构组成对于水生动物的健康培育具有重要的指导意义。
鲟鱼是地球上现存最古老的脊椎动物,主要分布在北半球的北美洲大陆和欧亚大陆,其中我国是鲟鳇鱼分布较多的国家[6]。据统计,我国年产鲟鱼约10万t,养殖产量占世界鲟鱼养殖总产量的80%以上[7-8]。在鲟鱼养殖过程中,鲟鱼对于水中的溶氧量要求与其他鱼类相比较高,要求养殖水体中的溶氧量控制在5 mg·L-1以上。因此,在鲟鱼人工养殖下,为了维持水中的溶解氧浓度,必须通过使用增氧设备装置来提高溶解氧含量。近年来,主要的水产养殖模式中在传统的叶轮式、水车式增氧机的基础上,出现了新型的微纳米曝气增氧技术,能够显著提高鲟鱼养殖水体中溶解氧含量[9-10]。目前,关于不同增氧方式对鲟鱼养殖水体微生物群落结构影响的研究未见报道。为了深入研究鲟鱼养殖水体的微生物群落结构,本研究采用高通量测序技术等手段对微纳米曝气和水车式两种增氧机的增氧效果以及其对鲟鱼养殖水体细菌群落结构的影响进行分析,从而为鲟鱼人工养殖技术开发提供理论支撑。
1 材料与方法
1.1 试验材料
试验在福建省周宁县福建龙鳇鲟业有限公司鲟鱼养殖车间进行,车间厂房为钢架结构,屋面与外墙采用隔热保温材料修建,鱼池为砖砌水泥池,单池面积144 m2,养殖水体144 m3。试验分为2组,A组为微纳米曝气增氧机,B组水车式增氧机,每组设3个重复。试验时选取放养密度一致、养殖条件一致、养殖品种相同的鲟鱼。
1.2 水样采集
样品于2020年6月12日采集,利用500 mL含0.4 mg硫代硫酸钠的无菌水样采集袋采集水样,将采集的水样送实验室4℃保存,24 h内完成DNA提取。样品命名:微纳米曝气增氧机养殖水体样品编号为A1、A2和A3,水车式增氧机养殖水体样品编号为B1、B2和B3。
1.3 溶解氧测定
溶解氧(DO)采用美国哈希便携式溶氧仪HQ30D测定。
1.4 基因组DNA提取
取养殖水体样品各500 mL,利用0.45 μm滤膜富集水体中的微生物。富集好的微生物样品采用水样DNA提取试剂盒(MOBIO,美国)提取总基因组DNA,得到的DNA样品用Qubit 2.0分光光度计(Invitrogen,美国)测定其浓度,之后将浓度≥50 ng·μL-1的样品送生工生物工程(上海)股份有限公司进行16S rRNA基因的PCR扩增和Illumina测序。PCR扩增采用16S rRNA基因V3~V4区的通用引物341F和805R。
1.5 高通量数据处理
Illumina测序平台得到的PE reads,首先采用overlop进行拼接[11-12],区分样品后对序列质量进行质控和过滤[13],然后进行OTU聚类分析和物种分类学分析[14-15];进一步对OTU进行多种多样性指数分析,对测序深度进行检测[16-17]。
2 结果与分析
2.1 增氧机增氧效果对比
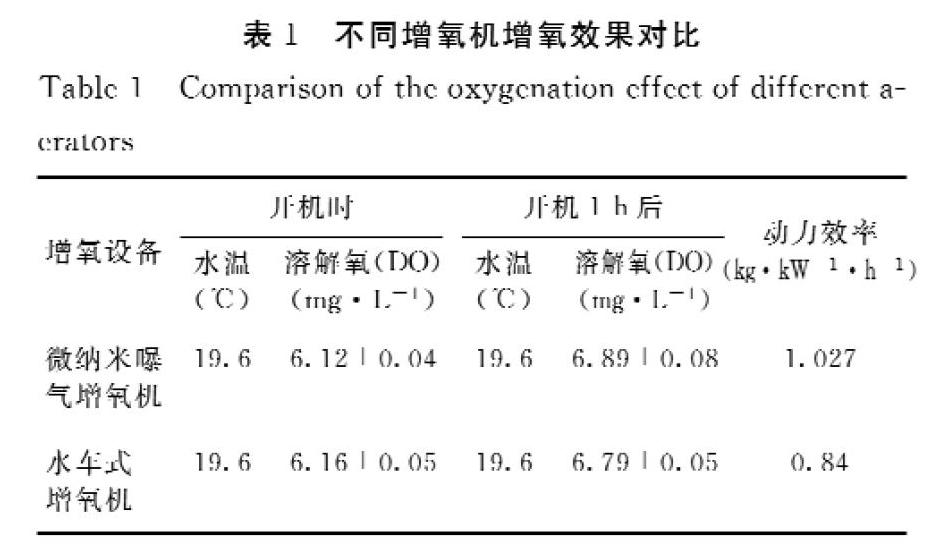
表1为微纳米曝气增氧机和水车式增氧机的增氧效果比较。其中,动力效率是指增氧机每瓶输入功率每小时使氧气在水中溶解的千克数,单位为kg·kW-1·h-1。在增氧能力上,微纳米曝气增氧比水车式增氧机增氧提高了22.22%;在增氧动力效率上,前者是后者的1.22倍。
表1 不同增氧机增氧效果对比
2.2 高通量测序数据分析
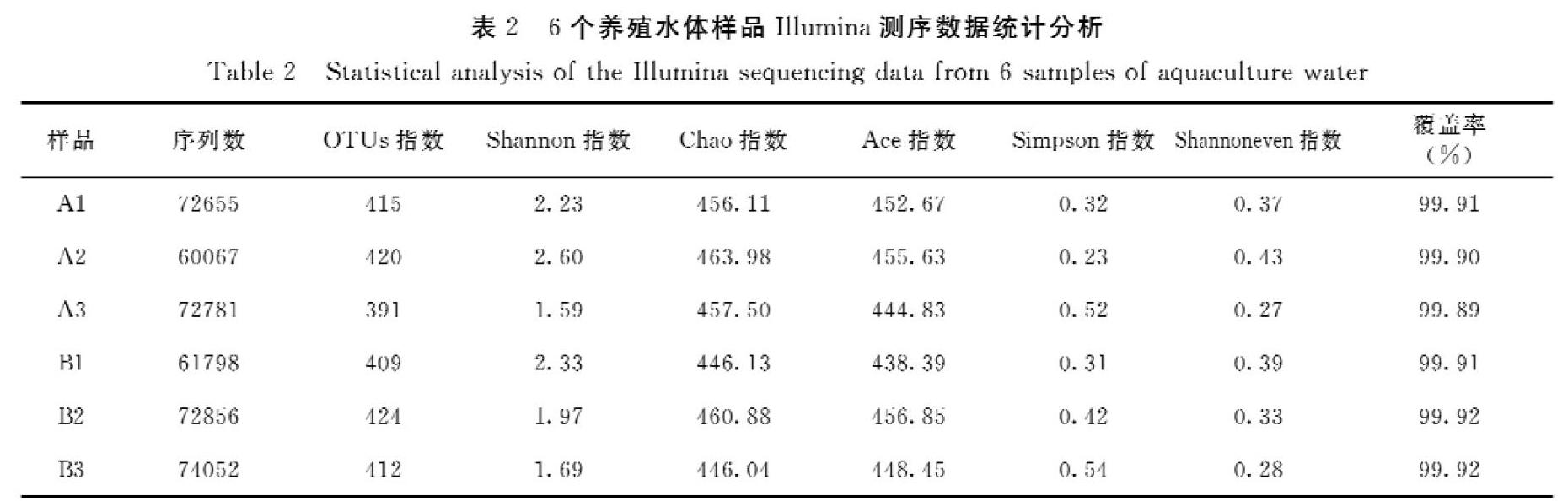
表2为6个养殖水体样品Illumina测序数据统计分析结果。从表2可知,每个样品的OUT覆盖率(Good′s coverage)均大于99%,表明本研究获取的数据量能够很好地反映特定样品的细菌多样性情况;6个样品获得的有效16S rRNA基因序列数为60067~74052条,共计414209条;基于97%的序列相似性,平均每个样品获得OTUs为412个。Alpha多样性分析结果表明,微纳米曝气增氧机和水车式增氧机的Alpha多样性指数(ACE指数、Chaol指数、Shannon指数、Simpson指数和Shannoneven指数)的差异并不明显,表明各样品间的物种丰度和多样性基本一致。
2.3 鲟鱼养殖水体细菌群落结构特征分析
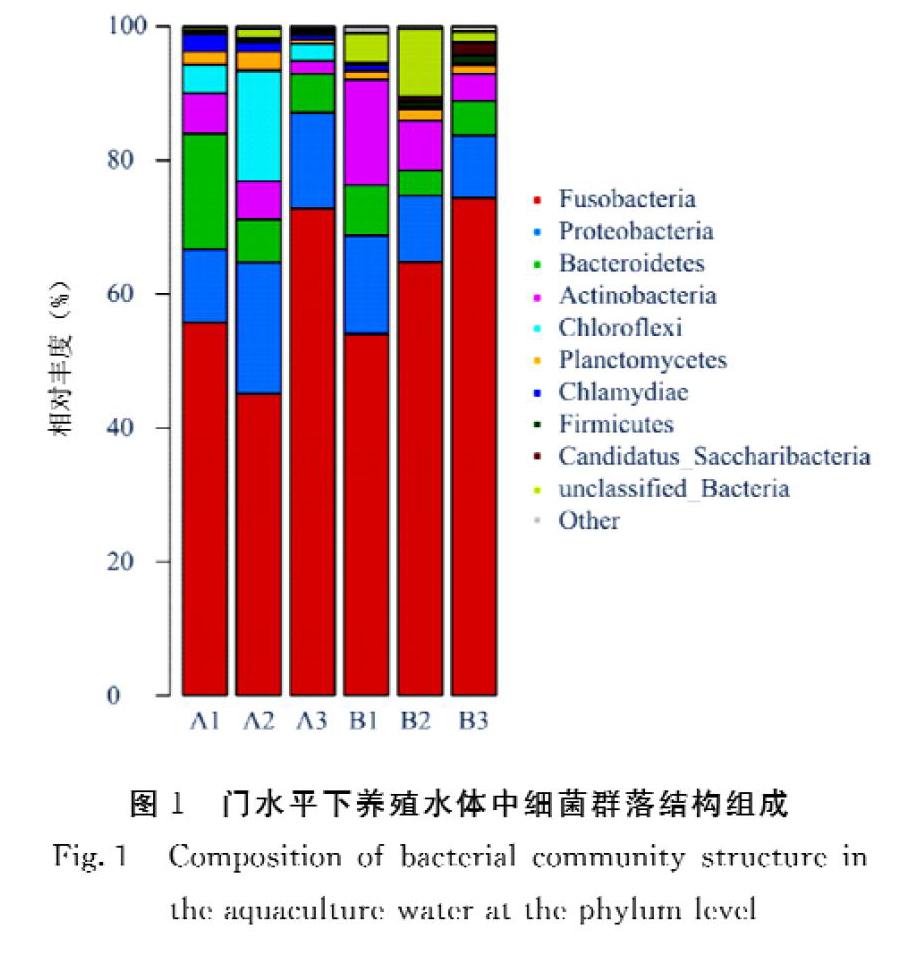
2.3.1 优势菌群相对丰度 本研究共得到18个门水平的细菌(图1)。从图1可见,6个鲟鱼养殖水体样品中的优势菌群类别基本相同,主要由Actinobacteria、Bacteroidetes、Fusobacteria和Proteobacteria组成,这4个门分别占到所有样品序列总数的76.92%~94.87%。但差异显著性分析结果显示,这些门类的细菌在两种增氧方式下养殖水体中的差异并不显著(P≥0.05)。
在两组鲟鱼养殖水体样品中,共检测到227个属的细菌,其中未分类的细菌菌属达到65个。从分析结果(图2)可以看出,养殖水体中丰度在2%以上的细菌属主要有Cetobacterium(60.11±11.31)%、Mycobacterium(4.48±5.19)%、Litorilinea(3.88±6.39)%、Bacteroides(3.35±5.07)%、unclassified_Bacteria(3.04±3.74)%和Legionella(2.95±4.55)%。同時统计结果显示,这些优势菌属在两组养殖水体中无显著差异(P≥0.05),说明在属水平上,两组养殖水体中的细菌种类和组成相似。
2.3.2 养殖水体细菌群落组成比较分析 通过构建韦恩图来分析鲟鱼养殖水体样品中所共有的和特有的OTU数目(图3)。图3显示,各养殖水体样品中共有251个OTUs,A1、A2、A3、B1、B2、B3养殖水体中各含有特有的OTUs分别为6、1、1、5、1和1个,说明两组养殖水体中的细菌种类是基本一致的。
2.3.3 潜在病原微生物群落及其与环境因子的关系 表3显示的是两组鲟鱼养殖水体中潜在病原微生物在属水平上的分布情况。水产动物中常见的病原微生物主要包括Acinetobacter、Aeromonas、Chryseobacterium、Clostridium、Edwardsiella、Flavobacterium、Heliobacillus、Lachnospira、Leucothrix、Mycobacterium、Parachlamydia、Pseudomonas、Plesiomonas、Providencia、Thiothrix、Rickettsia和Vibrio等。从表4可以看出,在两种增氧方式下的鲟鱼养殖水体中均检测出9种潜在病原微生物(属水平),共检测出10种潜在病原微生物。其中,潜在病原微生物Acinetobacter、Aeromonas、Clostridium、Flavobacterium、Mycobacterium、Pseudomonas在微纳米曝气增氧机中的相对丰度要低于水车式增氧机的养殖水体,但差异不显著。相关性分析显示,潜在病原微生物Parachlamydia和Rickettsia与养殖水体中的溶解氧浓度呈显著正相关(P<0.05)。
3 结论
在微纳米曝气增氧机和水车式增氧机两种不同增氧方式下开展鲟鱼养殖试验,采用高通量测序技术对鲟鱼养殖水体的微生物群落结构进行研究,分析增氧方式对养殖水体中的优势菌群结构和潜在病原微生物之间的影响以及溶解氧浓度与潜在病原微生物相对丰度的相关性。
(1)两种增氧方式下鲟鱼养殖水体中的优势菌群结构基本一致,优势菌门由Actinobacteria、Bacteroidetes、Fusobacteria和Proteobacteria组成,优势菌属由Cetobacterium、Mycobacterium、Litorilinea、Bacteroides、unclassified_Bacteria和Legionella组成。
(2)在两种增氧方式下的鲟鱼养殖水体中共检测出10种潜在病原微生物(属水平)。其中,潜在病原微生物Acinetobacter、Aeromonas、Clostridium、Flavobacterium、Mycobacterium、Pseudomonas在微纳米曝气增氧机中的相对丰度要低于水车式增氧机的养殖水体,但差异不显著。
(3)相关性分析显示,潜在病原微生物Parachlamydia和Rickettsia与养殖水体中的溶解氧浓度呈显著正相关(P<0.05)。
参考文献:
[1]RUNGRASSAMEE W,KLANCHUI A,MAIBUNKAEW S,et al.Bacterial dynamics in intestines of the black tiger shrimp and the Pacific white shrimp during Vibrio harveyi exposure[J].J Invertebr Pathol,2016,133:12-19.
[2]MOHAMMED K A,MUHAMMED A,NALAN S.Investigation for zoonotic disease pathogens(Aeromonas hydrophila,Pseudomonas fluorescens,Streptococcus iniae)seen in carp farms in Duhok region of Northern Iraq by molecular methods[J].AIP conference proceedings,2017(1833):020078.
[3]BLANCHETON J P,ATTRAMADAL K J K,MICHAUD L,et al.Insight into bacterial population in aquaculture systems and its implication[J].Aquacultural Engineering,2013(53):30-39.
[4]崔丙健,高天明,陈琳.异育银鲫养殖环境典型病原微生物检测和细菌群落解析[J].微生物学通报,2019,46(12):3363-3377.
[5]倪海儿,王国良.网箱养殖大黄鱼(Pseudosciaena crocea)疾病与环境因子的关系[J].海洋与湖沼,2009,40(1):72-77.
[6]周晓华.中国鲟鱼保护与产业发展管理[J].中国水产,2019(9):34-39.
[7]周晓华.鱘鱼子酱产业现状分析[J].水产学杂志,2015,28(4):48-52.
[8]唐淑玮,高瑞昌,赵元晖,等.鲟鱼鱼糜漂洗工艺优化及其对品质的影响[J].渔业科学进展,2019,40(1):155-160.
[9]任华,蓝泽桥,兰大华,等.气泵增氧在循环水工厂化养殖中的应用[J].江西水产科技,2014(1):31-33.
[10]黄盛杰,郑巍,陈智.水产养殖增氧设备特性分析和试验研究[J].农业装备技术,2020,46(3):11-14.
[11]MAGO T,SALZBERG S L.FLASH:fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[12]MARTIN M.Cutadapt removes adapter sequences from highthroughput sequencing reads[J].EMBnet Journal,2011,17(1):10-12.
[13]SCHMIEDER R,EDWARDS R.Quality control and preprocessing of metagenomic datasets[J].Bioinformatics,2011,27(6):863-864.
[14]EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461.
[15]YE L,SHAO M F,ZHANG T,et al.Analysis of the bacterial community in a laboratoryscale nitrification reactor and a wastewater treatment plant by 454pyrosequencing[J].Water Research,2011,45(15):4390-4398.
[16]SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mothur:opensource,platformindependent,communitysupported software for describing and comparing microbial communities[J].Applied & Environmental Microbiology,2009,75(23):7537-7541.
[17]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of highthroughput community sequencing data[J].NatMethods,2010,7(5):335-336.
(责任编辑:柯文辉)

