绿原酸通过下调Notch1的表达抑制食管癌细胞的克隆形成和侵袭转移
詹芸,李瑞,蒋建东,韩燕星
·论著·
绿原酸通过下调Notch1的表达抑制食管癌细胞的克隆形成和侵袭转移
詹芸,李瑞,蒋建东,韩燕星
100050 北京,中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室
考察 Notch1 在绿原酸(CGA)抑制食管癌过程中的作用及机制。采用表达谱芯片检测食管癌小鼠食管组织中的差异基因表达,并用免疫组化(IHC)染色方法进行验证;用 CGA 对不同的食管癌细胞系进行处理,通过 Western blot 检测不同细胞中 Notch1 的表达变化情况。采用 RNAi 技术敲降食管癌细胞中 Notch1 的表达,再加入 CGA 处理,利用克隆形成实验和 Transwell 实验检测食管癌细胞的克隆形成能力和侵袭转移能力的变化情况。通过表达谱芯片结果发现 Notch1 在接受 CGA 治疗的食管癌小鼠食管组织内的表达下降,并且 IHC 染色结果证实这一变化。Western blot 结果显示,CGA 能够抑制不同食管癌细胞中 Notch1 的表达,并且这种抑制作用会随着 CGA 处理浓度的增加而逐渐增强。采用 RNAi 技术敲降食管癌细胞中的 Notch1 后加入 CGA 进行克隆形成实验和 Transwell 实验,结果均表明,在正常表达 Notch1 的食管癌细胞中,经过 CGA 处理的细胞所形成的克隆团数目与发生侵袭转移的细胞数目远远低于对照组,而敲降 Notch1 之后,两组细胞所形成的克隆团数和发生侵袭转移的细胞数量未有明显的差异。Notch1 是 CGA 的作用靶点之一,CGA 通过作用于 Notch1 进而抑制食管癌细胞的克隆形成和侵袭转移。
绿原酸; Notch1; 食管癌; 克隆形成; 侵袭
食管癌是常见的消化道肿瘤之一,其发病率与死亡率分别居于全部恶性肿瘤发病率与死亡率的第九位和第六位[1]。我国是食管癌的高发地区,其死亡率仅次于肺癌、胃癌及肝癌[2]。Notch1 是一种高度保守的细胞跨膜蛋白,参与调节多种重要的生物学进程,例如细胞增殖、凋亡、分化等[3]。研究表明 Notch1 的异常广泛存在于多种肿瘤中[4]。在食管癌中,Notch1 常常出现表达或者功能异常,是食管癌发生发展过程中的关键因子之一[5]。
绿原酸(chlorogenic acid,CGA)是一种水溶性酚类化合物,在多种植物中存在,具有广泛的生物学活性,包括抗肿瘤活性,在临床肿瘤治疗中展现出了良好的治疗效果。本课题组前期工作已经证实 CGA 能够有效抑制食管癌细胞的增殖及侵袭转移[6],但其作用机制尚不明确。本实验首先通过动物模型证实了 CGA 对 Notch1 的调节作用,再用体外细胞模型进一步探讨 Notch1 在 CGA 抑制食管癌细胞过程中的具体作用与机制。
1 材料与方法
1.1 材料
RPMI-1640 培养基、0.25% 胰酶、青链霉素和胎牛血清购自美国 Gibco 公司;RNA 干扰所用 siRNAs(siNotch1-1、siNotch1-2)和阴性对照(NC)由美国 Ambion(Thermo)公司设计合成;转染试剂 Hiperfect 购自美国 Qiagen 公司;RNA 提取试剂盒TrizolTMplus RNA Purification Kit 购自美国 Invitrogen 公司;cDNA 第一链合成试剂盒 High-Capacity cDNA Reverse Transcription Kit(4368813)、SYBR Green实时定量 PCR 试剂盒 PowerUp SYBR Green Master Mix(A25742)均购自美国Applied Biosystems 公司;Matrigel Matrix 购自美国 BD 公司;抗体 Notch1(CST-3608)、β-actin(CST-4970)均购自美国 Cell Signaling Technology 公司。
1.2 方法
1.2.1 细胞培养 KYSE30、KYSE140、KYSE180 及 KYSE510 细胞均来自于东京大学Y.Shimada 博士的馈赠。采用含 10% 胎牛血清及 1% 青链霉素的 RPMI-1640 培养基进行培养。
1.2.2 siRNA 的转染 将细胞接种至 6 孔板中,并调整细胞密度至 50% 左右,培养12 ~ 16 h,将 Hiperfect 与适量 siRNA 混合加入 Opti-MEM 中,涡旋混匀并简短离心,室温下静置 10 min,再将其加入 6 孔板中,待转染 24 h 后,再进行不同的处理。
1.2.3 克隆形成实验 将 siRNA 转染 24 h 后的细胞用胰酶消化后计数接种于 6 孔板中,每个孔接种 300 个细胞,加入含有 CGA(50 μmol/L)的培养基培养 2 周,冰甲醇固定并用 0.5% 结晶紫染色,拍照,光镜下观察并记录细胞个数在50 个以上的克隆。
1.2.4 侵袭转移实验 细胞先经 siRNA 转染24 h 后,加入 CGA(50 μmol/L)预处理 24 h,然后将细胞消化计数,用无血清培养基重悬使细胞浓度为 1 ×107个/ml,取 100 μl 细胞悬液小心加入预铺 Matrigel 胶的Transwell 上室中,并在下室中加入含 10% 胎牛血清的培养基,37 ℃恒温培养箱中静置培养 24 h,拭去上室内的细胞,甲醇固定并用 0.5% 结晶紫染色,于显微镜下观察、拍照。
1.2.5 RNA 提取及 qRT-PCR 检测 收取 siRNA转染后的细胞,预冷 1 × PBS 清洗,用细胞刮刀将细胞小心刮下,收集至离心管中,离心弃去上清,加入适量Trizol,用 RNA 提取试剂盒提取总 RNA。取 1 μg 总 RNA 进行逆转录合成 cDNA,按照试剂盒说明书进行 real-time PCR 检测 Notch1 的表达,以管家基因 GAPDH 的表达作为内参,并用 2-ΔΔCt方法进行定量分析。GAPDH 及 Notch1 的引物序列如下:GAPDH 正向 5' CTCCC ACTCTTCCACCTTCG 3',反向 5' TAGGGCCTCT CTTGCTCAGT 3';Notch 1 正向5' GGTGAGACCT GCCTGAATG 3',反向 5' GTTGGGGTCCTGGCA TC 3'。
1.2.6 Western blot 提取细胞内总蛋白,用 BCA 法测定蛋白浓度,取 30 μg 总蛋白进行 SDS-PAGE凝胶电泳,转膜,5% 脱脂牛奶封闭非特异性抗原,分别加入一抗(均为 1:1000 稀释)于 4 ℃孵育过夜,TBST 洗膜后加入辣根过氧化物酶标记的二抗(1:5000)室温孵育 2 h,TBST 洗膜后用电化学发光法(electro-chemi-luminescence,ECL)显色成像,得到蛋白免疫印记条带,以 β-actin 蛋白条带作为参照。
1.2.7 动物实验取材及免疫组化 本实验用动物购自北京维通利华有限公司。动物实验遵循北京实验动物管理委员会的规定。给予 6 周龄雄性 C57 小鼠100 μg/ml 的4-硝基喹啉-N-氧化物(4-nitroquinoline-N-oxide,4-NQO)水溶液,持续喂水 16 周,从第 22 周开始给予 CGA 50 mg/(kg·d) 或者同等体积生理盐水(NS)腹腔注射,详细的动物实验模型建立方法参考本课题组之前的文章[6]。给药 6 周后处死小鼠取出食管组织,取部分组织用液氮冻存后送北京博奥晶典生物技术有限公司进行表达谱芯片检测,余下食管组织经 4% 多聚甲醛固定后,送武汉谷歌生物科技有限公司按照病理实验检测 SOP 程序对组织样品进行 Notch1(1:100)免疫组化(IHC)染色,并将染色结果用全景切片扫描仪扫描保存,用 Aperio ImageScope 软件对结果进行定量分析。
1.3 统计学处理
2 结果
2.1 CGA 下调经 4-NQO 诱导的小鼠食管癌组织中 Notch1 的表达
本课题组在前期研究中已经证实经 4-NQO 诱导的自发性食管癌小鼠在接受50 mg/(kg∙d) CGA治疗后,其食管癌发生速度减缓,生存期比对照组小鼠有明显的延长[6]。对该模型中的小鼠食管组织进行表达谱基因检测寻找其中的差异基因,发现 CGA 治疗组小鼠食管组织中 Notch1 的表达低于对照组(图1A),提示 Notch1 可能是 CGA 的调控靶点之一。对同一模型其余小鼠的食管组织进行 IHC 检测 Notch1,发现与对照组相比,CGA 治疗组小鼠食管组织中 Notch1 的表达明显下降(图1B)。采用分析软件对 IHC 的染色结果进行量化分析,同样证实 Notch1 的表达在两组小鼠的食管组织中存在显著差异(图1C)。这些结果表明 CGA 能够降低 4-NQO 诱导的自发性食管癌小鼠食管组织中 Notch1 的表达。
2.2 CGA 抑制体外培养的食管癌细胞中 Notch1 的表达
在 KYSE30、KYSE140、KYSE180 及 KYSE510细胞中加入不同浓度的 CGA(0、25、50、100、200 μmol/L)处理 48 h,收取细胞蛋白进行 Western blot 实验。结果表明,4 种细胞中Notch1 的表达量均有不同程度的减少,随着 CGA 浓度的增加,细胞中 Notch1 的表达受抑制的程度进一步增强(图2),说明 CGA 能够以剂量依赖的方式抑制体外培养的食管癌细胞中 Notch1 的表达。这一结果与 4-NQO 诱导的自发性小鼠食管癌模型中食管组织 IHC 染色的结果趋势一致,说明 CGA 可以调节体内、外食管癌细胞中 Notch1 的表达,换而言之,Notch1 可能是 CGA 的作用靶点之一。
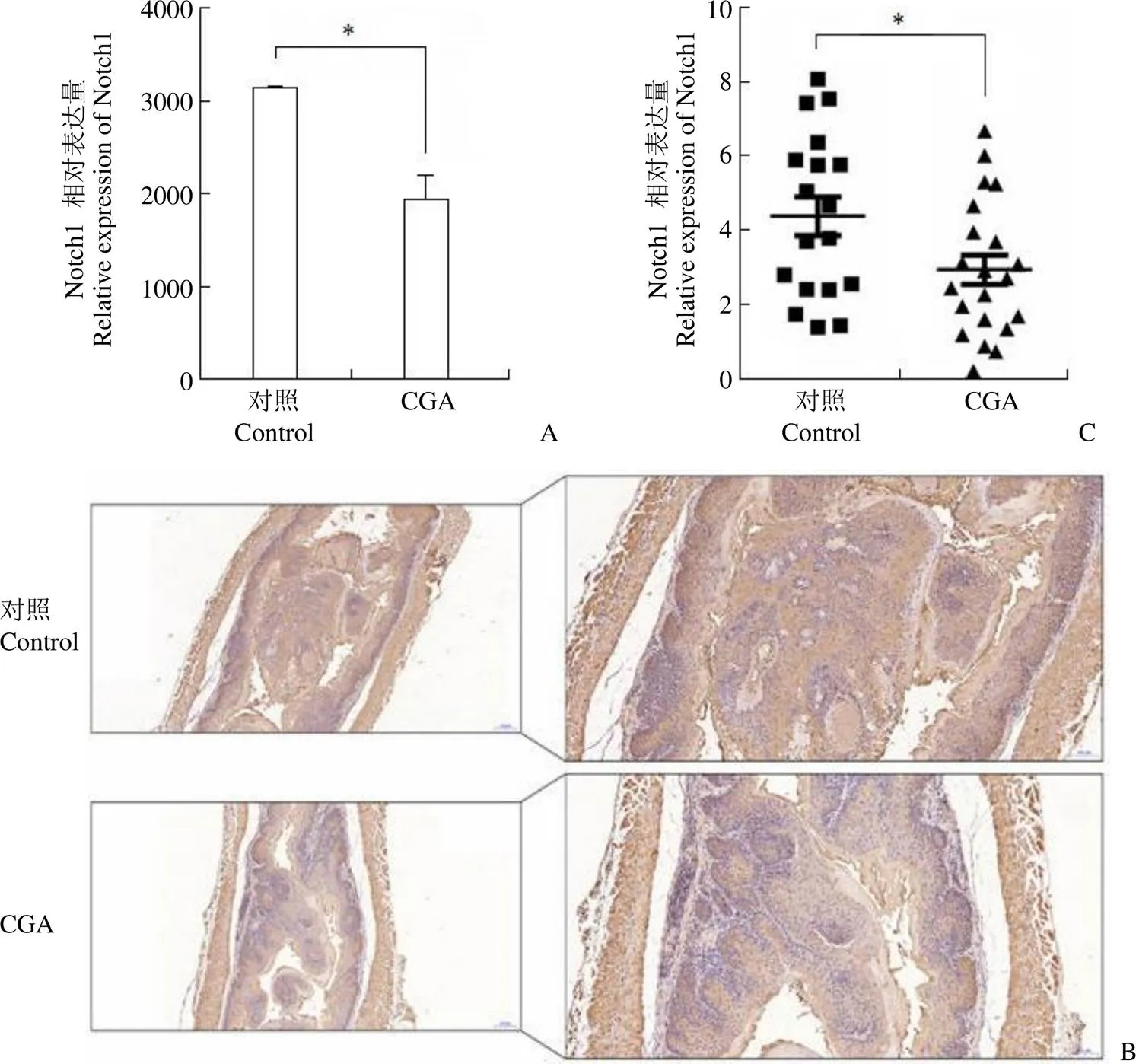
图1 CGA 对4-NQO 诱导的自发性食管癌小鼠食管组织内Notch1 表达的影响(A:利用芯片检测方法检测食管组织中Notch1 的表达情况;B:IHC 染色检测小鼠食管组织中Notch1 的表达;C:IHC 染色结果的定量分析;*P < 0.05)
Figure 1 The expression of Notch1 in esophagus tissues was down-regulated by CGA in 4-NQO induced ESCC murine model (A: The expression of Notch1 in esophagus tissues via microarray analysis; B: Representative photos of Notch1 expression in esophagus tissues by IHC staining; C: Quantitative analysis of IHC;*< 0.05)
2.3 敲降 Notch1 能减弱 CGA 对食管癌细胞的抑制作用
针对 Notch1 设计了两条不同的 siRNA 序列,通过瞬时转染的方式将这两条 siRNA 及 NC 分别转入 KYSE30、KYSE140、KYSE180 及 KYSE510 细胞中,于转染后 48 h 收取细胞 RNA 检测 Notch1 的表达,结果表明这两条 siRNA 均能显著抑制细胞中 Notch1 的表达,抑制率在 50% 以上(图3),说明这两条 siRNA 能够有效敲降食管癌细胞中的 Notch1 并开展进一步研究。本课题组在前期工作中已证实 CGA 能够抑制 4 种食管癌细胞的克隆形成,及 KYSE30、KYSE140、KYSE180 细胞的侵袭转移[6],根据 4 种细胞中 Notch1 受 CGA 抑制的程度高低(图2B),我们将 4 种细胞分成 2 组,分别检测敲降 Notch1 对食管癌细胞克隆形成能力和侵袭转移能力的影响。
2.3.1 对食管癌细胞克隆形成能力的影响 分别在 KYSE180 和 KYSE510 细胞中瞬时转入两条不同的 siRNA 或者 NC,再用含有 CGA(50 μmol/L)或者不含 CGA 的培养基培养 2 周,染色观察克隆团形成的情况。与本课题组前期工作的结果一致,在转染 NC 的 KYSE180 和 KYSE510 细胞中,用含 CGA 的培养基培养所形成的克隆团数目比用不含 CGA 的培养基培养所形成的克隆团数目明显减少(图4),说明 KYSE180 和KYSE510 细胞的克隆形成能力会受到 CGA 的抑制,而转染 siRNA 的 KYSE180 和 KYSE510 细胞中,用含CGA 的培养基培养所形成的克隆团数与不含 CGA 的培养基培养所形成的克隆团数相差无几(图4),表明 Notch1 在 CGA 抑制食管癌细胞克隆形成的过程中发挥了重要的作用,Notch1 的表达降低能够削弱 CGA 对食管癌细胞克隆形成能力的抑制作用。
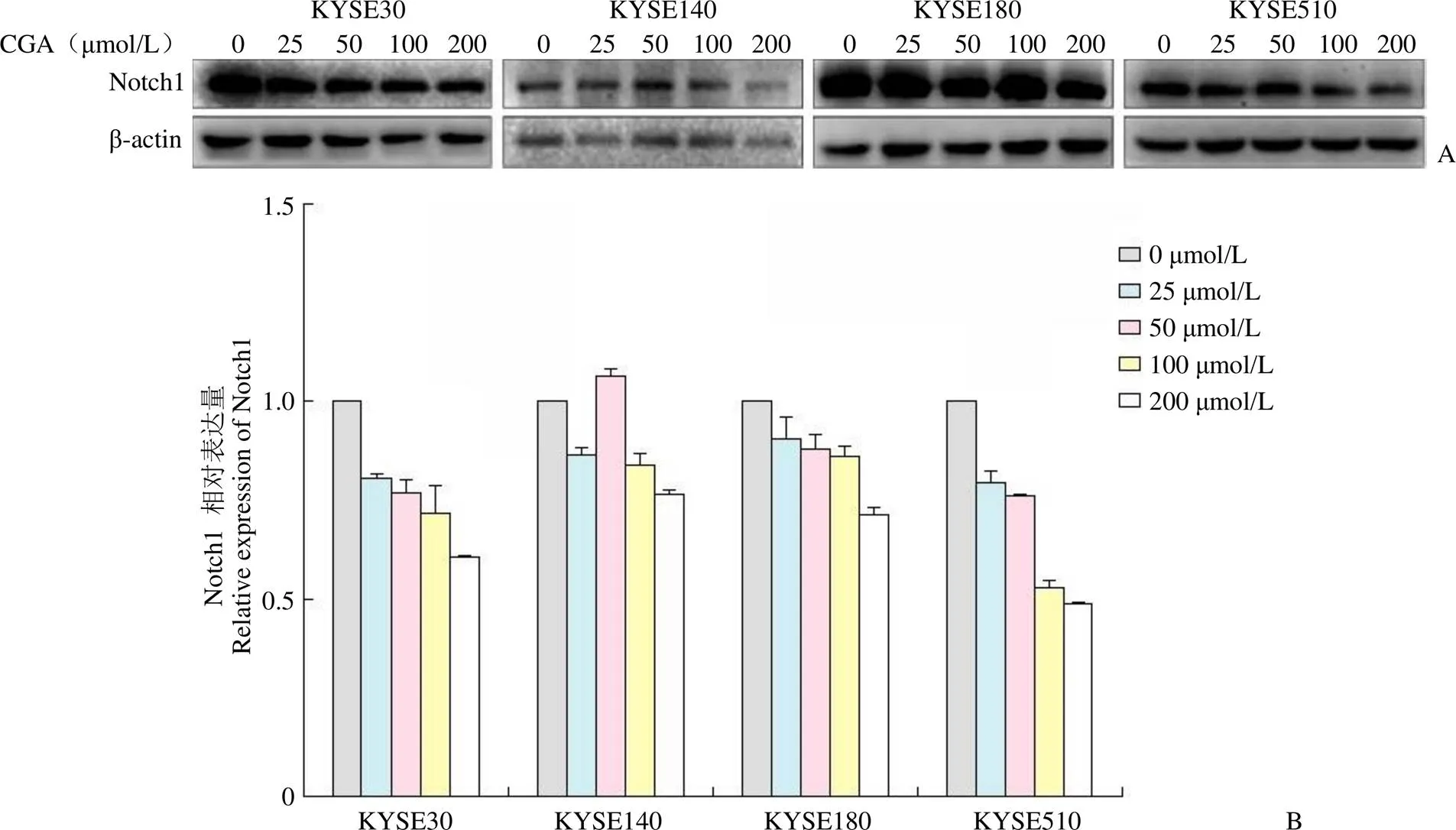
图2 Western blot 方法检测给予不同浓度 CGA 处理的 4 种食管癌细胞中 Notch1 的表达情况(A:Western blot 检测结果;B:对 Western blot 检测结果的半定量分析)
Figure 2 Detection of the expression of Notch1 in four ESCC cell lines treated with different dose of CGA by Western blot
(A: Western blot analysis; B: The density scanning of Western blot)
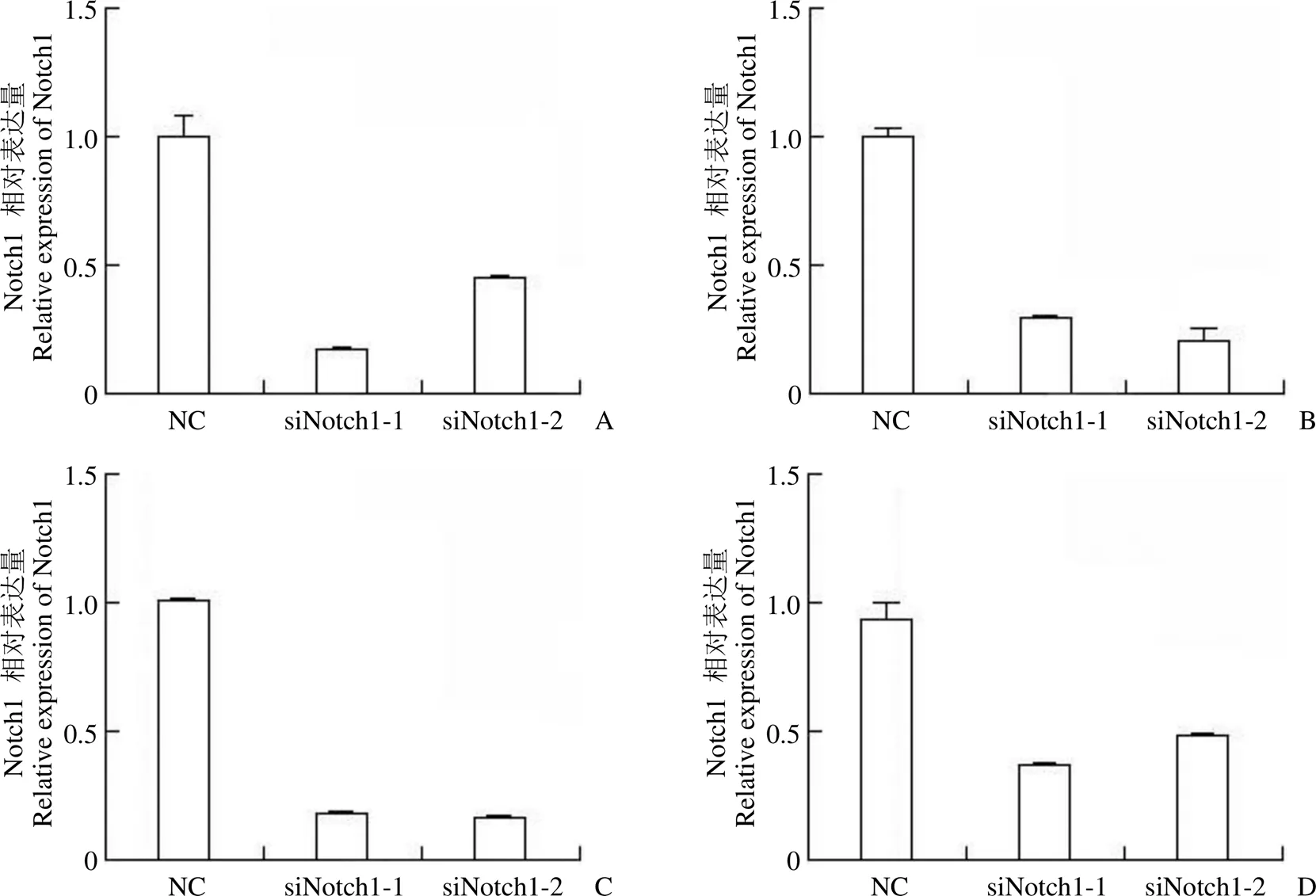
图3 qRT-PCR 检测 4 种食管癌细胞系分别转入两条不同 siRNA 或 NC 序列后 Notch1 敲降的程度(A:KYSE30;B:KYSE140;C:KYSE180;D:KYSE510)
Figure 3 Ratio of knocking down Notch1 at mRNA level in four ESCC cell lines transfected with two different siRNAs or NC using qRT-PCR (A: KYSE30; B: KYSE140; C: KYSE180; D: KYSE510)

图4 CGA 对敲降Notch1 的KYSE180 和KYSE510 细胞克隆形成的抑制作用(A:克隆形成的拍照结果;B:克隆形成比例;*P < 0.05,***P < 0.001)
Figure 4 Colony formation assays were performed to detect the inhibitory effect of CGA on Notch1 knocked-down KYSE180 and KYSE510 cells (A: Representatvie photographs; B: Percentage of formed colonies;*< 0.05,***< 0.001)
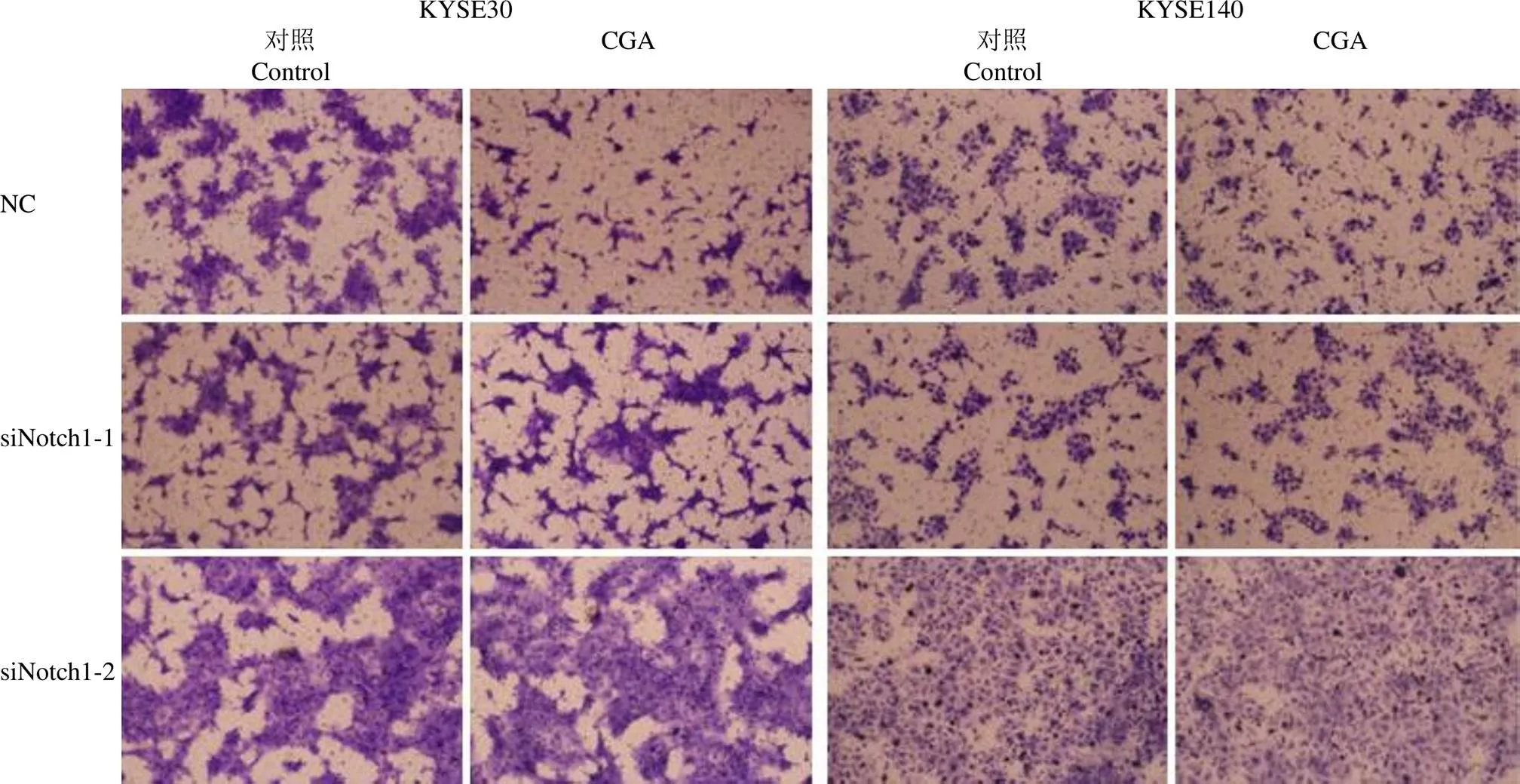
图5 CGA 处理对敲降Notch1 的KYSE30 和KYSE140 细胞侵袭转移的影响
Figure 5 Representative micrographs of invading cells using Notch1 knocked-down KYSE30 and KYSE140 cells treated with CGA
2.3.2 对食管癌细胞侵袭转移能力的影响 采用瞬时转染的方法,在 KYSE30 和 KYSE140 细胞中分别转入两条 siRNA 或者NC,转染 12 h 后,加入 CGA(50 μmol/L)处理 24 h,再将细胞接种至预铺有 Matrigel 胶的Transwell 小室中,24 h 之后染色观察结果。结果表明,与不加 CGA 处理的细胞相比,转染 NC 的 KYSE30 和 KYSE140 细胞,在经过 CGA 处理 24 h 后,侵袭转移能力明显减弱(图5),说明 CGA 的确可以抑制 KYSE30 和 KYSE140 细胞的侵袭转移,而转染 siRNA 的 KYSE30 和 KYSE140 细胞,其侵袭转移能力并未受到 CGA 的影响(图5),说明敲降 Notch1 之后,KYSE30 和 KYSE140 细胞的侵袭转移能力不再受到 CGA 的抑制,换而言之,Notch1 能够调控食管癌细胞的侵袭转移能力,CGA 通过抑制Notch1 的表达从而抑制食管癌细胞的侵袭转移。
通过上述克隆形成和侵袭转移实验,证实了 CGA 对食管癌细胞的克隆形成和侵袭转移能力均有抑制作用,而在敲降细胞中的 Notch1 之后,该抑制作用减弱消失,说明 Notch1 是 CGA 的作用靶点,CGA 通过调控 Notch1 进而影响食管癌细胞的克隆形成和侵袭转移。
3 讨论
食管癌是高度恶性的消化道肿瘤之一,其 5 年生存率仅为 20% 左右,以外科手术治疗为主的各种治疗手段并不能有效改善食管癌,尤其是晚期食管癌的预后,延长食管癌患者的生存期[7]。由于食管生理解剖位置的隐蔽性,食管癌早期症状不明显,多数食管癌患者就诊时已处于中晚期,手术可切除率低,现有的放化疗治疗手段效果欠佳、副作用大[8],亟需寻找开发新的食管癌治疗药物,尤其是针对中晚期食管癌。CGA 是金银花、杜仲等许多中草药的主要有效成分之一,具有广泛的生物学活性,在抗菌、抗病毒、抗炎、抗肿瘤等方面发挥作用[9]。在我国,已将 CGA 作为抗肿瘤药物用于治疗晚期复发 IV 级胶质母细胞瘤 II/III 期临床研究(CTR20181644)。本课题组在前期工作中已经证实 CGA 能够抑制体内、外食管癌细胞的增殖和侵袭转移,同时延长 4-NQO 诱导的自发性食管癌小鼠的生存期[6],表明 CGA 同样具有良好的抗食管癌效果。然而,作为小分子天然活性产物,CGA 具有多靶点、多作用机制的特性[9],在不同种类肿瘤中的具体作用靶点和分子机制并未明确,需要深入探讨研究。
Notch1 是 Notch 蛋白家族成员之一,具有高度的保守性,在脊椎动物和非脊椎动物中广泛存在。Notch1 参与的信号通路在许多基本的生物学进程和组织稳态中发挥了十分重要的作用,因此它的异常可以直接导致多种人类疾病,从各种发育综合征(如脊椎肋骨发育不全、并指等)到各种成人疾病(如肿瘤、阿尔茨海默病等)等[3]。由于 Notch1 所介导的信号通路具有细胞组织背景依赖的特性[10],尽管有大量研究报道 Notch1 的异常与多种肿瘤的发生发展密切相关,其在肿瘤中的具体作用依旧不明确,既可以作为原癌基因发挥促癌作用,又可以作为抑癌基因发挥抑癌作用,其具体作用取决于不同的肿瘤类型,或者同一肿瘤的不同亚型[4, 10-14]。在食管癌中,多个研究团队针对不同地区来源的食管癌组织进行高通量测序后均发现,编码 Notch1 蛋白的1 基因在食管癌组织中常常出现无意义突变或者扩增[5, 15-18],提示 Notch1 可以作为食管癌的一个分子标志物。同时,Notch1表达量的高低也与食管癌的分化程度和生存预后密切相关,高表达 Notch1 的食管癌患者的生存期明显缩短[19-20]。另外一项针对 4-NQO 诱导的自发性食管癌小鼠模型的研究表明,与正常对照小鼠相比,食管癌小鼠组织中 Notch1 的表达量明显升高,并且其表达量随着食管癌的发生发展进程不断增加[21],这些研究均表明 Notch1 在食管癌的发生发展过程中发挥了重要的作用。在本实验中,通过对 4-NQO 诱导的自发性食管癌小鼠模型中的食管组织进行表达谱分析找出其中的差异基因,发现 Notch1 在对照组和 CGA 治疗组中的表达存在明显差异,并且通过 IHC 染色及 qRT-PCR 实验证实了这一差异的存在,提示 Notch1 的表达下调与 CGA 抑制食管癌密切相关。
肿瘤细胞干性和自我更新能力在肿瘤的发生、发展、转移及复发过程中发挥了重要的作用,克隆形成和侵袭转移能力则是体现肿瘤细胞干性的其中两个特征[22]。研究表明,Notch1 及其介导参与的信号通路能够调控食管癌细胞的克隆和侵袭转移,进而影响食管癌细胞的干性[21, 23]。本课题组前期工作已经证实 CGA 能够抑制食管癌细胞的增殖、克隆形成和侵袭转移这几个肿瘤细胞干性的特征,这一抑制作用与调节食管癌细胞内干性相关转录因子 SOX2、Bmi1 的表达相关[6]。作为小分子天然化合物,CGA 的作用靶点与作用机制并不唯一,因此,在课题组前期工作的基础上,本实验发现 Notch1 在 CGA 抑制食管癌细胞的克隆形成和侵袭转移过程中同样发挥了重要的作用,提示Notch1 是 CGA 抑制食管癌的另外一个作用靶点。然而,在 CGA 针对食管癌细胞发挥抑制作用的过程中,Notch1 和SOX2、Bmi1 之间是否存在联系或者交叉作用,除了对食管癌细胞克隆形成和侵袭转移的作用之外,Notch1 与 SOX2、Bmi1 对 CGA 调节食管癌细胞其他干性特征,如放化疗抵抗等方面是否同样发挥作用,以及它们的具体调控机制仍然有待进一步的研究和探讨。
尽管 Notch1 在肿瘤中的具体作用还有待进一步明确,针对能够下调 Notch1 表达的抗肿瘤和化疗增敏药物的研究发现,这些药物能发挥减少肿瘤干细胞亚群数量,从而达到抗肿瘤的作用[4],提示 Notch1 也可以作为临床抗肿瘤药物研发的一个不错的靶点。围绕 Notch1 及其介导的信号通路中的分子作为临床抗肿瘤治疗靶点的可行性研究已有大量开展[24-26]。使用 Notch1 的抑制剂,例如Notch1 单克隆抗体、Notch1 siRNA、γ-分泌酶抑制剂、天然产物等,能够在不同肿瘤阶段发挥抗癌作用[4]。这其中被研究最多的是 γ-分泌酶,其能够导致 Notch 介导的信号通路的失活,目前已有临床研究开展探讨分泌酶抑制剂的单用和联用治疗肿瘤的效果[27-29]。本研究已经证实 Notch1 是 CGA 发挥抗食管癌作用的靶点之一,能够影响食管癌细胞的克隆形成和侵袭转移,提示 Notch1 作为抗食管癌药物研究靶点是具有可行性的,为进一步阐述 CGA 治疗食管癌的分子作用机制,以及临床抗食管癌药物的研发提供更多的理论依据。
[1] Global Burden of Disease Cancer C, Fitzmaurice C, Dicker D, et al. The global burden of cancer 2013. JAMA Oncol, 2015, 1(4):505-527.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015. CA Cancer J Clin, 2016, 66(2):115-132.
[3] Kopan R, Ilagan MX. The canonical Notch signaling pathway: unfolding the activation mechanism. Cell, 2009, 137(2):216-233.
[4] Gharaibeh L, Elmadany N, Alwosaibai K, et al. Notch1 in cancer therapy: possible clinical implications and challenges. Mol Pharmacol, 2020, 98(5):559-576.
[5] Sasaki Y, Tamura M, Koyama R, et al. Genomic characterization of esophageal squamous cell carcinoma: Insights from next-generation sequencing. World J Gastroenterol, 2016, 22(7):2284-2293.
[6] Zhan Y, Li R, Feng CL, et al. Chlorogenic acid inhibits esophageal squamous cell carcinoma growth in vitro and in vivo by downregulating the expression of BMI1 and SOX2. Biomed Pharmacother, 2020, 121:109602
[7] Watanabe M, Otake R, Kozuki R, et al. Recent progress in multidisciplinary treatment for patients with esophageal cancer. Surg Today, 2020, 50(1):12-20.
[8] Taylor PR, Abnet CC, Dawsey SM. Squamous dysplasia--the precursor lesion for esophageal squamous cell carcinoma. Cancer Epidemiol Biomarkers Prev, 2013, 22(4):540-552.
[9] Wang QH, Du TT, Zhang ZH, et al. Advances in research on the pharmacological effects and mechanism of action of chlorogenic acid. Acta Pharm Sin, 2020, 55(10):2273-2280. (in Chinese)
王庆华, 杜婷婷, 张智慧, 等. 绿原酸的药理作用及机制研究进展. 药学学报, 2020, 55(10):2273-2280.
[10] Zhang M, Biswas S, Qin X, et al. Does Notch play a tumor suppressor role across diverse squamous cell carcinomas? Cancer Med, 2016, 5(8):2048-2060.
[11] Malyukova A, Dohda T, von der Lehr N, et al. The tumor suppressor gene hCDC4 is frequently mutated in human T-cell acute lymphoblastic leukemia with functional consequences for Notch signaling. Cancer Res, 2007, 67(12):5611-5616.
[12] Licciulli S, Avila JL, Hanlon L, et al. Notch1 is required for Kras-induced lung adenocarcinoma and controls tumor cell survival via p53. Cancer Res, 2013, 73(19):5974-5984.
[13] O'Brien R, Marignol L. The Notch-1 receptor in prostate tumorigenesis. Cancer Treat Rev, 2017, 56:36-46.
[14] Cancer Genome Atlas Research Network. Comprehensive genomic characterization of squamous cell lung cancers. Nature, 2012, 489(7417):519-525.
[15] Salem ME, Puccini A, Xiu J, et al. Comparative molecular analyses of esophageal squamous cell carcinoma, esophageal adenocarcinoma, and gastric adenocarcinoma. Oncologist, 2018, 23(11):1319-1327.
[16] Song Y, Li L, Ou Y, et al. Identification of genomic alterations in oesophageal squamous cell cancer. Nature, 2014, 509(7498):91-95.
[17] Gao YB, Chen ZL, Li JG, et al. Genetic landscape of esophageal squamous cell carcinoma. Nat Genet, 2014, 46(10):1097-1102.
[18] Lin DC, Hao JJ, Nagata Y, et al. Genomic and molecular characterization of esophageal squamous cell carcinoma. Nat Genet, 2014, 46(5):467-473.
[19] Ogawa R, Ishiguro H, Kimura M, et al. NOTCH1 expression predicts patient prognosis in esophageal squamous cell cancer. Eur Surg Res, 2013, 51(3-4):101-107.
[20] Liu J, Fan H, Ma Y, et al. Notch1 is a 5-fluorouracil resistant and poor survival marker in human esophagus squamous cell carcinomas. PLoS One, 2013, 8(2):e56141.
[21] Natsuizaka M, Whelan KA, Kagawa S, et al. Interplay between Notch1 and Notch3 promotes EMT and tumor initiation in squamous cell carcinoma. Nat Commun, 2017, 8(1):1758.
[22] Rassouli FB, Matin MM, Saeinasab M. Cancer stem cells in human digestive tract malignancies. Tumour Biol, 2016, 37(1):7-21.
[23] Jia R, Yang L, Yuan X, et al. GASC1 promotes stemness of esophageal squamous cell carcinoma via NOTCH1 promoter demethylation. J Oncol, 2019, 2019:1621054.
[24] Katoh M, Katoh M. Precision medicine for human cancers with Notch signaling dysregulation (Review). Int J Mol Med, 2020, 45(2):279- 297.
[25] Liu J, Shen JX, Wen XF, et al. Targeting Notch degradation system provides promise for breast cancer therapeutics. Crit Rev Oncol Hematol, 2016, 104:21-29.
[26] Guo L, Zhang T, Xiong Y, et al. Roles of NOTCH1 as a therapeutic target and a biomarker for lung cancer: controversies and perspectives. Dis Markers, 2015, 2015:520590.
[27] Papayannidis C, DeAngelo DJ, Stock W, et al. A phase 1 study of the novel gamma-secretase inhibitor PF-03084014 in patients with T-cell acute lymphoblastic leukemia and T-cell lymphoblastic lymphoma. Blood Cancer J, 2015, 5(9):e350.
[28] Pant S, Jones SF, Kurkjian CD, et al. A first-in-human phase I study of the oral Notch inhibitor, LY900009, in patients with advanced cancer. Eur J Cancer, 2016, 56:1-9.
[29] Hughes DP, Kummar S, Lazar AJ. New, tolerable gamma-secretase inhibitor takes desmoid down a notch. Clin Cancer Res, 2015, 21(1):7-9.
Chlorogenic acid suppresses colony formation and invasion of esophageal squamous cell carcinoma via down-regulating the expression of Notch1
ZHAN Yun, LI Rui, JIANG Jian-dong, HAN Yan-xing
Author Affiliations: State Key Laboratory of Bioactive Substances and Function of Natural Medicine, Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China
This study aims to investigate the effect and mechanism of Notch1 in the process of chlorogenic acid (CGA) suppressing esophageal squamous cell carcinoma (ESCC).Microarray assay was performed to detect the different genes in esophagus tissues of ESCC murine model treated with CGA, and immunohistochemistry (IHC) was used for verification. Different ESCC cell lines were treated with CGA, and the expression of Notch1 in these cells was detected by Western blot. RNAi was used to knock down Notch1 in ESCC cells before adding CGA treatment, then the colony formation assay and Transwell invasion assay were performed to detect the capabilities of colony formation and invasion in these cells, respectively.Microarray assay analysis showed that the expression of Notch1 in esophagus tissues was down-regulated in mice treated with CGA, which was confirmed by IHC staining. Inhibition of Notch1 expression in different ESCC cell lines was observed by Western blot, and the inhibitory effect was gradually enhanced with the increase of CGA concentration.Using RNAi technology to knock down Notch1 in ESCC cells and adding CGA to perform colony formation assay and Transwell invasion assay, the results showed that the number of colonies formed and cells invaded by CGA treatment was much lower than that of the control group in ESCC cells that normally express Notch1. However, in Notch1 knocked-down ESCC cells, no significant difference of the number of either colonies formed or cells invaded was observed after the treatment of CGA.Notch1 is one target of CGA, and CGA inhibits the capabilities of colony formation and invasion of ESCC cells by acting on Notch1.
chlorogenic acid; Notch1; esophageal carcinoma; colony formation; invasion
HAN Yan-xing, Email: hanyanxing@imm.ac.cn
“重大新药创制”国家科技重大专项(2018ZX09711001- 003-001);协和青年科研基金(3332015165)
韩燕星,Email:hanyanxing@imm.ac.cn
2021-01-06
10.3969/j.issn.1673-713X.2021.03.002

