1,10-癸二醇对杀鲑气单胞菌群体感应的抑制作用
牛慧超,李婷婷,刘景云,孙晓佳,励建荣,*,谢 晶,牟伟丽,沈 琳,劳敏军,郭晓华,邓尚贵
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工 及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013; 2.大连民族大学生命科学学院,辽宁大连 116600; 3.上海海洋大学食品学院,上海 201306; 4.蓬莱京鲁渔业有限公司,山东烟台 265600; 5.大连东霖食品股份有限公司,辽宁大连 116100; 6.浙江兴业集团有限公司,浙江舟山 316120; 7.山东美佳集团有限公司,山东日照 276800 8.浙江海洋大学,浙江舟山 316022)
水产品是我们生活中不可或缺的食物,水产品中富含蛋白质和营养成分,例如DHA、EPA和牛磺酸[1-2],深受消费者的青睐。水产品不但富含营养,而且具有美味的口感[3],但由于肌肉组织柔软,含水量高,并且不饱和脂肪酸易于氧化,因此在储存和运输过程中很容易腐败[4]。水产品的腐败变质的原因是多方面的,其腐败机制与生物、化学、物理等复杂的变化有关[5]。研究发现微生物是导致水产品腐败的最常见原因,近年来由微生物所致的食品腐败中检测到不同类型的信号分子(N-acyl-homoserinelactones,AHLs),且鱼类腐败菌主要以AHLs介导调控毒力因子和致腐因子表达,进而影响水产品腐败变质[6],群体感应(Quorum sensing,QS)系统参与调控微生物的腐败[7]。杀鲑气单胞菌便是一种水产品腐败菌。
QS系统是细菌之间信息交换的一种机制。它产生并感应称为自动诱导剂的信号分子,以监测其种群密度并调节细菌的许多生理功能,例如:生物发光、细菌运动、毒素分泌、生物被膜[8]形成和其他次级代谢产物的产生[9-11],细菌进行这些生理活动便会对食物造成腐败。群体感应抑制剂(Quorum sensing inhibitors,QSIs)是指可以破坏或者干扰细菌间QS系统的物质,理想的QS抑制剂已被定义为化学稳定和高效的低分子质量分子,其对QS调节具有高度的特异性,并且无毒副作用[12],破环水产品中腐败菌的QS系统,可以有效减少水产品腐败变质带来的经济损失。1,10-癸二醇是一种化学物质,它的分子式是C10H22O2,可以由人工合成,主要用来制备香精香料,中药柴胡中也含有这种物质。本研究团队在对群体感应抑制剂进行虚拟筛选时,发现1,10-癸二醇可作为群体感应抑制剂[13],故本文探究其对杀鲑气单胞菌群体感应系统的抑制效果,并对新型群体感应抑制剂的研发提供了理论依据。
1 材料与方法
1.1 材料与仪器
大黄鱼源杀鲑气单胞菌 由本实验室分离并鉴定(于2019年5月从腐败大黄鱼中进行分离);紫色杆菌CV026(ChromobacteriumviolaceumCV026) 为C.violaceumATCC 31532的mini-Tn5突变体,该菌株自己不会产生AHLs,对短链的AHLs(C4~C8)具有敏感性,当加入外源AHLs培养时,会产生特征性紫色菌素[14-15];1,10-癸二醇 上海阿拉丁生化科技股份有限公司(人工合成);LB肉汤 青岛高科技工业园海博生物技术有限公司;甲醇 天津市津东天正精细化学试剂厂;卡那霉素、信号分子标准品 美国Sigma公司;结晶紫 天津致远化学试剂有限公司。
SW-CJ-2FD超净工作台 苏净集团苏州安泰空气技术有限公司;MLS-3030CH立式压力蒸汽灭菌锅 广州三洋电机有限公司;Biofuge Strotas冷冻高速离心机 美国Thermo Fisher公司;iMark酶标仪 美国Bio-Rad公司;SS-4800场发射扫描电子显微镜 江苏太仓市实验设备厂;LRH-150生化培养箱 上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 菌株培养条件 本实验中,所用报告菌株CV026和杀鲑气单胞菌株培养均在160 r/min、28 ℃下培养,平板培养均在28 ℃的生化培养箱中;菌株活化:将报告菌株CV026和杀鲑气单胞菌分别接种于新鲜的LB肉汤中过夜活化,接种时菌液与肉汤的体积比例为1∶100。
1.2.2 1,10-癸二醇的抑菌活性和QSIs抑制活性的测定 将报告菌株CV026和杀鲑气单胞菌活化两次后,分别接种于新鲜的LB肉汤中,接种时菌液与肉汤的体积比例为1∶100,接种CV026的肉汤中需要加入卡那霉素,卡那霉素在肉汤中的浓度为20 μL/mL。培养完成后将菌液与LB营养琼脂混合,倒平板,用牛津杯打孔。待平板凝固后,向孔中加浓度为0.4 mg/mL的1,10-癸二醇溶液(1,10-癸二醇用体积分数50%的甲醇溶液溶解)。以体积分数50%的甲醇溶液作为阴性对照。然后将平板放置在的28 ℃生化培养箱中静置培养并观察1,10-癸二醇对CV026和杀鲑气单胞菌生长情况的影响。
将报告菌株CV026接种于添加有卡那霉素的LB肉汤中培养完成后,将菌液与LB营养琼脂培养基混合,然后加入C6-HSL(N-Hexanoyl-L-hoMoserine lactone)并混匀,用牛津杯打孔法,将浓度为0.4 mg/mL的1,10癸二醇溶液加入到孔中。以体积分数50%的甲醇溶液作为阴性对照。然后将平板置于生化培养箱中静置培养,观察1,10-癸二醇对紫色菌素的抑制情况。
1.2.3 1,10-癸二醇对紫色杆菌生长及紫色菌素产量的影响 根据文献[16]中的方法,将活化后的报告菌株CV026接种于添加了不同质量浓度(0.1、0.2、0.3、0.4 mg/mL)的1,10-癸二醇溶液的新鲜LB肉汤中,并且肉汤中添加C6-HSL。同时,加入一组质量浓度不同但没有信号分子的1,10-癸二醇溶液的实验组,以观察1,10-癸二醇是否对菌株的生长有影响。以加入50%体积的甲醇溶液实验组设为阴性对照。
培养完成后,从添加了信号分子的实验组中分别吸取300 μL的菌液加入灭过菌的1.5 mL离心管中,各加入150 μL 10%的十二烷基硫酸钠,用振荡器振荡10 s,再加入600 μL的正丁醇后,用振荡器振荡5 s,接着用离心机以10000 r/min离心5 min,最后吸取200 μL的紫色上清液加入到96孔板中,使用酶标仪于波长为595 nm处测定OD值。同时将加入了不同质量浓度的1,10-癸二醇溶液但是不添加信号分子的实验组的菌液各吸取200 μL加入到96孔板中,同样在波长为595 nm处测定其OD值。
1.2.4 1,10-癸二醇对杀鲑气单胞菌胞外蛋白酶活力的影响 根据参考文献[17],配制脱脂牛奶平板,倒平板,用牛津杯打孔,凝固后,向孔中分别加入200 μL制作好的杀鲑气单胞菌的菌悬液,菌悬液中分别含有不同质量浓度(0.1、0.2、0.3、0.4 mg/mL)的1,10-癸二醇溶液,并设置不添加1,10-癸二醇的阴性对照组以及添加C6-HSL信号分子的阳性对照组,然后将平板放置于生化培养箱中静置培养。
1.2.5 1,10-癸二醇对杀鲑气单胞菌群集现象和泳动现象的影响 根据参考文献[18],配置群集与泳动所需要的培养基,将1,10-癸二醇溶液用0.22 μm的滤膜过滤后,分别与所配制的群集和泳动的培养基混合均匀,并使1,10-癸二醇的终浓度分别为0.1、0.2、0.3、0.4 mg/mL。并设置不添加1,10-癸二醇的阴性对照组以及添加C6-HSL信号分子的阳性对照组。然后倒平板,用牛津杯打孔,待平板冷却凝固后,分别向平板表面中央添加2 μL过夜活化两次的杀鲑气单胞菌液,等平板表面所加的菌液风干后,进行培养。
1.2.6 1,10-癸二醇对杀鲑气单胞菌生物被膜生成的影响
1.2.6.1 酶标法测定1,10-癸二醇对杀鲑气单胞菌生物被膜生成量的影响 根据参考文献[19],将杀鲑气单胞菌活化后,与新鲜的LB肉汤培养液按照1∶100 (V/V)混合均匀后,吸取1 mL加入到灭过菌的1.5 mL离心管中,然后分别加入1,10-癸二醇溶液,并使其终浓度分别为0.1、0.2、0.3、0.4 mg/mL,另设置加入体积分数为50%的甲醇溶液作为阴性对照组以及加入C6-HSL信号分子作为阳性对照组。培养完成后,分别吸取200 μL用于测定菌液密度。将剩余菌液倒掉,分别用无菌水清洗3次后,在无菌风下自然干燥35 min,接着再分别加入1 mL 1 g/L的结晶紫染液,室温下染色15 min后,倒去结晶紫染液,再用无菌水清洗5次,最后分别加入1 mL的体积分数为33%的冰醋酸溶液。充分溶解后,各吸取200 μL于96孔板中,用酶标仪在波长为595 nm处测定OD值。杀鲑气单胞菌生物被膜的相对生成率按公式(1)计算。
生物被膜相对生成率(%)=(OD595 nm实验组/OD595 nm阴性对照组)×100
式(1)
式中:OD595 nm实验组为加入1,10-癸二醇或C6-HSL的实验组测得的值;OD595 nm阴性对照组为加入体积分数为50%的甲醇溶液所测得的值。
1.2.6.2 扫描电子显微镜观测 1,10-癸二醇对杀鲑气单胞菌生物被膜形态的影响 预处理锌片(纯度≥99.0%,厚度0.20 mm):将去除氧化层的锌片切割成6×6 mm大小后,先浸入无水乙醇中超声,然后浸入去离子水中超声,取出后烘干,灭菌备用。
将10 mL含有杀鲑气单胞菌菌液LB肉汤倒入无菌培养皿中,杀鲑气单胞菌菌液的体积占比为1%,再分别加入1,10-癸二醇溶液,终浓度分别为0.1、0.2、0.3、0.4 mg/mL,另设置不添加1,10-癸二醇溶液作为阴性对照组以及加入C6-HSL信号分子作为阳性对照组。混合均匀后将预处理好的锌片放入其中,放置于生化培养箱中静置培养。
在取出锌片前,准备好无菌水,以及配制好体积分数为2.5%的戊二醛溶液,并将戊二醛溶液置于4 ℃的冰箱预冷,取出锌片后,用预先准备好的无菌水将锌片冲洗3~5次,然后将锌片放入准备好的戊二醛溶液中浸泡,浸泡结束后,放入梯度体积分数乙醇中进行脱水,再用醋酸异戊脂置换两次,最后将锌片室温下自然干燥,喷金处理后进行观测。
1.3 数据处理
每个实验做三个平行,实验数据均用Excel 2010建立数据库,采用SPSS 20.0统计分析软件进行实验数据处理,采用Origin 9.0软件作图,实验数据处理结果均以“平均值±标准偏差”表示。显著性差异分析P<0.05。
2 结果与分析
2.1 1,10-癸二醇的抑菌活性和QS抑制活性测定
图1所示为0.4 mg/mL的1,10-癸二醇浓度对CV026菌株产紫色菌素的抑制效果图。由图可以看出,加入体积分数为50%的甲醇溶液的孔周围是被紫色包围的,说明溶剂不具有QS抑制作用;而加入1,10-癸二醇溶液的孔周围出现白色且浑浊的圈,这证明1,10-癸二醇溶液可以抑制紫色菌株CV026产生紫色菌素。

图1 1,10-癸二醇对紫色杆菌 CV026产紫色菌素能力的抑制活性Fig.1 Inhibitory activity of 1,10-decanediol on violacein production of CV026注:1:体积分数为50%的甲醇溶液; 2:0.4 mg/mL的1,10-癸二醇溶液。
2.2 1,10-癸二醇对紫色杆菌的生长及紫色菌素产量影响的影响
从图2中可以看出,与对照组相比,1,10-癸二醇溶液处理组中的紫色菌素产量显著(P<0.05)下降,而且随着浓度逐渐增大,紫色菌素的产量也随之减少。此外,加入1,10-癸二醇溶液后,CV026菌株的菌液密度没有显著性差异,表明生长并未受到影响。由此可知,1,10-癸二醇的QS抑制活性不是由于细菌生长受到抑制,而是通过干扰QS系统实现的。

图2 1,10-癸二醇溶液对紫色菌株 CV026紫色菌素产量和菌液密度的影响Fig.2 Effect of 1,10-decanediol solution on violacein production and bacterial density of CV026注:不同大写或小写字母表示差异显著(P<0.05),图4、图6同。
2.3 1,10-癸二醇对杀鲑气单胞菌胞外蛋白酶活力的影响结果
微生物造成水产品的腐化,是通过蛋白酶水解水产品中的蛋白质,同时会利用分解产物繁殖[20-21]。结合图3和图4可以看出,各组数据之间差异性显著(P<0.05),当有外源C6-HSL信号分子的作用时,杀鲑气单胞菌分泌的胞外蛋白酶产生的水解圈直径(平均直径)最大为26.195 mm,表明蛋白酶活性受QS系统调控,并且C6-HSL信号分子能够促进杀鲑气单胞菌胞外蛋白酶的产生。而当加入1,10-癸二醇溶液后,胞外蛋白酶产生的水解圈直径随着1,10-癸二醇溶液浓度的增大而逐渐减小。这表明1,10-癸二醇可以通过干扰QS系统抑制其杀鲑气单胞菌蛋白酶的活性。梅永超等[22]通过研究发现绿薄荷精油可以通过调控QS机制来达到抑制温和气单胞菌胞外蛋白酶的产生。
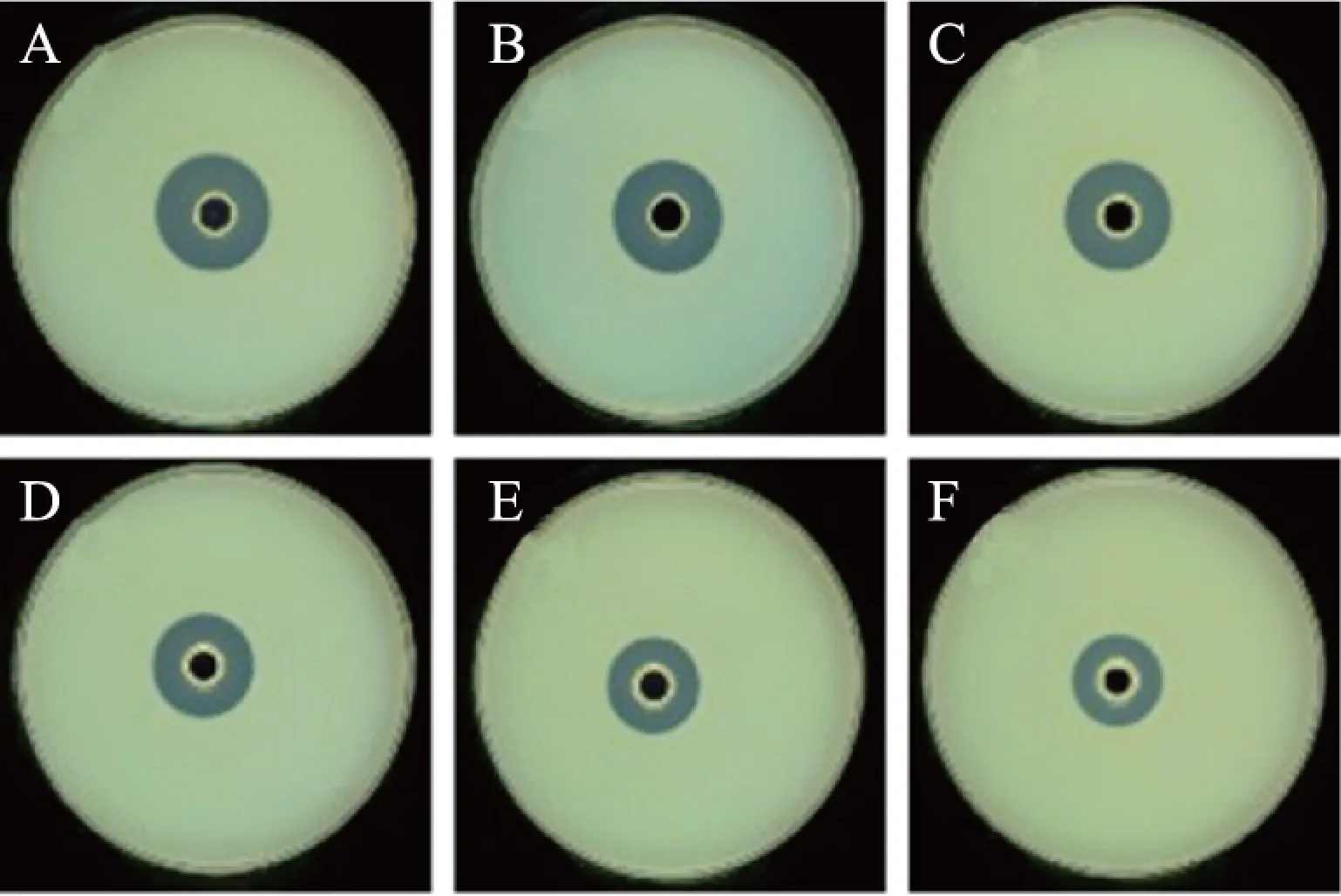
图3 1,10-癸二醇对杀鲑气单胞菌 胞外蛋白酶活力的影响Fig.3 Effect of 1,10-decanediol on extracellular protease activity of Aeromonas salmon注:A:C6-HSL;B:0 mg/mL;C:0.1 mg/mL; D:0.2 mg/mL;E:0.3 mg/mL;F:0.4 mg/mL。

图4 1,10-癸二醇对杀鲑气单胞菌 胞外蛋白酶活力的影响Fig.4 Effect of 1,10-decanediol on extracellular protease activity of Aeromonas salmon
2.4 1,10-癸二醇对杀鲑气单胞菌群集现象和泳动现象的影响
群集和泳动是细菌由鞭毛介导在接触表面迁移的两种方式,这两种运动方式的区别在于培养基的琼脂含量不同[23-25]。研究表明,细菌的群集和泳动能力对生物被膜的形成过程有极其重要的影响[26]。Zhang[27]等发现了精油成分对微生物的群集和泳动有抑制效果。
从图5中可以看出,外源C6-HSL信号分子处理组中杀鲑气单胞菌的迁移范围明显增大。而加入了1,10-癸二醇溶液后,运动能力是与1,10-癸二醇溶液的浓度呈负相关的,随着1,10-癸二醇溶液浓度不断的增大,其运动能力也越来越弱。当1,10-癸二醇的浓度为0.4 mg/mL时,杀鲑气单胞菌的运动能力变得极其微弱。
2.5 1,10-癸二醇对杀鲑气单胞菌生物被膜生成的影响
2.5.1 1,10-癸二醇对杀鲑气单胞菌生物被膜生成量的影响 生物被膜的形成是细菌为了适应自然环境且利于细菌生存的一种生命现象,由微生物及其分泌物积聚而形成,其自身包绕于积聚物中形成的大量细菌聚集膜样物。作为细菌保护自身的生长方式,其对环境变化的耐受力远高于浮游菌,一旦在食品加工设备表面形成,很容易对食品造成严重污染[28]。

图5 1,10-癸二醇对杀鲑气单胞菌群集、泳动的影响Fig.5 Effect of 1,10-decanediol on swarming and swimming motility of Aeromonas salmon注:A:1,10-癸二醇对杀鲑气单胞菌群集的影响;B:1,10-癸二醇对杀鲑气单胞菌泳动的影响。 1:C6-HSL;2:0 mg/mL;3:0.1 mg/mL;4:0.2 mg/mL;5:0.3 mg/mL;6:0.4 mg/mL。
从图6中可以看到,无论加入外源C6-HSL信号分子,还是加入不同浓度的1,10-癸二醇溶液,杀鲑气单胞菌的菌液浓度都无显著性差异,表明都不会影响杀鲑气单胞菌的生长,而对生物被膜的相对生成率则有显著差异,表明对生物被膜的生成有显著影响。加入外源C6-HSL信号分子的阳性对照组对阴性对照组来说,杀鲑气单胞菌的生物被膜生成率提高了20.5%。而加入了1,10-癸二醇溶液后,随着浓度的增大,杀鲑气单胞菌的生物被膜生成率相应地降低。当1,10-癸二醇溶液的浓度为0.4 mg/mL时,生物被膜的生成率降低了76.92%。这表明,1,10-癸二醇可以通过调控杀鲑气单胞菌的QS机制来调控其生物被膜的生成。并且发现研究结果与群集、泳动的研究结果互相印证。

图6 1,10-癸二醇对杀鲑气 单胞菌生物被膜生成率的影响Fig.6 Effect of 1,10-decanediol on biofilm formation rate of Aeromonas salmon
2.5.2 1,10-癸二醇对杀鲑气单胞菌生物被膜形态的影响 图7是通过扫描电子显微镜观察杀鲑气单胞菌形成的生物被膜结构的图片。其中A为添加了外源C6-HSL信号分子的阳性对照组所生成的生物被膜形态,B为阴性对照组生物被膜所生成的形态,从图中可以看出阴性对照组所生成的生物被膜均匀致密,将载体表面全部覆盖;而阳性对照组中生物被膜形态不仅结构致密,而且还形成堆叠状态,形成的生物被膜更厚。其中C~F分别是1,10-癸二醇溶液浓度为0.1、0.2、0.3、0.4 mg/mL时所形成的生物被膜的形态,可以看出当加入1,10-癸二醇溶液后,杀鲑气单胞菌随形成生物被膜出现裂缝,而且随着添加的1,10-癸二醇浓度的增大裂缝也变得越来越多,其中D图的裂缝多余C图,而E图中膜已成完全龟裂状,F图中膜则破碎严重且面积缩小。结果表明,1,10-癸二醇可以干扰并减弱杀鲑气单胞菌形成生物被膜的能力。

图7 1,10-癸二醇对杀鲑气单胞 菌生物被膜影响的扫描电镜图Fig.7 Scanning electron microscopic images of the effect of 1,10-decanediol on biofilm of Aeromonas salmon注:A:C6-HSL;B:0 mg/mL;C:0.1 mg/mL; D:0.2 mg/mL;E:0.3 mg/mL; F:0.4 mg/mL;放大倍数:10000倍。
3 结论
本研究选取了1,10-癸二醇这种物质来作为群体感应抑制剂。通过作用于添加了外源信号分子的紫色菌株CV026来证明1,10-癸二醇在亚抑菌浓度下有抑制细菌群体感应现象的作用。研究结果表明1,10-癸二醇可以很大程度地抑制紫色菌株CV026产生紫色菌素的量,并对杀鲑气单胞菌的胞外蛋白酶活性、群集和泳动的能力以及形成生物被膜的能力均有较强的抑制作用,而且随着1,10-癸二醇溶液的浓度增大,其抑制效果也越来越明显。1,10-癸二醇对可以有效的抑制杀鲑气单胞菌的QS机制,可以做为新的保鲜剂,用来延长水产品的保存期限,减少由于腐败造成的经济损失。

