槟榔多酚对急进高原大鼠具有抗缺氧作用
霍 妍,赵安鹏,宋晶燕,李加忠,王 荣
1兰州大学药学院,甘肃 兰州 730000;2中国人民解放军联勤保障部队第940 医院全军高原医学重点实验室,甘肃兰州730050
高原在医学上通常指海拔大于2500 m的地区,高原环境具有低气压、低氧分压、寒冷、干燥、紫外线强等特点[1]。高原的恶劣气候会引发机体各脏器出现损伤,进而导致高原疾病,其中低氧分压是高原缺氧损伤的主要诱因[2]。目前,对于高原病的预防药物主要为红景天胶囊[3]。虽然红景天胶囊对于预防高原缺氧损伤具有一定的疗效,但疗效甚微,且红景天生长于高海拔地区,种植难度大,难于获得[4]。随着高原旅居人群的日益增多,开发出高效易得、毒副作用小的抗高原缺氧损伤药物越来越必要。
近年来,对于抗高原缺氧损伤药物的开发从未停止。有研究发现芫根总多糖在低压氧舱模拟缺氧的环境中,能够缓解小鼠的脑组织和肺组织的损伤[5]。有研究自拟的中药合剂益心方,在模拟高原缺氧环境中,能够保护大鼠心肌组织[6]。有文献报道麻花秦艽醇提物对高原缺氧大鼠的肺组织和脑组织具有一定的保护作用[7]。但现有抗高原缺氧药物的研究大多基于低压低氧模拟舱内进行,缺乏自然条件下高原复杂气候的影响,难以反映真实的高原环境[8]。
高原缺氧损伤是多因素、多机制的,高原缺氧环境会使机体产生一系列的生理病理反应,导致主要脏器出现损伤[9]。高原缺氧条件下,空气中氧分压降低,人体氧气摄入量减少,体内血液指标发生变化,通常用血气指标来判断机体酸碱平衡以及缺氧程度[10]。缺氧会导致自由基代谢平衡失调等一系列氧化应激反应,影响机体供能,引起重要脏器缺氧[11]。高原低氧还会导致炎症因子的大量释放,造成机体的炎症反应[12]。槟榔的主要成分为槟榔多酚,主要是黄酮类物质[13]。槟榔的抗氧化活性主要来自多酚类化合物[14]。槟榔多酚具有广泛的药理作用,如抗氧化作用、抗疲劳作用、抗菌作用及抗炎作用等[15]。多酚的含量与抗氧化抗缺氧的能力有密切的关系[16]。本课题组前期优化了槟榔多酚的提取纯化方法,验证了槟榔无水醇提物中槟榔多酚的含量,并设计实验验证了其对心肌细胞缺氧的保护作用[17]。本实验使大鼠急进海拔4010 m的高原实地,设计验证槟榔多酚是否通过提升机体抗氧化能力,减轻机体炎症反应来发挥其抗高原缺氧活性,对大鼠各脏器的高原缺氧损伤产生保护作用。
1 材料和方法
1.1 实验试剂
红景天胶囊;槟榔饮片(甘肃陇脉药材);10%水合氯醛;0.9%氯化钠注射液(石家庄四药);多聚甲醛固定液(武汉赛维尔生物科技);肝素钠(南京新百药业);BCA蛋白浓度测定试剂盒(北京索莱宝科技);SOD(测总)试剂盒(南京建成生物工程研究所);丙二醛MDA测定试剂盒(南京建成生物工程研究所);GSH试剂盒(南京建成生物工程研究所);QAR-CYT 试剂盒(RayBiotech,Inc.,广州)。
1.2 实验仪器
MDF-U2086S超低温冰箱(SANYO);3K15型4 ℃高速台式冷冻离心机(sigma);Radiometer ABL80全自动血气分析仪(Radiometer);Tissuelyser-24多样品组织研磨机(上海净信实业发展有限公司);SpectraMax i3型全自动荧光酶标仪(Molecular);涡旋混匀器(海门市其林贝尔仪器制造);倒置显微镜(Olympus)。
1.3 槟榔多酚的制备
将槟榔饮片研磨成粉末,使用80%乙醇溶液作为提取溶剂(料液比1∶30),65 ℃提取2 h。提取后的产物经过AB-8大孔树脂纯化,以95%乙醇洗脱。采用酒石酸亚铁法,以没食子酸为标准品,测定提取物中槟榔多酚含量为45.03%。
1.4 动物分组
SPF级Wistar大鼠36只,雄性,体质量200±20 g,动物许可证号为SCK(辽)2015-0001。将实验大鼠随机分成6组,6只/组,分别为平原组、高原组、高原+红景天组,阳性对照组)、高原+槟榔多酚低剂量组、高原+槟榔多酚中剂量组、高原+槟榔多酚高剂量组。各组大鼠按表1的方案预防灌胃给药3 d后急进青海玉树巴塘全军高原环境损伤防治重点实验室(海拔4010 m),运送途中果冻补水。抵达高原后,缺氧暴露5 d,期间继续每日按剂量给药,自由获取食水,于末次给药后1 h开始实验。平原组的大鼠与高原组同时开始实验。实验方案均通过原兰州军区兰州总医院伦理委员会批准。
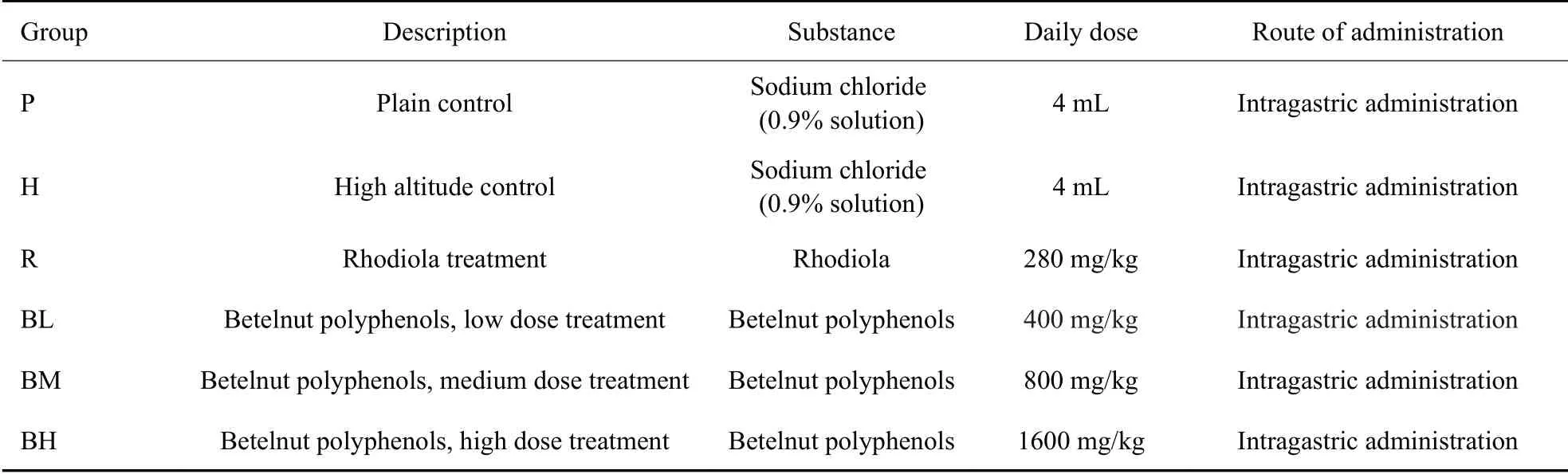
表1 实验分组和给药剂量Tab.1 Experimental groups and treatment regimens
1.5 样本采集
末次给药后1 h,大鼠通过腹腔注射10%水合氯醛麻醉,人道处死动物,进行中线剖腹术和门静脉切开术,然后剪开腹主动脉排出血液。切除心肌、肝、脑、肺组织,用冰冷的0.9%NaCl生理盐水冲洗,称重并收集。
1.6 大鼠主要组织病理切片的制备和观察
摘取大鼠的心肌、肝、肺和脑组织,用生理盐水洗净血液后,用多聚甲醛固定液固定,使组织充分展开。组织固定好后切成4 μm厚度的切片,洗涤,脱水,透明化处理,石蜡包埋,苏木精-伊红染色,脱水,树脂封片。
1.7 大鼠血气指标的测定
末次给药1 h后,腹腔注射水合氯醛麻醉实验大鼠,取其腹主动脉血,避免接触空气,立即使用血气分析仪进行检测。主要血气指标有:血液酸碱度(pH),动脉血二氧化碳分压(PaCO2),动脉血氧分压(PaO2),碳酸氢根(HCO3-),标准碳酸氢盐(SBC),动脉血氧饱和度(SatO2),氧合指数(PO2/FIO2)等。
1.8 大鼠主要组织氧化应激指标的测定
称取大鼠心肌、肝、肺和脑组织,加相应体积的生理盐水制备10%组织匀浆。用BCA试剂盒测定各组织匀浆的蛋白浓度、总SOD活力、MDA含量和GSH含量。
1.9 大鼠血清炎症因子的测定
大鼠麻醉后采血,离心后获得血清。采用蛋白质芯片技术(QAR-CYT试剂盒),分析差异表达的炎症因子。
1.10 统计学处理
使用SPSS 22.0软件进行统计学分析。结果以均数±标准差表示。采用单因素方差分析进行检验,采用LSD-t检验进行组间对比,P<0.05为差异具有统计学意义。
2 结果
2.1 槟榔多酚对高原组大鼠组织损伤的保护作用
2.1.1 心肌组织病理 P组大鼠心肌组织光滑平整,细胞排列整齐、核仁清晰,肌纤维连续、无中断,组织未出现明显损伤(图1A);H组大鼠心肌组织发生裂解现象,细胞排列中断不连续、核深染,组织出现炎性浸润,提示心肌组织出现损伤(图1B);与H组相比,预防给药槟榔多酚后,心肌细胞排列整齐、形态正常、核仁清晰、胞浆无深染,组织炎性减轻(图1D~F)。
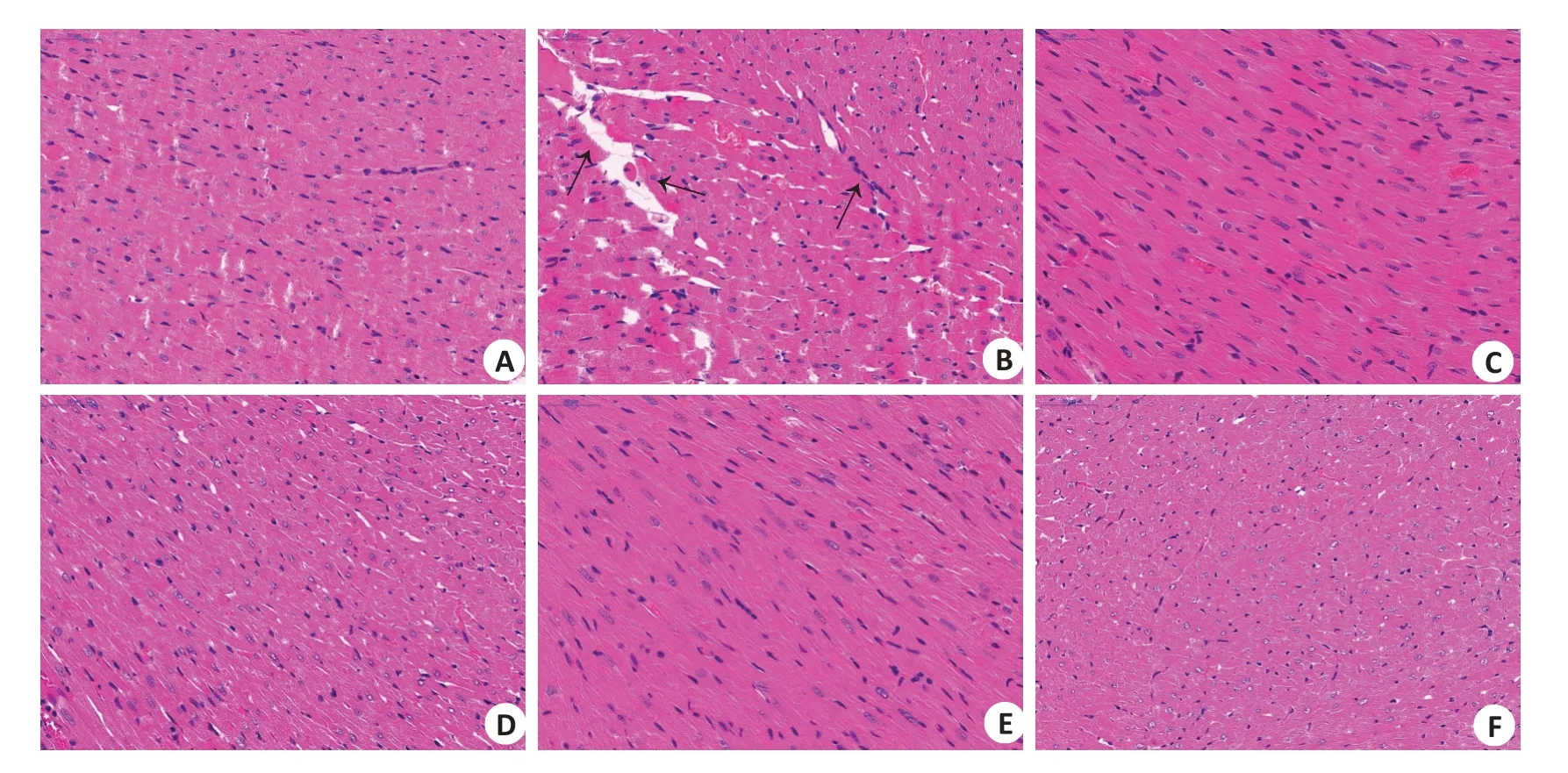
图1 大鼠心肌组织病理Fig.1 Pathological examination of cardiac muscle tissue of the rats(HE staining,original magnification:×40).A:P group.B:H group.C:R group.D:BLgroup.E:BM group.F:BH group.
2.1.2 脑组织病理 P组大鼠脑组织细胞结构正常、形态完整,细胞间隙致密无水肿,海马区细胞排列整齐,未观察到明显异常的病变(图2A);而在H组大鼠的脑组织中,能够明显观察到脑组织海马细胞排列轻微紊乱、不致密,且出现核固缩,细胞间隙明显增大,部分区域呈现水肿(图2B);BL组、BM组及BH组大鼠脑部海马细胞结构完整、排列整齐,水肿程度减轻(图2D~F)。

图2 大鼠脑组织病理Fig.2 Pathological examination of the brain tissue of the rats(HE staining,×10).A:P group.B:H group.C:R group.D:BLgroup.E:BM group.F:BH group.
2.1.3 肝组织病理 P组大鼠肝细胞未出现明显病理样变化,肝小叶结构清晰,肝细胞以中央静脉为中心呈索状排列、核结构清晰(图3A);H组的大鼠肝细胞正常索结构被破坏,中央静脉腔周围空泡样病变,出现少量灶性及点状坏死,细胞体积增大,中央静脉内皮下有轻度水肿(图3B);预防给药槟榔多酚低中剂量组大鼠肝组织空泡样变性得到有效缓解,炎症反应减轻,肝细胞正常索结构恢复,肝组织未出现明显坏死,水肿程度减轻(图3D~F)。
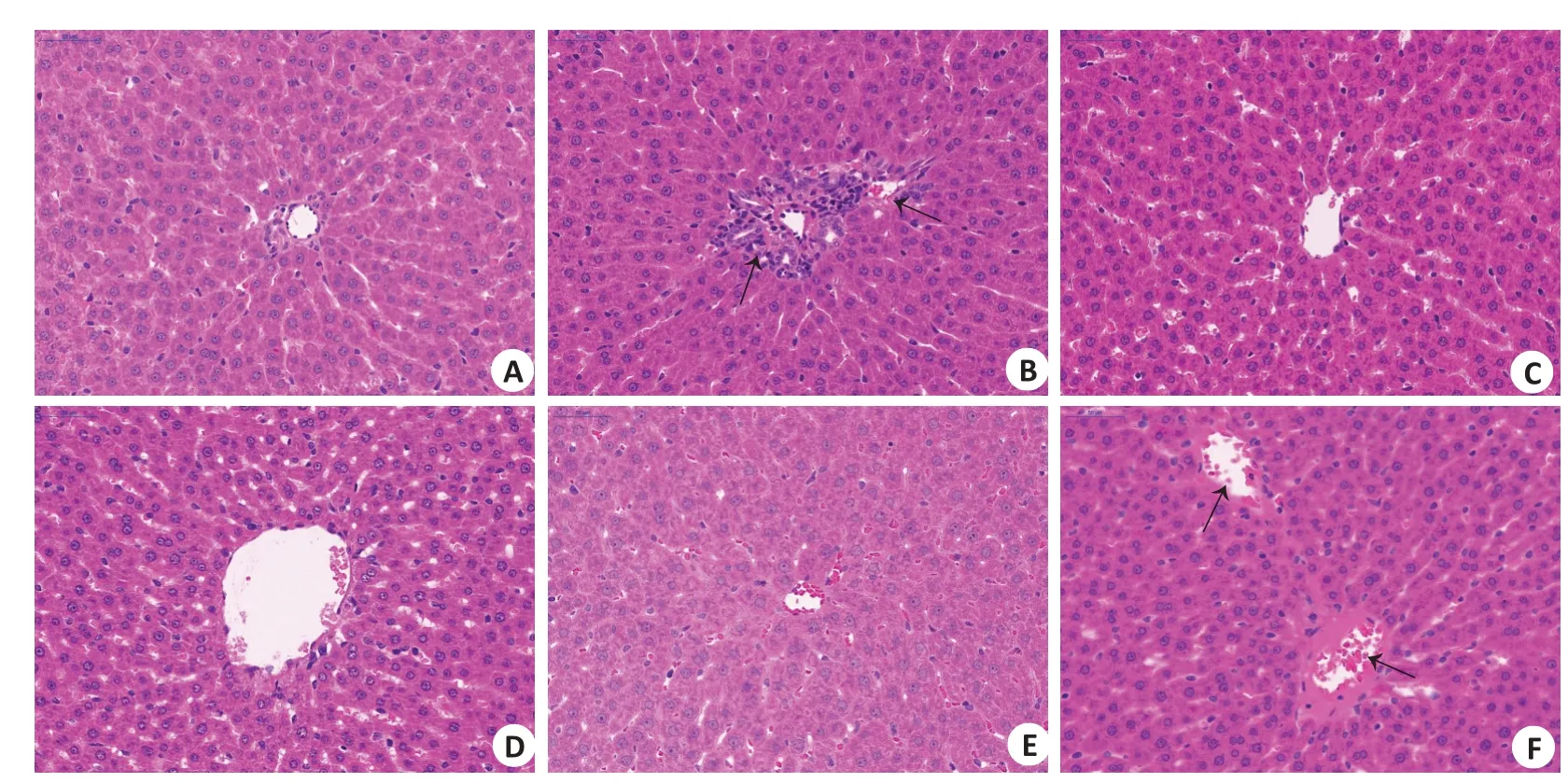
图3 大鼠肝组织病理Fig.3 Pathological examination of the liver tissue of the rats(HE staining,×40).A:P group.B:H group.C:R group.D:BLgroup.E:BM group.F:BH group.
2.1.4 肺组织病理 P组大鼠肺组织结构完整,肺泡呈空泡状薄壁结构且未见液体渗出,肺泡壁光滑,无明显病理改变(图4A);H组大鼠的肺泡结构严重被破坏,肺泡壁增厚、肺泡腔缩小,肺泡扩张及塌陷、间隔增宽,并伴有炎细胞浸润,部分区域出现液体渗出(图4B);预防给药后,大鼠的肺泡结构趋于完整,肺泡壁变薄、肺泡腔结构恢复,肺泡内液体渗出减少,炎性反应减轻,槟榔多酚低剂量组的效果更加明显(图4D~F)。
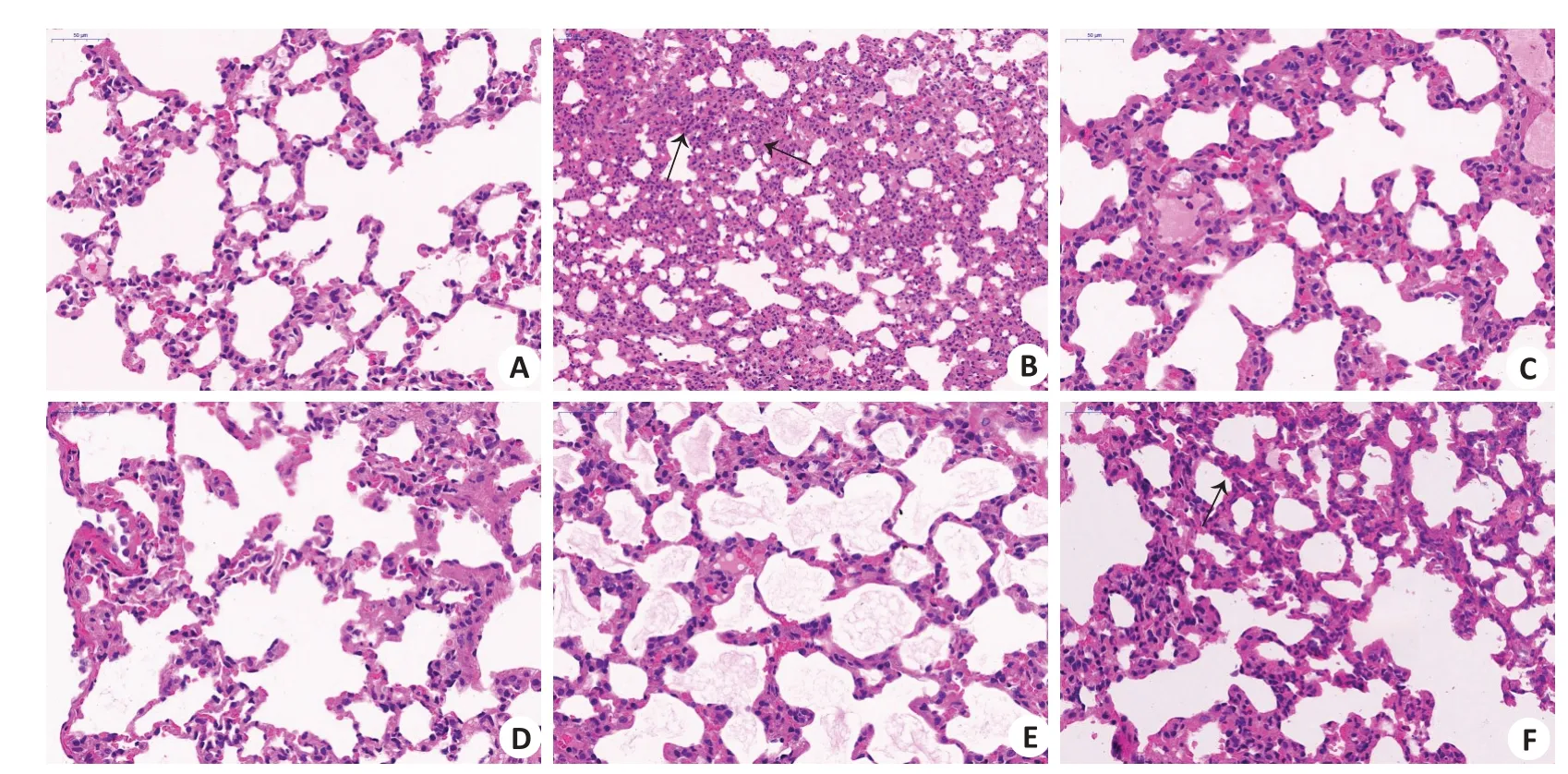
图4 大鼠肺组织病理Fig.4 Pathological of lung tissues of the rats (HE staining,×40).A:P group.B:H group.C:R group.D:BL group.E:BM group.F:BH group.
2.2 槟榔多酚不同剂量对高原缺氧大鼠血气指标的影响
与P组相比,H组大鼠的PO2/FIO2、SatO2、PaO2值降低(P<0.001,表2);同时TCO2,HCO3-,SBC也显著降低(P<0.001)。与H 组大鼠相比,R 组大鼠的SatO2、pH、SBC值显著提高(P=0.01,P=0.05,P=0.03),PaCO2值显著降低(P<0.01)。相比于H组,BM组大鼠SatO2、pH、SBC均增加(P=0.02,P=0.01,P=0.02),PaCO2值显著降低(P=0.03),BH 组大鼠的SatO2、pH、SBC 增加(P=0.03,P=0.01,P=0.01),PaCO2值显著降低(P=0.02),而BL组无显著性改善(P>0.05)。
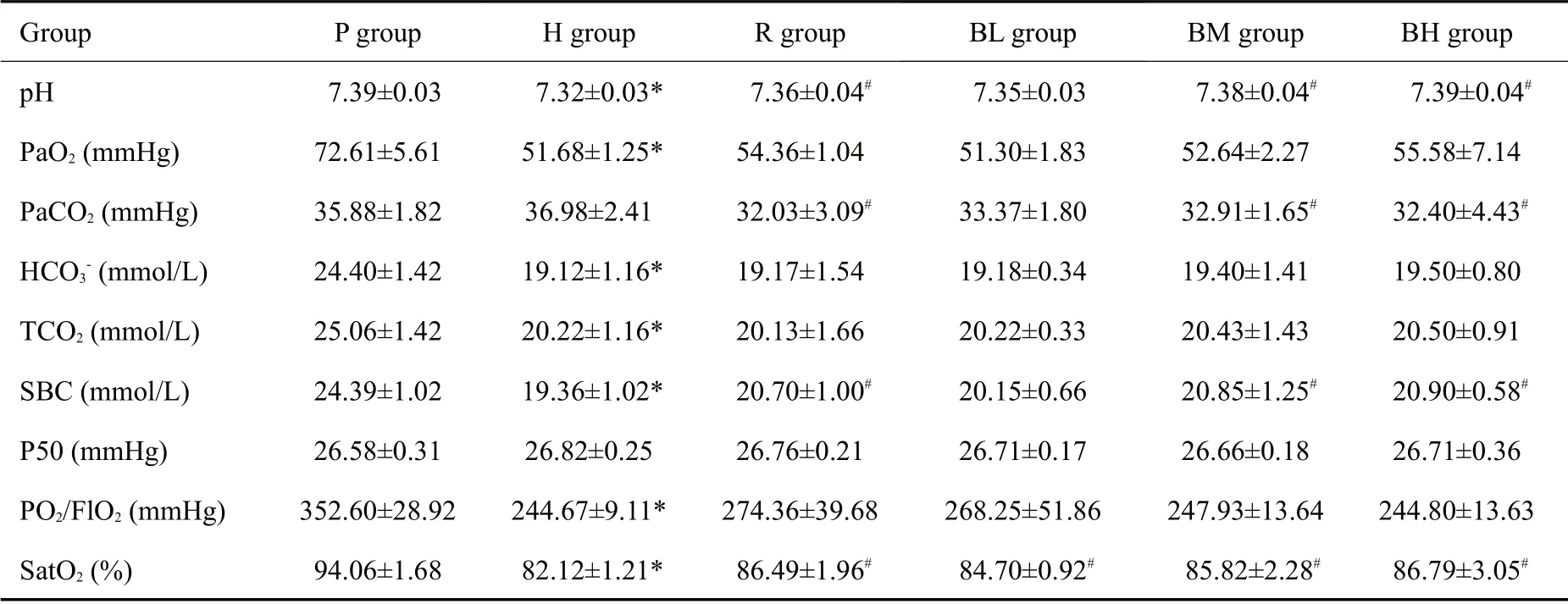
表2 各组大鼠血气指标分析Tab.2 Results of blood gas analysis in different groups(Mean±SD,n=6)
2.3 槟榔多酚不同剂量对高原缺氧大鼠各组织氧化应激指标的影响
与P组相比,H组大鼠的肝、肺组织中的MDA含量显著升高(P<0.001,图5),心肌组织中MDA含量升高了1.44 倍(P=0.03),脑组织中的MDA 含量有升高趋势,但其差异不具有统计学意义(P>0.05)。与H组比较,R组大鼠心肌和脑组织中MDA含量降低(P=0.05,P=0.02)。BL、BM及BH组大鼠心肌组织MDA含量均降低(P=0.04,P=0.03,P=0.04);BL、BM及BH组大鼠肝组织中的MDA含量降低(P=0.006,P=0.002,P<0.001)。
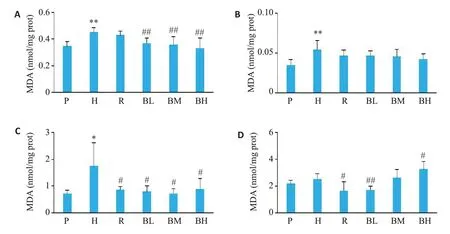
图5 各组大鼠组织MDA含量Fig.5 MDA content in rats in different groups(Mean±SD,n=6).A:Liver tissue;B:Lung tissue;C:Cardiac muscle.D:Brain tissue.*P<0.05,**P<0.01 vs P group;#P<0.05,##P<0.01 vs H group.
相比于P组,H组大鼠的肝、肺、心肌及脑组织中的SOD 活力显著降低(P=0.01,P=0.001,P=0.005,P=0.004,图6)。与H组相比,R组大鼠脑组织中SOD活力显著升高(P=0.02)。BL 组大鼠肝、肺和脑组织中的SOD 活力均显著升高(P=0.003,P=0.006,P=0.001);BM组大鼠肝、肺和脑组织中的SOD活力显著升高(P=0.004,P=0.005,P<0.001);BH组大鼠肝、肺组织的SOD活力分别显著增加(P=0.03,P=0.02)。

图6 各组大鼠组织SOD活力Fig.6 SOD activity in rats at different groups(Mean±SD,n=6).A:Liver tissue;B:Lung tissue;C:Cardiac muscle.D:Brain tissue.*P<0.05,**P<0.01 vs P group,#P<0.05,##P<0.01 vs H group.
与P组相比,H组大鼠肝、肺和心肌组织中的GSH含量均降低(P=0.03,P=0.007,图7)。与H组比较,R组大鼠的肺组织的GSH 含量显著升高(P=0.02);BL 和BM 组大鼠肝组织中的GSH 含量增加(P=0.03,P=0.01);BL 组大鼠肺组织中GSH 含量显著升高(P=0.02);而在脑组织中,GSH含量的变化无统计学意义(P>0.05)。

图7 各组大鼠组织GSH含量Fig.7 Results of GSH content in rats in different groups(Mean±SD,n=6).A:Liver tissue;B:Lung issue;C:Cardiac muscle.D:Brain tissue.*P<0.05,**P<0.01 vs P group.#P<0.05,##P<0.01 vs H group.
2.4 槟榔多酚不同剂量对高原缺氧大鼠血清炎症因子的影响
通过蛋白质芯片技术的筛选,发现大鼠缺氧后,血清有4种蛋白质因子出现差异性表达。与平原组相比,大鼠缺氧后,血清中MCP-1、TIMP-1、ICAM-1、L-Selectin水平升高(图8)。与缺氧模型组比较,给予大鼠红景天胶囊后,血清中的MCP-1、ICAM-1、L-Selectin含量降低(P<0.01);槟榔多酚低剂量组大鼠的MCP-1、ICAM-1、L-Selectin 降低(P<0.05);槟榔多酚中剂量组的大鼠MCP-1、TIMP-1、ICAM-1、L-Selectin 含量降低(P<0.05);槟榔多酚高剂量组的大鼠ICAM-1、L-Selectin含量降低(P=0.02)。
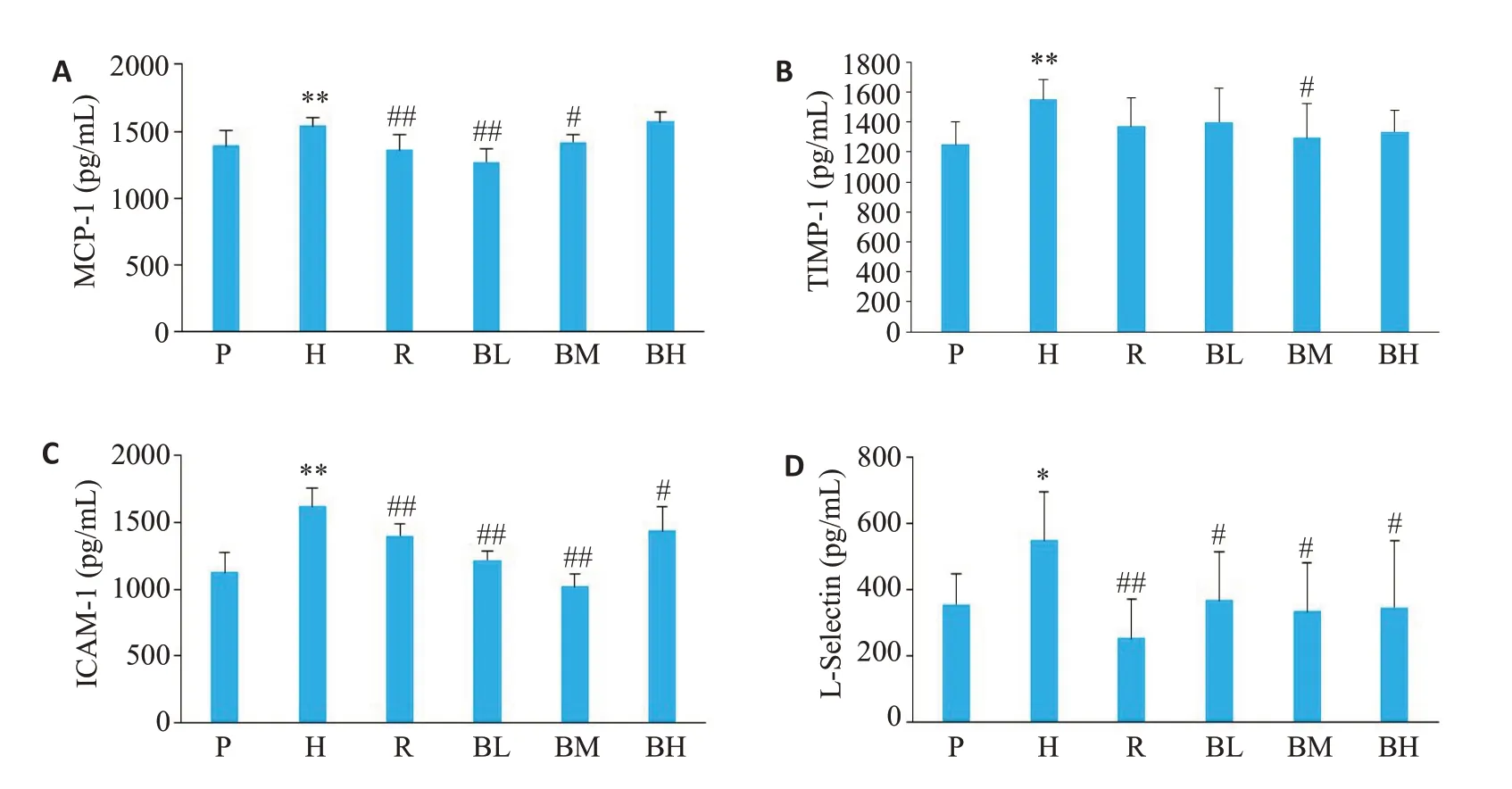
图8 各组大鼠血清炎症因子含量Fig.8 Serum levels of cytokines in different groups(Mean±SD,n=6).A:MCP-1.B:TIMP-1.C:ICAM-1.D:L-Selectin.*P<0.05,**P<0.01 vs P group.#P<0.05,##P<0.01 vs H group.
3 讨论
高原环境主要有低氧分压、低气压、寒冷干燥、紫外线强等特点,其中氧分压低对于机体的影响最显著[18]。人体在短时间内急进高原,会出现呼吸急促、头痛、厌食、睡眠障碍等症状,若不及时缓解,可能会发展为更严重的高原肺水肿和高原脑水肿[19]。本实验在高原实地建立了大鼠高原缺氧损伤模型,通过观察大鼠各脏器病理变化,测定大鼠动脉血气,各组织氧化应激指标,血清炎症因子变化,验证了槟榔多酚对预防大鼠高原损伤具有明显的效果。
本研究发现大鼠在高原条件下缺氧暴露后,主要组织出现了明显损伤:心肌细胞排列不连续,核深染,心肌组织裂解,出现炎性细胞浸润;脑组织细胞出现核固缩,海马细胞排列轻微紊乱;肝细胞索结构被破坏,中央静脉腔周围出现空泡样病变,细胞体积增大,可见少量灶性及点状坏死,中央静脉内皮下有轻度水肿;肺泡壁增厚,肺泡腔缩小,肺泡扩张,肺泡塌陷,间隔增宽,并伴有炎细胞浸润。预防给药槟榔多酚可以缓解这种损伤,表明槟榔多酚对高原缺氧所致的损伤具有保护作用。
高原条件具有低氧分压的特点,在高原环境中机体氧气量摄入量减少,血气指标相应发生变化,全身组织器官的摄氧量也随之受到不同程度的影响。血气指标的变化通常可以用来反应机体的酸碱平衡以及缺氧程度[20-21]。本实验结果表明,大鼠急进高原后,动脉血中SatO2、PO2/FIO2、PaO2等指标明显降低,提示急进高原后,缺氧会导致机体氧合不足,可能出现低氧血症;而HCO3-含量的降低,指示机体出现呼吸性碱中毒合并代谢性酸中毒。在预防给药槟榔多酚后,高原缺氧大鼠的SatO2明显上升,表明槟榔多酚能明显改善高原缺氧大鼠的低氧血症。
高原缺氧损伤是多因素、多机制的,缺氧会导致机体重要脏器缺氧缺血,影响机体供能,发生自由基代谢平衡失调等一系列氧化应激反应[22]。机体内自由基的生成与清除之间存在动态平衡,这种平衡主要通过以超氧化物歧化酶(SOD)[23]、谷胱甘肽过氧化氢酶(GSH-Px)[24]为主的酶系统来维持[25]。随着机体暴露于缺氧条件下的时间的延长,自由基会在体内堆积,从而产生细胞毒性,引起脂质过氧化损伤。由于自由基与脂质的过氧化反应终产物是MDA,通常可用MDA含量来评价组织膜系统的损伤程度[25-26]。由实验结果可知,预防给药槟榔多酚后,大鼠主要组织中的SOD活力和GSH含量升高,MDA水平降低(相较于高原缺氧大鼠),有效缓解了机体缺氧条件下的氧化应激损伤,证明槟榔多酚对高原缺氧环境下大鼠主要组织有明显的保护作用。
炎症反应是一种典型的缺氧损伤特征,一系列炎症因子参与了高原缺氧损伤的发病机制[27]。本实验筛选出了4种在高原缺氧环境下差异性表达的炎症因子,即TIMP-1、ICAM-1、MCP-1、L-Selectin。实验结果表明,缺氧大鼠血清内,炎性因子TIMP-1、ICAM-1、MCP-1、L-Selectin水平明显增多。血管通透性增加、血管收缩舒张失衡是急性高原病的重要机制。炎症介质是血管通透性增加、血管收缩舒张失衡的重要调节因素,缺氧大鼠血清内的细胞粘附分子ICAM-1、L-Selectin水平升高。而在给予大鼠槟榔多酚后,大鼠血清内的炎症因子含量较缺氧组降低,炎症反应得到有效缓解。
本研究优化了槟榔多酚的提取纯化方法,使多酚含量达到45.03%。并在海拔4010 m的高原实地评价了槟榔多酚对高原缺氧损伤的保护作用,能够真实反映高原复杂环境导致的机体损伤。实验发现在高原缺氧条件下,血清中的炎症因子TIMP-1、ICAM-1、MCP-1、LSelectin显著性升高,有望进行进一步的研究。本实验发现急进高原的大鼠出现低氧血症,心肌、肝、肺和脑组织出现不同程度氧化应激损伤。而预防给药槟榔多酚后,血氧饱和度显著升高,低氧血症得到有效的缓解;主要组织氧化应激损伤减轻,炎症反应缓解,病理损伤得到明显改善。表明预防给药槟榔多酚400 mg/kg和800 mg/kg均具有显著的抗高原缺氧的作用。
综上所述,本研究建立了急进高原实地大鼠缺氧损伤模型,通过大鼠动脉血气,血清炎症因子水平,肝、肺、脑和心肌组织的病理变化,各组织氧化应激指标,来探究预防给药不同剂量的槟榔多酚对高原缺氧大鼠保护作用。研究结果表明,槟榔多酚能显著改善高原环境中大鼠的血气状况,减轻机体炎症反应,减轻氧化应激损伤,对大鼠各组织器官有明显的的保护作用。槟榔多酚具有抗高原缺氧的活性,并对急进高原大鼠的各脏器具有保护作用,可能是通过提升机体抗氧化能力,减轻机体炎症反应来发挥其抗高原缺氧。