水稻耐热性评价方法研究进展
王伍梅 王辉 杜士云

摘要 在全球气候变暖的趋势下,高温热害现象已经成为制约水稻高产、稳产主要气象灾害之一。操作简单、使用方便、有效、可重复性好的水稻耐热性评价方法是开展水稻耐热种质资源筛选与创制、培育耐热水稻新品种、解析水稻耐热性状分子遗传机制的关键。介绍了水稻高温热害的形成机理、评价方法,以及前人在不同热处理条件下开展的水稻耐热性QTL研究,以期为开展水稻耐热性相关研究,解决气候变暖大趋势下水稻高温热害问题提供参考。
关键词水稻;耐热;评价方法;数量性状位点
中图分类号 S511文献标识码 A
文章编号 0517-6611(2021)10-0020-08
doi:10.3969/j.issn.0517-6611.2021.10.006
开放科学(资源服务)标识码(OSID):
Research Progress on the Methods for Evaluating Heat Tolerance in Rice
WANG Wu-mei,WANG Hui,DU Shi-yun (Key Laboratory of Rice Genetics and Breeding of Anhui Province,Rice Research Institute,Anhui Academy of Agricultural Sciences,Hefei,Anhui 230031)
Abstract As global temperature increased,heat disaster has become one of the main meteorological disasters which restrict the high and stable yield of rice.A simple,convenient,effective and repeatable method for evaluating heat tolerance in rice is the key to screen new germplasm resources and breed new varieties for heat tolerance in rice,and also to study the molecular genetic mechanism of heat tolerance in rice.This review introduced the mechanism of heat injury in rice and the methods for evaluation heat tolerance of rice,and QTL for heat tolerance reported by the previous studies based on different heat treatment conditions,with a purpose of being conducive to dealing with the challenge of heat damage to rice under the trend of global warming.
Key words Rice (Oryza sativa);Heat tolerance;Evaluation methods;Quantitative trait locus
在全球气候变暖的大环境下,极端高温天气频繁发生,近年来其强度、持续时间和发生频率均呈上升趋势。2013年,中国部分水稻主产区夏季35 ℃以上高温天气次数高达30~40,多个地区温度突破40 ℃[1-2]。高温热害已经成为制约水稻、玉米等重要农作物高产稳产的主要气象灾害之一,严重威胁世界粮食安全[3]。IPCC第五次报告预估未来100 a全球地表温度仍将继续保持上升的趋势[4],这预示着农作物遭受高温的危害将会越来越严重。在中国,高温热害问题已经引起了政府、粮食生产经营者和科技人员的广泛重视。
水稻是中国第二大粮食作物,年种植面积稳定在0.3亿hm2,约占粮食作物总种植面积的27.3%[5]。长江流域沿线地区是中国主要水稻种植生产区域之一,也是高温热害发生的重灾害区。单季中稻在7月下旬和8月上旬经历抽穗扬花、灌浆结实过程,频繁遭遇高温热害侵袭[6-8]。1978年夏季,高温热害使得四川、湖北2省部分水稻品种结实率降至50%以下,有的品种甚至降至10%[8-9],该事件发生以后,中国政府、水稻科技工作者高度重视高温热害在杂交稻推广应用过程中的不利影响。1994年,长江流域沿线地区再次发生高温热害事件,使得在湖北、四川等省推广应用的高产杂交稻品种 Ⅱ 优63等严重不实,几乎颗粒无收,即使是较耐高温的三系杂交稻品种汕优63,结实率也降至约40%[8]。2003年夏季发生的高温热害事件是有文献记载最严重的1次,持续时间和强度均刷新了历史纪录,沿线的中稻几乎均因此而减产,使得当年全国稻谷产量降至近20年来的最低点[8,10]。保守估计,长江流域当年水稻受灾面积达3×107 hm2,产量损失达5.18×107t[8],位于长江下游的安徽省,受灾面积3.3×105 hm2,产量损失达1.28×106 t[11-13]。其后,安徽、江苏在2013、2016年又发生了2次严重的高温热害事件[14-22]。在南亚及东南亚国家,如巴基斯坦、印度、孟加拉国、泰国、苏丹以及非洲部分地区区域性高温热害也频繁发生[23-25]。
水稻起源于热带或亚热帶地区,是一种性喜高温高湿的植物,在生长发育过程中需要经历一定的高温期才能顺利地开花自交,进而完成整个生命周期。但是,在水稻孕穗后期至抽穗开花期遇到持续高温天气时,颖花浆片不能正常吸水膨胀打开,水稻雄蕊严重失水,花药开裂受阻,花粉活力及其在雌蕊柱头上的萌发率均降低,花粉管伸长停止,受精过程失败而形成空粒,最终导致减产[26],该现象在水稻生产上称之为高温热害。水稻对高温热害的反应与遗传因素有关,是多基因控制的数量性状,不同品种结实率降至50%的临界温度相差2~6 ℃[26-28]。不同类型水稻的耐高温能力亦存在明显差异,一般情况下杂交稻比常规稻对高温更为敏感,受害范围广且更严重,两系杂交稻耐高温性强于三系杂交稻,籼稻的耐高温性强于粳稻[29-30]。鉴于此,笔者综述了水稻幼苗期和开花期耐受热害能力的评价方法,以及以耐热能力为表型指标开展的QTL定位研究进展,以期为水稻耐热种质资源筛选与创制、解析水稻耐热性状分子遗传机制、应对全球气候变暖大趋势下水稻高温热害问题提供参考。
1 水稻高温热害形成机理
1.1 水稻高温敏感时期
相对于营养生长期,生殖生长期水稻对高温反应更为敏感,其中开花期是最敏感的生育阶段,异常高温直接影响花药开裂、花粉活力及后续受精过程,其次是孕穗期,即开花前9~12 d[27,30],高温导致花粉数量减少、活力降低[31-36]。灌浆期是水稻产量和品质形成的关键时期,高温造成籽粒的充实度差,甚至产生秕粒,降低籽粒的千粒重[37];另一方面,在异常高温情况下,籽粒灌浆速率加快,时间变短,稻米产生垩白,品质降低[38]。在水稻生产上,普遍定义的高温热害是指在孕穗后期至抽穗扬花期遭遇异常高温天气造成结实率及产量降低的现象。
1.2 开花期高温热害生理机制
综合分析前人研究结论[27,36,39-54],开花期高温导致水稻结实率降低的原因主要有以下4个方面:①高温往往伴随低湿,在这种环境下,颖花基部的浆片吸水膨胀受到抑制,导致不能正常打开,造成不开花;②高温造成花药失水过快而不能正常开裂,释放花粉,这是导致开花期高温不育的主要原因;③高温环境下,花粉活力低、寿命缩短,受精成功的概率低。正常情况下花粉暴露在空气中的寿命只有5min左右,高温下花粉寿命大大缩短,43 ℃条件下持续5min可以将籼稻花粉完全杀死;④高温抑制花粉管伸长。花粉在雌蕊柱头上萌发,经一系列生理生化反应形成花粉管,并延伸至胚囊,花粉通过花粉管到达胚囊与胚珠结合完成受精,高温抑制花粉管伸长,导致受精失败。
2 水稻耐热性评价方法
2.1 室外自然高温条件下耐热评价
在高温易发地区,如江西南昌(28°10′N,115°27′E)[55]、湖南长沙(28°10′N,113°E)[56-57]、古巴、巴基斯坦、坦桑尼亚等[58],利用室外自然高温天气条件,对水稻材料耐热性进行评价。该方法的优点是可以结合当地气候,筛选出适合当地种植的耐热水稻品种,且不受场地限制,可以大批量进行品种筛选与评价。此外,鉴于水稻耐热性状的复杂性,无论用何种方法筛选出的耐热品系,均需要经历田间自然高温条件验证,确定材料的耐热能力。该方法的缺点是试验成功与否依赖于当地高温发生期的强度、持续时间,而这些因素在年际间差异较大,试验条件重复性差,甚至在一些年份高温天气条件达不到热害评价要求,因而试验结果的重复性较差。
2.2 室内人工气候室模拟室外高温条件下耐热评价
在室内设置温度、光照、湿度等模拟室外高温发生时的气候条件,将在盆栽或水培条件下生长的水稻材料放置室内经受高温处理一段时间,考察在处理条件与对照条件下的表型差异,评价材料的耐热性。该方法弥补了室外自然条件下高温处理强度可能不足的弊端,且处理条件较为一致,缺点是生长室内人为设定的高温环境与自然发生的高温环境存在较大差异,评价结果不能完全反映田间种植条件下的耐热性;另一方面,目前的技术难以使生长室内温度、光照、湿度等达到均匀,存在微环境对试验结果的影响;此外,受场地、费用成本的限制,难以实现高通量鉴定。
2.3 幼苗期室内耐热性评价
水稻幼苗在盆栽或水培条件下培养至约15 d大小,在生长室内设置高温条件,处理一段时间后,观测黄叶、叶面积、叶尖枯、全叶枯、死叶等叶部形态指标,判定耐热等级,并测定地上和地下部分鲜重和干重,综合评价水稻材料的耐热性。该方法的优点是简单、快速,一次可以测定几百株材料。然而,幼苗期耐热性评价结论是否具有实践应用价值,取决于试验结果与田间自然高温条件下评价结果的相关性。试验表明,在幼苗期和开花期分别经历模拟室外高温气候条件处理得出的耐热性评价结果,与田间自然高温条件下的试验结果,三者之间具有较高的相关性,室内鉴定出的耐热材料中70%在田间自然高温气候条件下表现出良好的耐热性,可以作为水稻育种群体耐热品系的预筛选[58]。水稻苗期耐高温评价试验的关键点在于高温胁迫处理强度,包括处理温度和持续时间,以及品种耐热值的评价方法等。以下介绍3个代表性研究机构所使用的方法:
(1)浙江大学周伟辉等[59]使用的方法是从沙土育苗圃中选取长势基本一致,大小为15 d的幼苗,放入5 mL 盛有Yoshida培養液[60]的离心管,每管放2株,在生长室内43 ℃/30 ℃温度(白天/黑夜,14 h/10 h)、相对湿度为75% 的条件下处理 7 d,对照温度设定为30 ℃/25 ℃(白天/黑夜,14 h/10 h),试验设置3个重复。处理结束后测定叶片SPAD、根长、株高、地上部分鲜重、地上部分干重、根鲜重和根干重7项指标。7项指标在处理条件下相对对照条件下的降低值的加权平均作为耐热值,试验结果表明,该方法能够明显地区分水稻耐热品种与热敏感品种。
(2)国际水稻研究所使用的方法[58]是设置耐热型(N22)、中等耐热型(IR64)、热敏感型(IR52和WAB 56-104)对照,在水培和盆栽条件下,15 d幼苗经45 ℃/28 ℃(白天/黑夜)温度处理,水培条件下每天高温处理14 h,盆栽条件下每天高温处理6 h,相对湿度均为80%,处理4~6 d,对照条件设定为温度28 ℃/20 ℃(白天/黑夜,16 h/8 h),相对湿度为70%,每份材料50~100个单株。处理结束后观测叶片发黄、叶面积减少、叶尖枯、整体叶枯和叶片死亡情况,按表1描述评价水稻材料耐热值,并测定地上部分与地下部分干重、鲜重、长度,按公式:胁迫指数=(处理值/对照值)×100,计算胁迫指数。
(3)中国国家科学院上海植物生理生态研究所植物分子遗传国家重点实验室Li等[61]采用的方法是将萌发的水稻种子放入去底96孔PCR板,然后将PCR板架在盛有Yoshida培养液[60]的容器上,保持种子处于半浸没状态,12 d后(2叶期),在恒温光照培养箱中设定温度45 ℃,相对湿度80%下处理52 h后放回28 ℃环境,7 d后按公式恢复率=(恢复活力的幼苗数/总幼苗数)×100计算恢复率。利用该方法,通过图位克隆的方式,成功地克隆了在幼苗期具有耐受高温能力QTL TT1,表明该方法具有可靠性、重复性,操作流程亦较为简单。
2.5 开花期水稻耐热性室内鉴定
生长室内处理条件的设定以及设备性能的稳定性是水稻开花期耐热性鉴定实验成功与否的关键,其中处理温度和持续时间是2个重要因素。在水稻生殖期,最适合的生长温度在25~30 ℃,33 ℃是正常开花受精的最高温度,≥33.7 ℃ 持续1 h足以导致不育[27,62]。Tenorio等[63]认为37 ℃是大多数水稻品种的临界值,38 ℃水稻开花期耐热鉴定的有效温度。然而,近年中国长江中下游沿线水稻种植区域气象数据和水稻生产实践表明,35 ℃温度持续3~4 d对水稻伤害是很有限的,在中国湖北省、印度安得拉邦沿海地区,在水稻生长季节白天的温度可达到50 ℃[64]。另一方面,由于蒸腾作用,能量反射、传递、消散等因素,水稻植株温度不仅取决于空气温度、湿度等外部因素,而且受器官的位置、大小、形状、表面积和植株形态的影响,Zhang等[65]研究表明外界空气温度为40 ℃时,剑叶与穗温度分别为38和34 ℃,因此,有研究者提出利用植株器官温度,而非空气温度描述热害[66]。目前,在水稻开花期耐热性鉴定实验中,用室内空气的温度值描述热处理强度,温度值的选择没有统一的标准,多数研究者未考虑颖花位置对试验结果的影响。关于热处理时间,根据水稻开花习性,在每天的盛花期,花药从颖壳中露出在空气中停留约30 min[67],花粉从开裂的花药散出到空气中存活时间约为10 min[68],花粉落入雌蕊柱头后产生一系列生理生化反应形成花粉管,通过花粉管到达胚囊完成受精过程大约需要30 min[69],由此看来,理论上讲,自花药从颖花中露出始,其后约1.5 h对水稻是否能够成功完成受精过程至关重要[23,69]。Jagadish等[62]研究认为,高温下≤1 h足以导致不育,时间越长,经历≥1 h高温环境的颖花数越多,结实率降低程度越大。
目前,水稻开花期耐热性室内鉴定试验普遍流程是:①水稻种子经处理打破休眠、浸种萌发、催芽后,播种在育苗基质上,20 d左右将幼苗移栽至盛有营养土的桶或盒内,或采取水培的方式在温室内生长至开花期;②花药初现时,将植株移入智能光照培养箱或生长室进行高温处理;③高温处理时间结束后,将植株移回温室,继续生长至成熟期;④考察高温处理期开花的颖花结实率。
Jagadish等[62-63,70]和Ishimaru等[71]使用的方法是将4~6粒将浸种萌发、催芽的水稻种子直接播种在盛有灭菌沙、砾石泥炭堆肥和蛭石混合无土培养基的桶中(直径12.5 cm),在三叶期,每只桶内仅保留1株生长健康的秧苗,在颖花露出之前的生长过程,用营养液浇灌,植株仅保留3个分蘖。将花药初现植株,在即将到达水稻盛花期时(黎明后约2 h)移入温度为38 ℃,湿度为70%的生长室,2 h后將植株移回温室。用红色的记号笔标记在生长室内开放的颖花,用蓝色记号笔标记移入生长室前和移回温室后开放的颖花,在晚上小心减去标记为蓝色的颖花,处理时间仅1 d。处理结束后10~12 d,统计标记红色的颖花受精成功和失败的数目。这种方法优点是能够有效地排除在处理期之外开花的颖花对试验结果的影响,缺点是人为排除株型在理论上会对试验结果产生影响,另一方面,优势颖花与劣势颖花的选取对试验结果产生影响,因为根据Fu等[72]研究表明优势颖花表面温度比劣势颖花温度高4 ℃。
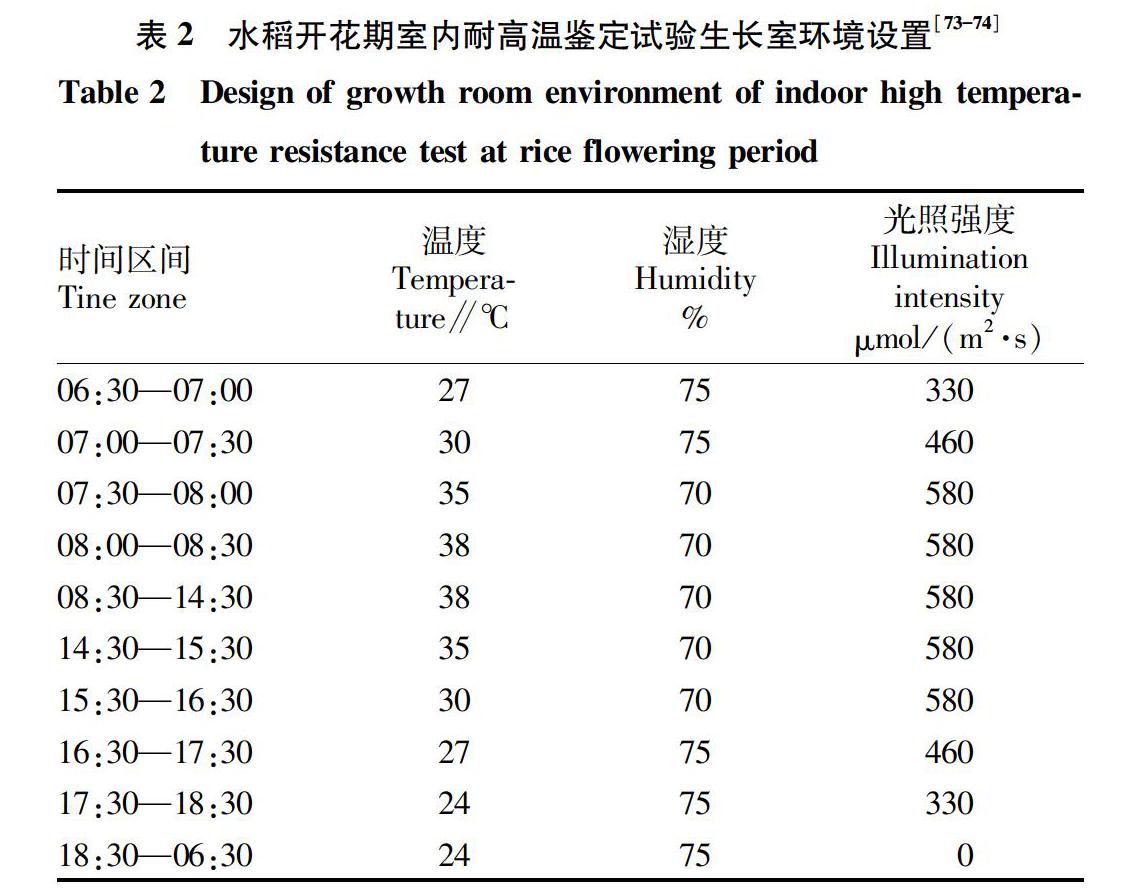
Ye等[73-74]使用的方法是将21 d大小的水稻幼苗移栽至盛有自然粘土的桶内(Φ11.5×16.5 cm),生长至开始抽穗,标记前3个抽穗的分蘖,将植株移入生长室,动态控制室内温度、湿度及光照条件(表2),3个标记穗上颖花全部开花后(约14 d),将植株移回温室继续生长至成熟期,统计3个标记穗实粒数和空粒数,计算结实率,以处理植株的结实率作为耐热能力的评价指标。他们用该方法对亲本IR64和N22杂交衍生的后代群体进行耐热性表型评价,开展QTL定位研究,主效QTL在不同类型群体中能够重复检测到,表明该方法重复性好,评价结果可靠。值得注意的是,为避免桶内的植株分蘖过于拥挤,另一方面,也是为了水稻花期与高温期尽量重合,避免未经高温胁迫处理的颖花影响评价结果的准确性,他们的处理方式是仅考察主茎穗和2个分蘖穗,剪掉其他分蘖穗,陈庆全等[75-77]采取了相似的处理方式。Tenori等[64]利用这种方法从200份水稻材料中筛选出28份耐热材料,经过验证,23份材料可以用于耐热性种质资源创制的供体,再次证明了该方法的有效性和可靠性。此外,还得出38 ℃适合于水稻开花期耐高温性评价,39 ℃适合于水稻材料苗期耐高温筛选的结论。
隶属于联合国粮农组织/原子能机构粮食与农业核技术联合司的植物育种与遗传部2018年发布的《水稻耐高温突变体田间试验前室内筛选操作手册》介绍了一种操作简单、重复性好、结果可靠的水稻营养生长期和开花期耐热性评价方法[58]。该试验中,设置耐热型(N22)、中等耐热型(IR64)、热敏感型(IR52和WAB 56-104)对照材料,水稻幼苗在28~30 ℃/20 ℃玻璃温室培育6~8 d后,移栽至盛有土壤的盒子或水培装置[78],生长至开花期。花药初现时,用记号笔标记主茎穗后,将植株移栽至生长室进行高温处理,并标记高温处理期间开放的颖花,处理结束后将植株移回玻璃温室,成熟时统计标记颖花的结实率,以玻璃温室内生长的植株结实率为对照,结实率下降65%以上为高感,25%~65%为中间类型,25%以下为高抗型。研究人员优化了生长室内高温处理条件,认为3组处理条件对耐热性筛选最有效:①39 ℃处理4 d、每天6 h、相对湿度80%;②35 ℃处理6 d、每天6 h、相对湿度80%;③38 ℃处理5 d、每天4 h、相对湿度80%。
3 水稻耐热性评价指标
水稻的耐热性通常表述为在异常高温环境下的农艺性状相对于在适宜的生长条件下表现出的差异。结实率在高温处理条件下的下降程度是水稻最敏感、最直接的形态指标。室外自然高温条件鉴定,往往将供试水稻材料在高温易发地区的结实率,即绝对结实率作为耐热性评价指标,而在一些耐热性QTL定位研究中,常用高温处理条件相对于对照条件下的结实率差异,即相对结实率作为表型性状[76,79-83]。Jagadish等[70]认为,对照条件下结实率与高温条件下的结实率没有相关性,2种环境条件下也没检测到共同QTL,因此强烈建议用高温处理下的结实率,即绝对结实率作为水稻材料耐热性评价指标。Cheng等[84]在秀水09与IR2061-520-6-9构建的渗入系群体中检测到4个QTL,以结实率为表型数据,qSF5和qSF11在正常生长条件下能够检测到,但在热胁迫处理条件下不能检测到,而qSF4和qSF6在热胁迫处理条件检测到,而在正常生长条件下不能够检测到,再次证实了Jagadish等观点。理论上,只有在热胁迫诱导条件下产生的QTL才与水稻热应激反应机制相关,才能够降低热胁迫处理与正常生长条件下表型差异,有助于性状在2种环境下的稳定性,赋予水稻材料耐热属性。
4 水稻开花期耐热性分子遗传研究进展
4.1 水稻开花期耐热材料
水稻材料对高温热害的敏感性存在广泛的变异,大多数遗传是加性的,具有较高的遗传力[26],其详细的遗传机制目前知之甚少。依据水稻材料对高温处理的反应,可以很明显地划分为敏感型、耐热型和中间型[71]。在籼型和粳型群体中均发现了对高温热害具有较好耐性的水稻材料,如起源于印度Aus型水稻材料N22是迄今为止鉴定的最耐干旱和热害的水稻材料[26-27,50,63,70,86-87],常被用于水稻耐热性评价试验的耐热型对照材料[64],其EMS突变体NH219具有更强的耐受高温热害能力[88]。来源于日本的粳型水稻材料Akitakomachi在抽穗期40 ℃温度条件下连续处理6 d,每天6 h,结实率仍然可以达到50.3%,日本晴在相同的试验条件下结实率为35.0%,均表现出较强的耐热性,在同样的处理条件下,敏感型材料 minamihikari和Hinohikari结实率分别为19.2%和13.7%[45]。除此之外,印度籼型水稻材料Dular,中国籼型恢复系明恢63、996、T219亦具有较好的耐热能力[76,89-90]。
4.2 水稻开花期耐热性QTL定位
水稻在幼苗期、孕穗-开花期、灌浆-成熟期耐热性QTL定位有较多的报道,这些QTL分布于水稻每条染色体。Li等[61]利用非洲稻(Oryza glaberrima)克隆了在幼苗期具有耐受高温能力QTL TT1,TT1编码一个具有泛素化蛋白降解功能的26S蛋白酶体α2亚单元。泛素组分析表明,与OsTT1相比,OgTT1能够更有效地消除细胞毒性变性蛋白,维持热应答过程,保护细胞免受热激伤害。在水稻进化中,TT1的变异选择具有明显的气候温度变迁和地域适应性。Xu等[91]从粳稻KY131突变体库中分离鉴定SLG1基因,编码2-巯基蛋白2 (RCTU 2),修饰tRNA,在水稻幼苗期和生殖生长期高温胁迫反应中起关键作用。在亚洲栽培稻中,籼稻和粳稻SLG1基因在启动子区和编码区都存在差异,这种差异导致了亚洲栽培稻品种的巯基化tRNA水平升高,耐热性增强,SLG1等位基因分化使籼稻具有高温耐性,tRNA硫代途径可能是下一代应对全球变暖地区水稻育种的潜在目标。目前,利用鉴定的具有耐热性的遗传资源或QTL提高水稻品种的耐受热害能力的研究少有报道。
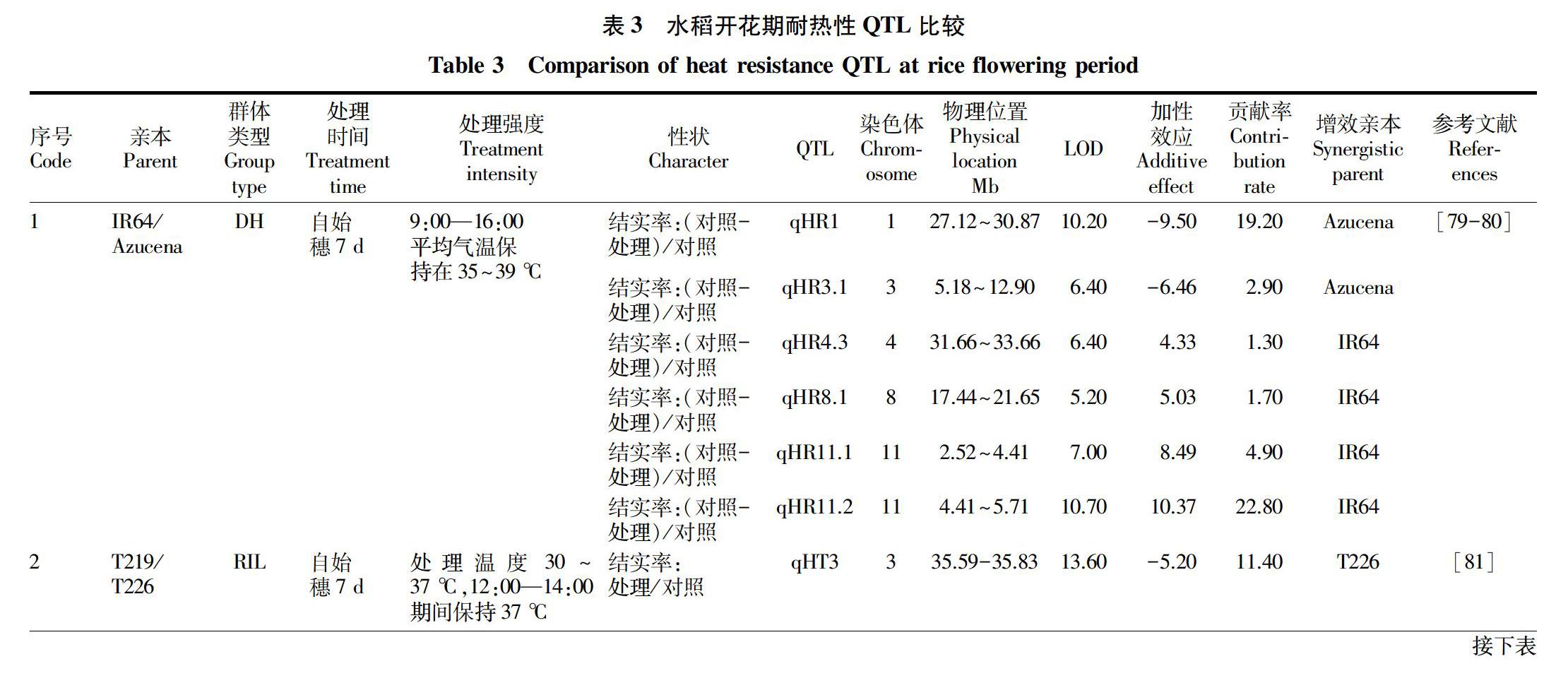
表3總结了前人利用耐热型与热敏感型水稻材料发展遗传分离群体,在开花期进行耐热处理,调查表型性状,结合分布于基因组分子标记,开展QTL定位工作。结果表明,控制水稻耐热性QTL水稻12条染色体均有分布,这些QTL不同的研究工作者中具有较好的可重复性。在初级定位群体(RIL或F2)中,单个QTL对群体表型变异贡献率约为15%。
5 结语
在自然影响因素和人为影响因素的共同作用下,全球气候变暖的事实毋庸置疑,在可预计的未来100 a内全球地表平均温度仍将继续保持上升的趋势。在世界许多地区,持续升高的地表温度导致的高温热害现象,已经成为作物生产的主要气象灾害之一。利用遗传方法培育耐热能力的作物是应对高温热害效应的重要途径。然而,水稻耐热性状遗传机理复杂,基础分子遗传学研究进展缓慢,遗憾的是迄今尚鲜见利用鉴定的具有耐热性的遗传资源或QTL有效地改良水稻品种的耐受热害能力的报道。快速、准确、高效的耐热性评价方法是开展水稻耐热性的遗传资源筛选、解析水稻耐热遗传及分子机理的重要前提。然而,目前尚未形成统一的水稻耐高温鉴定评价方法,热害鉴定设施、技术方法和评价体系也不一致,评价结果往往不具有可比性。高温鉴定设施主要包括简易温室、人工光照气候箱、田间远红外加热、采用水帘控温模式或氟利昂空调控温系统的人工温室等,这些设施在温度的均匀性、精准性、湿度控制等方面存在较大缺陷,室内设定的高温生长环境与外界高温环境截然不同,也直接影响试验结果的稳定性与可靠性。随着人工智能、图像识别技术的发展,探索热成像技术在水稻耐热性鉴定中的应用,结合生理生化指标分析,有可能提高水稻材料耐热性评价的稳定性与可靠性。
参考文献
[1]
唐恬,金荣花,彭相瑜,等.2013年夏季中国南方区域性高温天气的成因分析[J].成都信息工程学院学报,2014,29(6):652-659.
[2] 龚志强,王艳娇,王遵娅,等.2013年夏季气候异常特征及成因简析[J].气象,2014,40(1):119-125.
[3] 张桂莲,陈立云,雷东阳,等.水稻耐热性研究进展[J].杂交水稻,2005,20(1):1-5.
[4] 沈永平,王国亚.IPCC第一工作组第五次评估报告对全球气候变化认知的最新科学要点[J].冰川冻土,2013,35(5):1068-1076.
[5] 农业部.农业部关于印发《全国种植业结构调整规划(2016-2020年)》的通知[EB/OL].(2016-04-11)[2020-11-25].http://www.gov.cn/xinwen/2016-04/28/content_5068722.htm.
[6] 谢晓金,李秉柏,王琳,等.长江中下游地区高温时空分布及水稻花期的避害对策[J].中国农业气象,2010,31(1):144-150.
[7] 谭诗琪,申双和.长江中下游地区近32年水稻高温热害分布规律[J].江苏农业科学,2016,44(8):97-101.
[8] 田小海,罗海伟,周恒多,等.中国水稻热害研究历史、进展与展望[J].中国农学通报,2009,25(22):166-168.
[9] 范国太.南优二号作一季稻种植的空秕问题[J].湖北农业科学,1979(9):13-18.
[10] 李才媛,彭春华,赵勤炳,等.武汉市2003年盛夏异常高温特征分析[J].华中师范大学学报(自然科学版),2004,38(3):379-382.
[11] 黄义德,曹流俭,武立权,等.2003年安徽省中稻花期高温热害的调查与分析[J].安徽农业大学学报,2004,31(4):385-388.
[12] 汪寿康,汪更文,汪又佳.2003年水稻高温热害情况的调查[J].安徽农学通报,2004,10(1):27-35.
[13] 杨惠成,黄仲青,蒋之埙,等.2003年安徽早中稻花期热害及防御技术[J].安徽农业科学,2004,32(1):3-4.
[14] 吴金水.2013年高温热害对当涂县杂交水稻结实率的影响[J].现代农业科技,2014(5):30,34.
[15] 单宏业,黄在进,王金城.2013年淮安市水稻中后期高温热害调查分析[J].现代农业科技,2014(9):93,95.
[16] 马娟.2013年凤台县高温对水稻花期发育的影响[J].现代农业科技,2014(6):35-36.
[17] 邰祥友,王松洋,叶为发,等.2013年白湖水稻高温热害调查研究[J].现代农业科技,2014(6):253-254.
[18] 龚志强,王艳娇,王遵娅,等.2013年夏季气候异常特征及成因简析[J].气象,2014,40(1):119-125.
[19] 罗艳,伍晓玲,周建平,等.2013年极端高溫对合肥一季稻的影响分析[J].中国农学通报,2015,31(21):244-248.
[20] 张长海,汪向东,刘玲,等.2013年桐城市杂交中籼高温热害表现与成因分析[J].杂交水稻,2015,30(1):42-47.
[21] 孙正玉,霍金兰,孙明,等.2013年夏季高温对盐城水稻生产的影响[J].大麦与谷类科学,2014(3):12-14.
[22] 张佩,于庚康,徐敏,等.2013年持续高温对江苏省水稻生产的影响[J].江苏农业科学,2019,47(5):225-229.
[23] WASSMANN R,JAGADISH S V K,SUMFLETH K,et al.Chapter 3 regional vulnerability of climate change impacts on Asian rice production and scope for adaptation[J].Advances in agronomy,2009,102:91-133.
[24] JAGADISH S V K,SEPTININGSIH E M,KOHLI A,et al.Genetic advances in adapting rice to a rapidly changing climate[J].Journal of agronomy and crop science,2012,198(5):360-373.
[25] SHI W,ISHIMARU T,GANNABAN R B,et al.Popular rice (Oryza sativa L.) cultivars show contrasting responses to heat stress at gametogenesis and anthesis[J].Crop science,2015,55(2):589-596.
[26] YOSHIDA S.Fundamentals of rice crops science[M].Los Banos,The Philippines:International Rice Research Institute,1981.
[27] SATAKE T,YOSHIDA S.High temperature-induced sterility in indica rices at flowering[J].Japanese journal of crop science,1978,47(1):6-17.
[28] NAKAGAWA H,HORIE T,MATSUI T.Effects of climate change on rice production and adaptive technologies[C]//MEW T W,BRAR D S,PENG S,et al.Rice science:Innovations and impact for livelihood.Beijing,China: International Rice Research Institute,China,2003:635-657.
[29] 张再君,朱英国.高温对不同类型杂交稻结实率的影响[C]//湖北省遗传学会第七次代表大会暨学术讨论会论文摘要集.武汉:湖北省科学技术协会,2004:64-65.
[30] SHAH F,HUANG J,CUI K,et al.CLIMATE CHANGE AND AGRICULTURE PAPER:Impact of high-temperature stress on rice plant and its traits related to tolerance[J].Journal of agricultural science,2011,149(5):545-556.
[31] 徐海波,王光明,隗溟,等.高温胁迫下水稻花粉粒性状与结实率的相关分析[J].西南农业大学学报,2001,23(3):205-207.
[32] 李训贞,梁满中,周广洽,等.水稻开花时的环境条件对花粉活力和结实的影响[J].作物学报,2002,28(3):417-420.
[33] 张桂莲,陈立云,张顺堂,等.高温胁迫对水稻花粉粒性状及花药显微结构的影响[J].生态学报,2008,28(3):1089-1097.
[34] 張桂莲,张顺堂,肖浪涛,等.花期高温胁迫对水稻花药生理特性及花粉性状的影响[J].作物学报,2013,39(1):177-183.
[35] 雷东阳.开花期高温胁迫对水稻花粉粒性状及结实率的影响[J].中国农学通报,2014,30(18):35-39.
[36] 黄福灯,曹珍珍,李春寿,等.花期高温对水稻花器官性状和结实的影响[J].核农学报,2016,30(3):565-570.
[37] 黄英金,罗永锋,黄兴作,等.水稻灌浆期耐热性的品种间差异及其与剑叶光合特性和内源多胺的关系[J].中国水稻科学,1999,13(4):205-210.
[38] 李祥洲,任昌福,陈晓玲.水稻亚种间杂种一代籽粒充实的气温条件研究[J].作物学报,1996,22(2):247-250.
[39] MATSUI T,NAMUCO O S,ZISKA L H,et al.Effects of high temperature and CO2 concentration on spikelet sterility in indica rice[J].Field crop research,1997,51(3):213-219.
[40] MATSUI T,OMASA K,HORIE T.High temperature-induced spikelet sterility of japonica rice at flowering in relation to air temperature,humidity and wind velocity conditions[J].Japanese journal of crop science,1997,66(3):449-455.
[41] MATSUI T,OMASA K,HORIE T.Rapid swelling of pollen grains in response to floret opening unfolds anther locules in rice (Oryza sativa L.)[J].Plant production science,1999,2(3):196-199.
[42] MATSUI T,OMASA K,HORIE T.Mechanism of anther dehiscence in rice (Oryza sativa L.)[J].Annals of botany,1999,84(4):501-506.
[43] MATSUI T,OMASA K,HORIE T.High temperature at flowering inhibits swelling of pollen grains,a driving force for thecae dehiscence in rice (Oryza sativa L.)[J].Plant production science,2000,3(4):430-434.
[44] MATSUI T,OMASA K,HORIE T.Comparison between anthers of two rice (Oryza sativa L.) cultivars with tolerance to high temperatures at flowering or susceptibility[J].Plant production science,2001,4(1):36-40.
[45] MATSUI T,OMASA K,HORIE T.The difference in sterility due to high temperatures during the flowering period among japonica-rice varieties[J].Plant production science,2001,4(2):90-93.
[46] MATSUI T,OMASA K.Rice (Oryza sativa L.) cultivars tolerant to high temperature at flowering:Anther characteristics[J].Annals of botany,2002,89(6):683-687.
[47] MATSUI T,KAGATA H.Characteristics of floral organs related to reliable self-pollination in rice (Oryza sativa L.)[J].Annals of botany,2003,91(4):473-477.
[48] MATSUI T,KOBAYASI K,KAGATA H,et al.Correlation between viability of pollination and length of basal dehiscence of the theca in rice undera hot-and-humid condition[J].Plant production science,2005,8(2):109-114.
[49] GUNAWARDENA T A,FUKAI S,BLAMEY F P C.Low temperature induced spikelet sterility in rice.I.Nitrogen fertilisation and sensitive reproductive period[J].Australian journal of agricultural research,2003,54(10):937-946.
[50] PRASAD P V V,BOOTE K J,ALLEN L H JR,et al.Species,ecotype and cultivar differences in spikelet fertility and harvest index of rice in response to high temperature stress[J].Field crops research,2006,95(2/3):398-411.
[51] CAO Y Y, DUAN H,YANG L N,et al.Effect of heat stress during meiosis on grain yield of rice cultivars differing in heat tolerance and its physiological mechanism[J].Acta agronomica sinica,2008,34(12):2134-2142.
[52] JAGADISH S V K,MUTHURAJAN R,OANE R,et al.Physiological and proteomic approaches to address heat tolerance during anthesis in rice (Oryza sativa L.)[J].Journal of experimental botany,2010,61(1):143-156.
[53] DAS S,KRISHNAN P,NAYAK M,et al.High temperature stress effects on pollens of rice (Oryza sativa L.) genotypes[J].Environmental and experimental botany,2014,101:36-46.
[54] 王才林,仲維功.高温对水稻结实率的影响及其防御对策[J].江苏农业科学,2004,32(1):15-18.
[55] ZHAO L,LEI J G,HUANG Y J,et al.Mapping quantitative trait loci for heat tolerance at anthesis in rice using chromosomal segment substitution lines[J].Breeding science,2016,66(3):358-366.
[56] XIAO Y H,PAN Y,LUO L H,et al.Quantitative trait loci associated with pollen fertility under high temperature stress at flowering stage in rice (Oryza sativa)[J].Rice science,2011,18(3):204-209.
[57] XIAO Y H,PAN Y,LUO L H,et al.Quantitative trait loci associated with seed set under high temperature stress at the flowering stage in rice (Oryza sativa L.)[J].Euphytica,2011,178(3):331-338.
[58] SARSU F,GHANIM A M A,DAS P,et al.Pre-field screening protocols for heat-tolerant mutants in rice[M/OL].(2018)[2020-10-25].https://doi.org/10.1007/978-3-319-77338-4_5.
[59] ZHOU W H,XUE D W,ZHANG G P.Identification and physiological characterization of thermo-tolerant rice genotypes[J].浙江大学学报(农业与生命科学版),2012,38(1):1-9.
[60] YOSHIDA S,FORNO D A,COCK J H,et al.Laboratory manual for physiological studies of rice[M].Manila,Philippines:International Rice Research Institute,1976.
[61] LI X M,CHAO D Y,WU Y,et al.Natural alleles of a proteasome α2 subunit gene contribute to thermotolerance and adaptation of African rice[J].Nature genetics,2015,47(7):827-833.
[62] JAGADISH S V K,CRAUFURD P Q,WHEELER T R.High temperature stress and spikelet fertility in rice (Oryza sativa L.)[J].Journal of experimental botany,2007,58(7):1627-1635.
[63] TENORIO F A M,YE C R,REDONA E,et al.Screening rice genetic resource for heat tolerance[J].SABRAO journal of breeding and genetics,2013,45(3):341-351.
[64] JAGADISH S V K,CRAUFURD P Q,WHEELER T R.Phenotyping parents of mapping populations of rice for heat tolerance during anthesis[J].Crop science,2008,48(3):1140-1146.
[65] ZHANG C X,FU G F,YANG X Q,et al.Heat stress effects are stronger on spikelets than on flag leaves in rice due to differences in dissipation capacity[J].Journal of agronomy and crop science,2016,202(5):394-408.
[66] SHEEHY J E,MITCHELL P L,BEERLING D J,et al.Temperature of rice spikelets:Thermal damage and the concept of a thermal burden[J].Agronomie,1998,18(7):449-460.
[67] EKANAYAKE I J,DE DATTA S K,STEPONKUS P L.Spikelet sterility and flowering response of rice to water stress at anthesis[J].Annals of botany,1989,63(2):257-264.
[68] SONG Z P,LU B R,CHEN J K.A study of pollen viability and longevity in Oryza rufipogon,O.sativa,and their hybrids[J].IRRN,2001,26:31-32.
[69] CHO J.Double fertilization in Oryza sativa L.and development of the endosperm with special reference to the aleurone layer[J].Bulletin of the national institute of agriculture science,1956,6:61-101.
[70] JAGADISH S V K,CAIRNS J,LAFITTE R,et al.Genetic analysis of heat tolerance at anthesis in rice[J].Crop science,2010,50(5):1633-1641.
[71] ISHIMARU T,HIRABAYASHI H,KUWAGATA T,et al.The early-morning flowering trait of rice reduces spikelet sterility under windy and elevated temperature conditions at anthesis[J].Plant production science,2012,15(1):19-22.
[72] FU G F,FENG B H,ZHANG C X,et al.Heat stress is more damaging to superior spikelets than inferiors of rice (Oryza sativa L.) due to their different organ temperature[J].Frontiers in plant science,2016,7:1-16.
[73] YE C R,ARGAYOSO M A,REDOA E D,et al.Mapping QTL for heat tolerance at flowering stage in rice using SNP markers[J].Plant breeding,2012,131(1):33-41.
[74] YE C R,TENORIO F A,ARGAYOSO M A,et al.Identifying and confir ming quantitative trait loci associated with heat tolerance at flowering stage in different rice populations[J].BMC Genetics,2015,16:1-10.
[75] 陳庆全,余四斌,李春海,等.水稻抽穗开花期耐热性QTL的定位分析[J].中国农业科学, 2008,41(2):315-321.
[76] 陈庆全,万丙良.水稻耐热性的人工气候室鉴定方法研究[J].安徽农业科学,2009,37(14):6350,6360.
[77] 胡声博,张玉屏,朱德峰,等.杂交水稻耐热性评价[J].中国水稻科学,2012,26(6):751-756.
[78] BADO S,FORSTER B P,GHANIM A M A,et al.Protocols for pre-field screening of mutants for salt tolerance in rice,wheat and barley[M].Cham:Springer International Publishing,2016.
[79] 曹立勇,朱军,赵松涛,等.水稻籼粳交DH群体耐热性的QTLS定位[J].农业生物技术学报,2002,10(3):210-214.
[80] 曹立勇,赵建根,占小登,等.水稻耐热性的QTL定位及耐热性与光合速率的相关性[J].中国水稻科学,2003,17(3):223-227.
[81] ZHANG G L,CHEN L Y,XIAO G Y,et al.Bulked segregant analysis to detect QTL related to heat tolerance in rice (Oryza sativa L.) using SSR markers[J].Agricultural sciences in China,2009,8(4):482-487.
[82] SHANMUGAVADIVEL P S,AMITHA MITHRA S V,CHANDRA PRAKASH,et al.High resolution mapping of QTLs for heat tolerance in rice using a 5K SNP array[J].Rice,2017,10(1):1-11.
[83] LIU Q,YANG T F,YU T,et al.Integrating small RNA sequencing with QTL mapping for identification of miRNAs and their target genes associated with heat tolerance at the flowering stage in rice[J].Front plant science,2017,8:1-15.
[84] CHENG L R,WANG J M,VERONICA U,et al.Genetic analysis of cold tolerance at seedling stage and heat tolerance at anthesis in rice (Oryza sativa L.)[J].Journal of integrative agriculture,2012,11(3):359-367.
[85] VIKRAM P,SINGH A K,SINGH S P.Sequence analysis of Nagina-22 drought tolerant ESTs for drought specific SSRs[J].International journal of plant science,2010,5:174-176.
[86] MOHAPATRA T,ROBIN S,SARLA N,et al.EMS induced mutants of upland rice variety Nagina22:Generation and characterization[J].Proceedings of the Indian national science academy,2014,80(1):163-172.
[87] PRAKASH C,MITHRA S V A,SINGH P K,et al.Unraveling the molecular basis of oxidative stress management in a drought tolerant rice genotype Nagina 22[J].BMC Genomics,2016,17:1-14.
[88] POLI Y,BASAVA R K,PANIGRAHY M,et al.Characterization of a Nagina22 rice mutant for heat tolerance and mapping of yield traits[J].Rice,2013,6:1-9.
[89] 符冠富,宋健,廖西元,等.中国常用水稻保持系及恢复系开花灌浆期耐热性评价[J].中国水稻科学,2011,25(5):495-500.
[90] MANIGBAS N L,LAMBIO L A F,MADRID L B,et al.Germplasm innovation of heat tolerance in rice for irrigated lowland conditions in the Philippines[J].Rice science,2014,21(3):162-169.
[91] XU Y F,ZHANG L,OU S J,et al.Natural variations of SLG1 confer high-temperature tolerance in indica rice[J].Nature communications,2020,11:1-13.
[92] ZHAO L,LEI J G,HUANG Y J,et al.Mapping quantitative trait loci for heat tolerance at anthesis in rice using chromosomal segment substitution lines[J].Breeding science,2016,66(3):358-366.
[93] 盤毅,罗丽华,邓化冰,等.水稻开花期高温胁迫下的花粉育性QTL定位[J].中国水稻科学,2011,25(1):99-102.
[94] 曹志斌,谢红卫,聂元元,等.水稻抽穗扬花期耐热QTL(qHTH5)定位及其遗传效应分析[J].中国水稻科学,2015,29(2):119-125.
[95] 曹志斌,唐秀英,肖伟军,等.水稻抽穗扬花期耐热性QTL(qHTH10)的鉴定及遗传效应分析[J].分子植物育种,2019,17(7):2223-2230.

