栀子总环烯醚萜对抑郁模型小鼠神经递质的影响
曲书阅衡 霞戚懿予葛平原杨念云朱华旭茅向军张启春
(1.贵州中医药大学,贵州 贵阳550025; 2.南京中医药大学,江苏省中药资源产业化过程协同创新中心,江苏南京210023; 3.南京中医药大学,江苏省植物药深加工工程中心,江苏 南京210023; 4.南京中医药大学,江苏省中药药效与安全评价重点实验室,江苏 南京210023; 5.贵州省食品药品检验所,贵州 贵阳550004)
抑郁症是一种由生物学、心理、遗传、社会和家庭因素引发的疾病,主要表现为自卑、快感不足、无价值感、自杀念头等症状[1],并具有易发病、易致残、易反复的特点[2]。临床上以西药治疗为主,但有不良反应、依从性差、易复发等缺点[3]。因此,越来越多的研究人员将目光投向于中草药,中药成分多、靶点多、作用多的优点,在药物开发和临床治疗中具有良好的应用前景[4]。抑郁症发病机制复杂,主要与神经递质、神经营养因子以及炎症因子有关。神经递质在突触传递中是充当“信使”的特定化学物质,对维持人体正常的生理活动具有重要作用[5],其含量和受体功能的变化可导致抑郁的发生,主要包括单胺类、氨基酸类和胆碱类神经递质。
栀子为茜草科植物栀子的干燥成熟果实,具有泻火除烦,清热利尿,凉血解毒的作用。总环烯醚萜作为栀子的主要活性成分,具有抗抑郁、抗炎和保护细胞等作用[6]。研究表明,栀子苷抗抑郁的作用机制可能与小鼠脑组织中单胺类神经递质五羟色胺水平升高有关[7]。但目前总环烯醚萜对不同时间点神经递质的时程性变化还有待研究,因此我们建立了脂多糖诱导的小鼠抑郁模型,探讨脂多糖作用后2、6、12、24 h 对小鼠强迫游泳不动时间的影响以及小鼠海马区神经递质的含量变化。
1 材料
1.1 动物 SPF 级雄性ICR 小鼠,体质量18~22 g,由青龙山动物繁殖中心提供,实验动物生产许可证号SCXK(苏)2019⁃0009。在24 h 的明暗周期中自由饮食饮水,温度(25±1)℃,相对湿度为(60±5)%。
1.2 药物与试剂 栀子(产地江西,批号160501),购自安徽中州中药饮片有限公司,经生药学教授吴启楠博士鉴定(南京中医药大学药学院)为茜草科植物栀子Gardenia jasminoidesJ.Ellis 的干燥成熟果实。对照品γ⁃氨基丁酸(GABA,批号100482⁃201601)、氯化乙酰胆碱(ACh,批号111597⁃200331)、盐酸多巴胺(DA,批 号100070⁃201507)均购自中国食品药品检定研究院;L⁃谷氨酸(Glu,批号111576⁃200201)、5⁃羟色胺盐酸盐(5⁃HT,批号 111656⁃200401 )、栀子苷(纯 度 98%,批 号FY18380711)均购自中国药品生物制品检定所;脂多糖(LPS,美国Sigma 公司);盐酸氟西汀(北京伊诺凯科技有限公司);甲醇(色谱纯,江苏汉邦科技有限公司);乙腈(色谱纯,美国默克公司);甲酸(色谱级,阿拉丁);羧甲基纤维素钠(CMC⁃Na,化学纯,国药集团化学试剂有限公司);95%乙醇(江苏花厅生物科技有限公司);AB⁃8型和HPD100 型大孔吸附树脂(南京良纬生物科技有限公司);纯水和超纯水均为实验室自制。
1.3 仪器 液相色谱质谱联用仪AB Q⁃Trap 5500(美国AB SCIEX 公司);Analyst 分析软件(美国AB SCIEX 公司);紫外可见分光光度计(北京普析通用仪器有限责任公司);十万分之一电子分析天平(日本岛津公司);冷冻干燥系统(南京新飞达光电科学技术有限公司);旋转蒸发器(南京金正教学仪器有限公司);实验室级超纯水仪(南京易普易达科技发展有限公司);高速冷冻离心机(南京百奥生物科技有限公司);全自动样品快速研磨仪(上海净信科技有限公司);涡旋混合器(北京踏锦科技有限公司)。
2 方法
2.1 总环烯醚萜的提取和纯化 称取栀子500 g,先加5 L水回流提取1.5 h,再加4 L 水回流提取1 h。用纱布过滤后合并滤液,常压浓缩至生药浓度为0.2 g/mL 的栀子水提浓缩液。将此溶液过HPD100 和AB⁃8(2 ∶1)混合型大孔吸附树脂柱,大孔吸附树脂柱的径高比为1 ∶10,洗脱体积流量1.5 mL/min,先用2 BV 蒸馏水洗去杂质,再用70%乙醇洗脱至无色,得到总环烯醚萜洗脱液[8]。将洗脱液转入旋转蒸发仪中浓缩后放入冷冻干燥机中冻干,得到总环烯醚萜冻干粉32.79 g。
2.2 总环烯醚萜含有量测定
2.2.1 标准曲线的制备 精密称取栀子苷对照品2.72 mg,用甲醇溶解配制成0.054 4 mg/mL 的对照品储备液。准确吸取对照品储备液1.0、1.5、2.0、2.5、3.0 mL 定容于5 mL量瓶中,配制成系列浓度的标准品溶液。以甲醇为参比溶液,用紫外可见分光光度计于238 nm 波长处测定吸光度,以吸光度为纵坐标,溶液的浓度为横坐标,得到线性回归方程Y=27.359X+0.017,相关系数为0.999 9。
2.2.2 含有量测定结果 精密称取总环烯醚萜冻干粉3.21 mg,用甲醇溶解于25 mL 量瓶中,再准确吸取2 mL溶液定容于50 mL 量瓶中,得到供试品溶液。用紫外可见分光光度计于238 nm 波长处测定该溶液的吸光度为0.626,求得溶液质量浓度为0.022 26 mg/mL,总环烯醚萜含量为86.68%。
2.3 造模、分组与给药 小鼠适应性喂养7 d 后,随机分为10 组,每组10 只,分别是对照组、盐酸氟西汀组(2 h⁃LPS+盐酸氟西汀组,20 mg/kg)、4 个LPS 模型组(2 h⁃LPS 组、6 h⁃LPS 组、12 h⁃LPS 组、24 h⁃LPS 组)和4 个总环烯醚萜给药组(2 h⁃LPS+环烯醚萜组、6 h⁃LPS+环烯醚萜组、12 h⁃LPS +环烯醚萜组、24 h⁃LPS +环烯醚萜组,90 mg/kg)。总环烯醚萜给药组和盐酸氟西汀组分别溶于0.5% CMC⁃Na 中,各组以0.2 mL/10 g 连续灌胃7 d,每天1 次,对照组和模型组给予0.5% CMC⁃Na 溶液。在最后一次给药后1 h,对照组小鼠腹腔注射生理盐水,其余小鼠注射0.83 mg/kg LPS。LPS 注射2 h 后,对照组、2 h⁃LPS+盐酸氟西汀组、2 h⁃LPS+环烯醚萜组和2 h⁃LPS 组进行强迫游泳实验;LPS 注射6 h 后,6 h⁃LPS+环烯醚萜组和6 h⁃LPS 组进行强迫游泳实验;LPS 注射12 h 后,12 h⁃LPS+环烯醚萜组和12 h⁃LPS 组进行强迫游泳实验;LPS 注射24 h 后,24 h⁃LPS+环烯醚萜组和24 h⁃LPS 组进行强迫游泳实验。
2.4 强迫游泳实验 将小鼠放入直径约12 cm、高约25 cm的透明圆筒中,筒内水深15 cm,水温(25±1)℃,小鼠无法触碰圆筒底部。用摄像头记录小鼠6 min 内的游泳行为,并统计小鼠在后4 min 内的不动时间[9]。
2.5 海马处理 强迫游泳结束后,立即处死小鼠,冰上分离出海马组织并于液氮中快速冷冻。精密称取海马组织,加入10 倍量冰冷的0.1% 甲酸,匀浆3 min。取匀浆液100 μL,加入冰冷的0.2% 甲酸⁃乙腈200 μL,涡旋振荡3 min,在4 ℃冷冻离心机中12 000 r/min 离心10 min,吸取上清液转入离心浓缩仪中浓缩挥干,0.1% 甲酸水复溶进样。
2.6 色谱条件 色谱柱InfinityLab Poroshell 120 EC⁃C18(2.1 mm×100 mm,2.7 μm);流动相A 为乙腈,B 为0.1%甲酸;柱温30 ℃;体积流量300 μL/min;进样量2 μL;梯度洗脱(0~2 min,98%~95% B;2~3.5 min,95%~40% B;3.5~4 min,40%~98% B;4~6.1 min,98% B)。
2.7 质谱条件 电喷雾离子源(ESI),正离子模式,多反应监测(MRM);毛细管电压3.0 kV;锥孔电压30.0 V;离子源温度150 ℃;脱溶剂温度500 ℃。质谱离子对信息见表1。
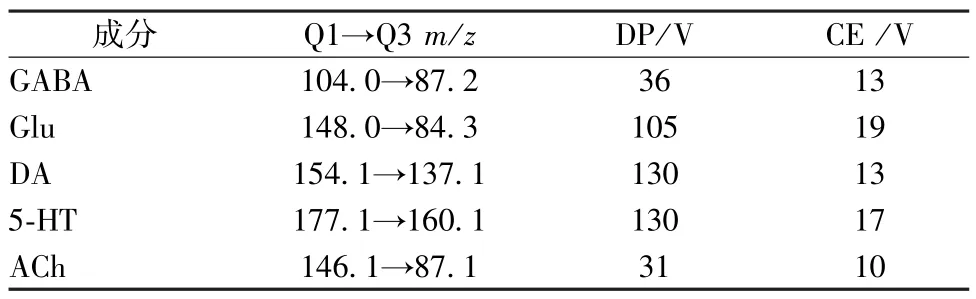
表1 神经递质的质谱信息
3 结果
3.1 总环烯醚萜对小鼠强迫游泳不动时间的影响 LPS 注射后,4 个模型组(2、6、12、24 h)小鼠强迫游泳不动时间较对照组升高(P<0.01),同时,阳性药盐酸氟西汀也能缩短小鼠强迫游泳的不动时间(P<0.01),表明造模成功。与模型LPS 组比较,2 h⁃LPS+环烯醚萜组和6 h⁃LPS+环烯醚萜组均能缩短小鼠不动时间(P<0.01),12 h⁃LPS+环烯醚萜组和24 h⁃LPS+环烯醚萜组小鼠强迫游泳不动时间无明显变化(P>0.05)。表明总环烯醚萜在LPS 注射后2~6 h 具有抗抑郁作用。见表2。
表2 各组小鼠强迫游泳不动时间的比较(, n=10)

表2 各组小鼠强迫游泳不动时间的比较(, n=10)
注:与对照组比较,**P<0.01;与2 h⁃LPS 组比较,##P<0.01;与6 h⁃LPS组比较,&&p<0.01。
3.2 方法学考察
3.2.1 线性范围及定量限 精密称取5 种神经递质对照品各2 mg,用0.1%甲酸溶解配制成1 mg/mL 的对照品储备液。准确吸取5 种对照品储备液各200 μL,加0.1% 甲酸至10 mL,配制成20 μg/mL 的混合对照品溶液,0.1%甲酸稀释至5、10、50、100、200、400、500、1 000、2 500、10 000、20 000 ng/mL,各取2 μL 进行LC⁃MS/MS 分析,并以各神经递质浓度为横坐标,峰面积为纵坐标,进行线性回归。见表3。
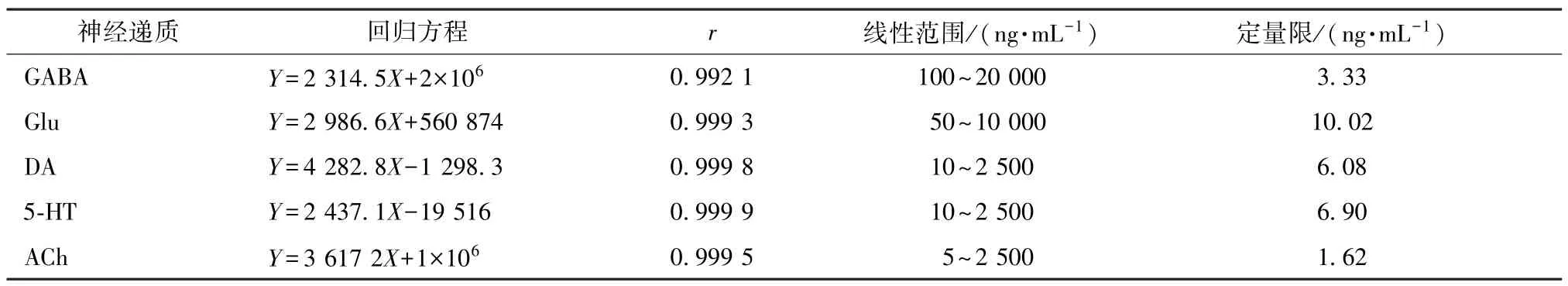
表3 5 种神经递质的线性关系及定量限
3.2.2 精密度试验 配制低、中、高3 种质量浓度(100、500、2 500 ng/mL)的对照品溶液,每个质量浓度6 份,每天测定3 次,连续3 d,计算日内和日间精密度。结果,GABA、Glu、DA、5⁃HT、ACh 的日内精密度RSD≤6.06,日间精密度RSD≤6.52,符合分析要求,见表4。
表4 5 种神经递质的精密度试验结果()

表4 5 种神经递质的精密度试验结果()
3.2.3 稳定性试验 取低、中、高浓度的混合对照品溶液,于4 ℃保存,分别在0、2、4、8、12、24 h 进样分析,各神经递质对照品RSD≤6.45%,表明4 ℃下24 h 内对照品稳定性较好。另取“2.5”项下的同一种脑组织的供试品溶液,于4 ℃保存,分别在0、2、4、8、12、24 h 进样分析,各脑组织中神经递质RSD≤6.0%,表明4 ℃下24 h内样品稳定性较好。见表5。
表5 5 种神经递质的稳定性试验及加样回收率()

表5 5 种神经递质的稳定性试验及加样回收率()
3.2.4 加样回收率试验 取空白脑组织匀浆液100 μL,加入已知量的各神经递质混合对照品溶液,配制成100、500、2 500 ng/mL,每个质量浓度样品数为6 份,按“2.5”项下方法操作,进样分析,记录所测峰面积,用A表示。另取空白脑组织匀浆液6 份,每份100 μL,同法处理,离心取上清后分别加入与上述等浓度的混合对照品溶液,放入离心浓缩仪中浓缩挥干,0.1%甲酸复溶进样,记录所测峰面积,用B表示,加样回收率=(A/B)×100%。结果见表5。
3.2.5 总环烯醚萜对海马中神经递质的影响 混合对照品及样品中神经递质色谱图见图1。与对照组相比,2 h⁃LPS组小鼠海马区Glu、ACh 升高(P<0.01),GABA、5⁃HT、DA 降低(P<0.01);与模型LPS 组相比,2 h⁃LPS+环烯醚萜组和6 h⁃LPS+环烯醚萜组中Glu、ACh 降低(P<0.01),2 h⁃LPS+环烯醚萜组和6 h⁃LPS+环烯醚萜组中GABA、5⁃HT、DA 升高(P<0.01),但12 h⁃LPS+环烯醚萜组和24 h⁃LPS+环烯醚萜组中各神经递质含量变化与模型组相比无明显变化(P>0.05)。见图2~3。

图1 混合对照品和海马中各神经递质色谱图

图2 总环烯醚萜对抑郁小鼠海马区神经递质的影响(n=10)

图3 总环烯醚萜对不同时间点海马神经递质的影响(n=10)
4 讨论
脂多糖是革兰氏阴性细菌细胞外壁的主要成分,能够诱导机体产生炎性细胞因子[10],炎性细胞因子通过影响脑中神经传递而发生氧化应激,从而导致抑郁症[11]。脂多糖注射后会产生心情低落,体质量减轻,食欲不振等症状,可用来模拟抑郁症的行为绝望状态[12]。本研究结果显示,脂多糖注射后,模型组(2、6、12、24 h)小鼠强迫游泳不动时间增加,总环烯醚萜给药后,2 h 和6 h 组小鼠强迫游泳不动时间减少,并与盐酸氟西汀和对照组小鼠不动时间相当,说明LPS 注射后2~6 h 总环烯醚萜可以改善小鼠的抑郁样行为。
海马是大脑边缘系统的重要脑区,人体情绪的改变与海马组织密切相关[13]。在抑郁症的发病过程中,海马区功能受损,神经递质的含量会发生改变。而抗抑郁药可以保护海马神经元细胞,促进海马神经发生[14]。研究发现,大脑功能的正常运行依赖于氨基酸类神经递质的平衡,Glu 经谷氨酸脱羧酶脱羧生成GABA,是中枢神经系统重要的抑制性递质,具有神经保护作用[15],当GABA 缺乏时会造成情绪失落[16]。Glu 是中枢神经系统中的兴奋性递质,是脑内含量最多的一种氨基酸。Glu 在正常情况下参与调节神经系统发育和学习记忆等过程,但在病理状态下表现出神经毒性[17]。唐亚梅等通过慢性不可预知应激模型发现抑郁模型大鼠中Glu 水平升高[18],通过调节Glu/GABA 的比值而起到神经保护的作用。单胺类神经递质作为中枢神经系统中的兴奋性递质,主要参与情感、睡眠、运动、神经内分泌的调节[19],其抗抑郁作用机制与神经递质的浓度及数量有关。研究表明抑郁模型大鼠可引起5⁃HT 和DA 含量下降[20]。胆碱能系统参与情绪调节,抑郁症通常与胆碱类递质异常有关[21]。ACh 在运动、感觉、活动、摄食、体温调节、睡眠和学习记忆中都起着重要的作用,当ACh 增多、释放减少时,可出现活动减少,嗜睡等现象[22]。中药本身具有多成分,多靶点的作用优势,可通过有效物质成分作用于神经递质,调节体内各种神经递质的表达起到抗抑郁作用。
从本实验结果分析,海马区GABA,5⁃HT,DA 在LPS注射后2 h 和6 h 比给药组降低,Glu 和ACh 在LPS 注射后2 h 和6 h 比给药组升高。但在LPS 注射后12 h 和24 h 与给药组相比各神经递质含量无明显变化。表明栀子总环烯醚萜通过与海马区的神经递质相互作用,调节不同时间点神经递质的变化,结合此结果推测小鼠在LPS 注射后2 h~6 h内总环烯醚萜有较好的抗抑郁作用,6 h 后总环烯醚萜无抗抑郁作用。产生此种变化的原因可能是由于栀子总环烯醚萜在体内逐渐代谢,6 h 后药效逐渐减弱,导致模型组和给药组没有差异。
本研究采用LC⁃MS/MS 法同时测定LPS 诱导的抑郁模型小鼠海马区5 种神经递质的含量变化。结果表明总环烯醚萜在LPS 注射后2~6 h 具有良好的抗抑郁作用,其作用机制是通过提升海马区GABA、5⁃HT、DA 水平以及降低Glu,ACh 的水平实现的。揭示了总环烯醚萜对海马区神经递质具有调节作用,也为临床上栀子总环烯醚萜治疗抑郁症提供了实验依据。

