基于离线2D-HPLC-DPPH-ESI-Q-TOF/MS联用技术的金银花抗氧化成分系统筛选研究
张敏敏 ,赵志国 ,刘 倩 ,刘 伟 ,王 晓 ,赵恒强 *
1.齐鲁工业大学(山东省科学院),山东省分析测试中心,山东 济南 250014
2.齐鲁工业大学(山东省科学院)药学院,山东 济南 250014
自由基是1 个含有不成对电子的原子团,性质极不稳定。体内过盛的自由基会攻击人体细胞对人体造成严重损伤,维持体内自由基平衡是保证人体健康的重要途径。抗氧化剂是一类能帮助捕获并中和自由基,从而祛除自由基对人体损害的一类物质。具有自由基清除作用的抗氧化剂的研究已成热点,其中天然抗氧化剂以其高安全性、强环保性等优势成为科学研究中的重要目标[1-2]。天然抗氧化剂的发现也是天然产物研究领域的重要研究方向。
金银花为忍冬科植物忍冬Lonicera j aponicaThunb.的干燥花蕾或带初开的花[3],在我国传统中药处方中广泛用于治疗发烧、感染、疮疡和肿胀等疾病[4-5],2002年被列入原卫生部公布的《既是食品又是药品的药物名单》,成为药食同源食品被广泛应用于保健食品和功能饮料行业[6-7]。现代药理学研究表明,金银花提取物具有解热、保肝、抗菌、抗炎、抗氧化、抗病毒等广泛的生物活性[8-11]。王春鹏等[12]建立了金银花抗氧化活性指纹图谱,从其中筛选出绿原酸和异绿原酸A 为主的8 个抗氧化成分;梁从莲等[13]建立金银花指纹图谱及清除DPPH自由基的谱-效关系,由此可见,金银花也是天然抗氧化剂的一个良好来源。研究发现,金银花中含有酚酸类、黄酮类、环烯醚萜类等多种化学成分[14-16],且各成分含量、极性差异较大,是复杂体系天然产物的代表。由于化学成分的复杂性对其提取物中抗氧化活性成分的发现造成了较大的干扰,尤其是对低含量化合物的活性发现和应用造成了较大困难。
传统的天然产物活性成分发现方法一般是采用一系列的分离和纯化技术得到单体成分,再进行体内或体外药理学筛选,该方法在药物开发中发挥着重要作用[17-19]。但是,该方法存在耗时、耗能、效率较低、较为盲目等不足。另外,某些化合物由于含量较低和分离纯化过程中性质不稳定等因素使其抗氧化活性难以被发现。近年来,基于液相色谱-二苯基-三硝基-苯肼[high performance liquid chromatography-2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,HPLC-DPPH] 技术的在线抗氧化成分筛选技术,具有色谱分离和活性筛选同时进行,高效、快速等优势,目前已广泛用于天然抗氧化活性成分的快速筛选[20-25],成为天然产物中抗氧化成分筛选的主要方法之一。本课题组也应用该技术进行了木瓜、厚朴等多种天然产物中抗氧化成分的快速筛选[26-27],取得了较好的结果。但综合对比以往的研究可以发现,该方法对化学成分相对简单,含量较高成分的筛选效果较好,但对复杂体系天然产物中极性差异大和含量较低活性成分的同时筛选仍然存在一定困难,制约了该技术在天然产物抗氧化成分筛选中的应用。
离线二维色谱技术具有分辨率高、通量大、仪器配置要求低等优点,结合高分辨飞行时间质谱技术可以实现复杂体系天然产物中化学成分的分析表征。特别适合不同极性成分、结构类似物的分析表征,并且可以实现低含量成分的富集。离线二维色谱技术与DPPH-HPLC 技术联用将大大增加复杂体系天然产物中抗氧化成分的筛选能力,有关这方面的研究未见报道。
本研究提出了离线二维色谱联合 DPPH- HPLC-ESI-Q-TOF/MS 技术的金银花抗氧化成分的系统筛选方法。运用该方法从金银花中筛选出36种具有抗氧化活性的化学成分。该研究为复杂体系天然产物中抗氧化成分的系统筛选研究提供方法和技术支持。
1 仪器与材料
赛默飞Unimates3000 系列高效液相色谱系统(美国赛默飞世尓科技公司);高速离心机(上海安亭科学仪器厂)。Tecan M20 系列多功能酶标仪(瑞士帝肯集团有限公司);布鲁克 IMPACT II ESI-Q-TOF/MS 质谱仪(美国布鲁克公司);MICROTESTTM96 孔酶标板(波士顿狄金森公司);SB-5200D 系列高功率超声波清洗仪(宁波新芝公司);CPA225D 型十万分之一电子分析天平(德国Sartorius 公司)。
1,1-二苯基-2-三硝基苯肼(DPPH)购买于Sigma公司,乙腈(色谱纯)购于Merch 公司;对照品新绿原酸(批号 M07GB140938)、绿原酸(批号Y24J7K16726)、隐绿原酸(批号M06GB147634)、芦丁(批号 A05GB144263)、木犀草苷(批号Y13J10H93050)、异绿原酸(批号AP11D11L134209)、异绿原酸(批号BP17N11L131404)、异绿原酸C(批号M11GB140940)、1,3-二咖啡酰奎宁酸(批号P22J11F116507)均购于上海源叶生物技术公司,质量分数>98%。甲醇为色谱纯,其他试剂均为分析纯。实验用水为超纯水(Millipore Q-Plus 系统,美国)。
金银花样品购于济南漱玉平民大药房,经齐鲁工业大学(山东科学院山东省分析测试中心)王晓教授鉴定为忍冬科植物忍冬L.japonicaThunb.的干燥花蕾。
2 方法
2.1 供试品溶液制备
2.1.1 待测样品 精密称定金银花粉末10 g,加入70%甲醇1000 mL,超声提取30 min,减压蒸干后用20 mL 70%甲醇复溶,过0.45 微孔滤膜,备用。
2.1.2 筛选试剂 精密称定DPPH,用80%乙腈配制成浓度为60 μmol/L 的DPPH 自由基溶液,置于4 ℃保存。
2.1.3 对照品溶液 分别精密称定各对照品1.0 mg于1 mL 量瓶中,溶解后用甲醇定容,配制成质量浓度为1.0 mg/mL 的对照品溶液。
2.2 色谱条件
2.2.1 一维色谱条件 采用RIGOL-3245 半制备液相色谱系统结合反相制备色谱柱对金银花粗提物进行初步分段制备。色谱柱:YMC-Pack ODS-A柱(250 mm×10.0 mm,5 μm);流动相:0.2%甲酸水溶液(A)-乙腈(B)。梯度洗脱:0~20 min,10%~40% B;20~30 min,40%~50% B;30~31 min,50%~100% B。体积流量3.0 mL/min,检测波长为280 nm。进样量为100 μL。3 部分流分(流分A~C)收集后冷冻干燥,用70%甲醇复溶,经0.22 μm 微孔滤膜滤过后用于后续分析、鉴定和筛选。
2.2.2 二维色谱条件 采用赛默飞U3000超高效液相色谱系统完成样品的分段分析。鉴于组分间极性和含量的差异,需针对3 个流分分别优化出不同的液相分离条件和质谱鉴别条件,以获得更多的色谱分离峰和较好的分离效果。
(1)流分A 色谱分析:沃特世XBridge Amide色谱柱(250 mm×4.6 mm,3.5 μm);流动相:水(含0.8%甲酸、10 mmol/L 甲酸铵,A)-乙腈(B);梯度洗脱:0~5 min,96%~93% B;5~20 min,93% B;20~30 min,93%~85% B;30~40 min,85%~82% B;40~50 min,82%~78% B;50~51 min,78%~50% B;体积流量1.0 mL/min;检测波长280 nm;柱温35 ℃。
(2)流分B 色谱分析:安捷伦Eclipse Plus C18色谱柱(100 mm×3.0 mm,1.8 μm);流动相:水(含0.6%甲酸,A)-乙腈(含10%水,B);梯度洗脱:0~5 min,5%~6% B;5~15 min,6%~8% B;15~25 min,8%~10% B;25~40 min,10%~13% B;40~45 min,13%~15% B;45~55 min,15%~17% B;55~65 min,17%~30% B;65~70 min,30%~45% B;体积流量0.5 mL/min;检测波长254 nm;柱温35 ℃。
(3)流分C 色谱分析:沃特世Xselect HSS T3色谱柱(150 mm×3.0 mm,3.5 μm);流动相:水(含0.8%甲酸、10 mmol/L 甲酸铵,A)-乙腈(B);梯度洗脱:0~10 min,14%~17% B;10~20 min,17%~18% B;20~30 min,18%~19% B;30~50 min,19%~23% B;50~65 min,23%~28% B;65~75 min,28%~35% B;体积流量0.5 mL/min;检测波长345 nm;柱温40 ℃。
2.3 在线抗氧化筛选
利用赛默飞U3000双三元液相色谱系统完成各组分在线抗氧化筛选。各流分利用右泵经最优化的色谱条件进样分析,样品经过色谱柱分离后与左泵泵出的DPPH 溶液混合,混合液在反应池中反应后流入HPLC 系统的DAD 检测器进行检测。鉴于DPPH 在波长517 nm 处的特征峰由于DPPH 自由基被抗氧化活性成分清除后会形成倒峰。对比样品最佳吸收波长下和DPPH 自由基特征波长下的HPLC图谱确定筛选出抗氧化活性成分。
2.4 ESI-Q-TOF/MS 分析
电喷雾正负离子全扫描检测;全扫描范围m/z50~1500;锥孔电压60 V;毛细管电压5.0 kV;裂解电压120 V;喷雾气压310 kPa;干燥气体积流量8.0 L/min;干燥气温度200 ℃,通过以上质谱条件对这3 组流分分别进行质谱鉴别分析。
2.5 活性验证
将各单一对照品储备液分别稀释至7 个不同的质量浓度(0.50、0.25、0.10、0.05、0.02、0.01、0.005 mg/mL),作为待测样品备用。
取待测溶液50 μL,0.04 mg/mL DPPH 溶液100 μL 加入到96 孔板中混匀,室温避光孵育30 min 后在酶标仪517 nm 下测定吸光度(A)值。对照组中以50 μL 甲醇代替50 μL 待测溶液,其余添加溶液不变。空白组仅添加150 μL 甲醇。以维生素C 作为阳性对照。按照公式计算DPPH 自由基清除率,以清除率为纵坐标,浓度为横坐标绘制标准曲线,计算各对照品的半数抑制浓度(IC50)值。
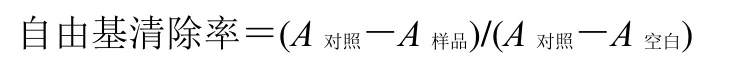
3 结果与分析
3.1 金银花提取物的离线二维色谱分析
本课题组在前期研究中建立了RP-HPLC-DAD法分析金银花活性成分的方法[28],并且发现金银花甲醇水提取物中活性成分较多,种类较为复杂,含量差异较大,除绿原酸和异绿原酸含量较高外,其他大部分成分含量较低[16]。另外,部分化学成分极性较高,采用反相色谱柱难以分离。含量和极性的显著差异对在线筛选的分辨率和灵敏度提出了更高要求。针对以上问题,本研究采用反相半制备液相色谱技术,根据色谱图中各色谱峰的出峰顺序和含量特点,对金银花提取物进行初步分离,从而实现低含量成分的富集和不同极性成分的初步分段。进一步采用不同类型色谱柱进行分析,以提高在线筛选的分辨率和灵敏度。
3.1.1 一维色谱条件优化 反相高效液相色谱系统已广泛应用于天然产物的分离纯化中,具有高效率,高分离度和高回收率的优点[29]。本部分利用反相半制备液相色谱技术将金银花提取物进行分段分析。在本研究中,考虑到金银花提取物的复杂性,采用梯度洗脱方法进行初步分离。通过半制备液相色谱柱洗脱出的样品按照极性和含量等综合评估分别收集A、B、C 3 个流分(制备分离结果见图1)。其中,流分A 所含化学成分极性较强且含量较低,流分C 化学成分极性稍弱、含量亦较低,需要多次进行富集。为从金银花中发现更多的低含量抗氧化成分,本研究对流分A 和C 进行了多次制备和浓缩,对流分B 进行了适当制备浓缩。
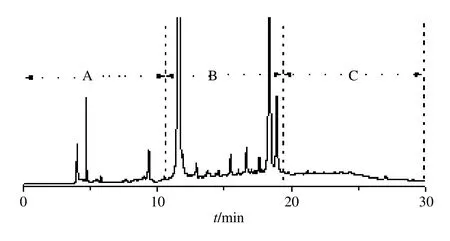
图1 金银花流分富集制备HPLC 图谱 (280 nm)Fig.1 Preparative chromatogram of Lonicerae Japonicae Flos segmentation (280 nm)
3.1.2 二维色谱分析条件优化 流分A在半制备液相上出峰较快。所含化学成分极性较强,采用普通反相色谱柱难以实现其有效分离,因此选用亲水色谱柱进行分析。考察了XBridgeTMHILIC column(150 mm×2.1 mm,3.5 μm),SeQuantTMZIC-HILIC column(150 mm×2.1 mm,3.5 μm;)和XBridgeTMAmide column(250 mm×4.6 mm,3.5 μm)3 根不同的亲水色谱柱对该组分的分离效果。结果表明,利用XBridgeTMAmide column(250 mm×4.6 mm,3.5 μm)进行分离时,出峰数量较多、分离度较好、峰形较尖锐,因此选用该色谱柱对流分A 进行色谱分离。流动相是影响色谱分离的又一项重要因素。经过考察发现,采用乙腈-水体系梯度洗脱可以实现流分A 中化学成分的较好分离。为了改善色谱峰拖尾现象,经过优化在水相中加入0.8%甲酸、10 mmol/L 甲酸铵可以得到较好的色谱峰型。HILIC 色谱柱分离效果受柱温影响较大,因此本研究考察了4 个不同柱温(25、30、35、40 ℃)对色谱分离的影响。结果表明,柱温为35 ℃时,峰形尖锐、分离度高、对称性好。优化后的色谱图见图2-A。
根据流分B 在半制备液相色谱上的出峰时间,选择反相色谱柱进行分析。另外,由于流分B 中化学成分较多,各成分间极性差异性较小,单纯采用乙腈-水体系梯度洗脱难以实现其有效分离。进一步考察了在乙腈中加入不同比例水(5%、10%、15%)的分离效果,结果表明,采用乙腈(10%水)-水体系,梯度洗脱,可以实现流分B 的较好分离。同时,考虑到金银花中所含主要化学成分为酚酸、黄酮类化合物,易造成C18柱拖尾现象,通过优化考察,在水相中添加一定比例的酸(0.6%甲酸)以达到改善色谱峰形的效果。在优化的色谱条件下,流分B的色谱分离图见图2-B。
流分C 在半制备色谱柱上出峰时间较晚,说明其极性稍弱,本研究采用反相色谱柱用于其分析研究。采用跟流分B 相同的方法和思路对流分C 色谱 条件进行了系统优化,最终选用 0.8%甲酸和10mmol/L甲酸铵作为流动相A,乙腈作为流动相B,柱温40 ℃作为最优色谱条件用于分析,所得色谱图如图2-C 所示。
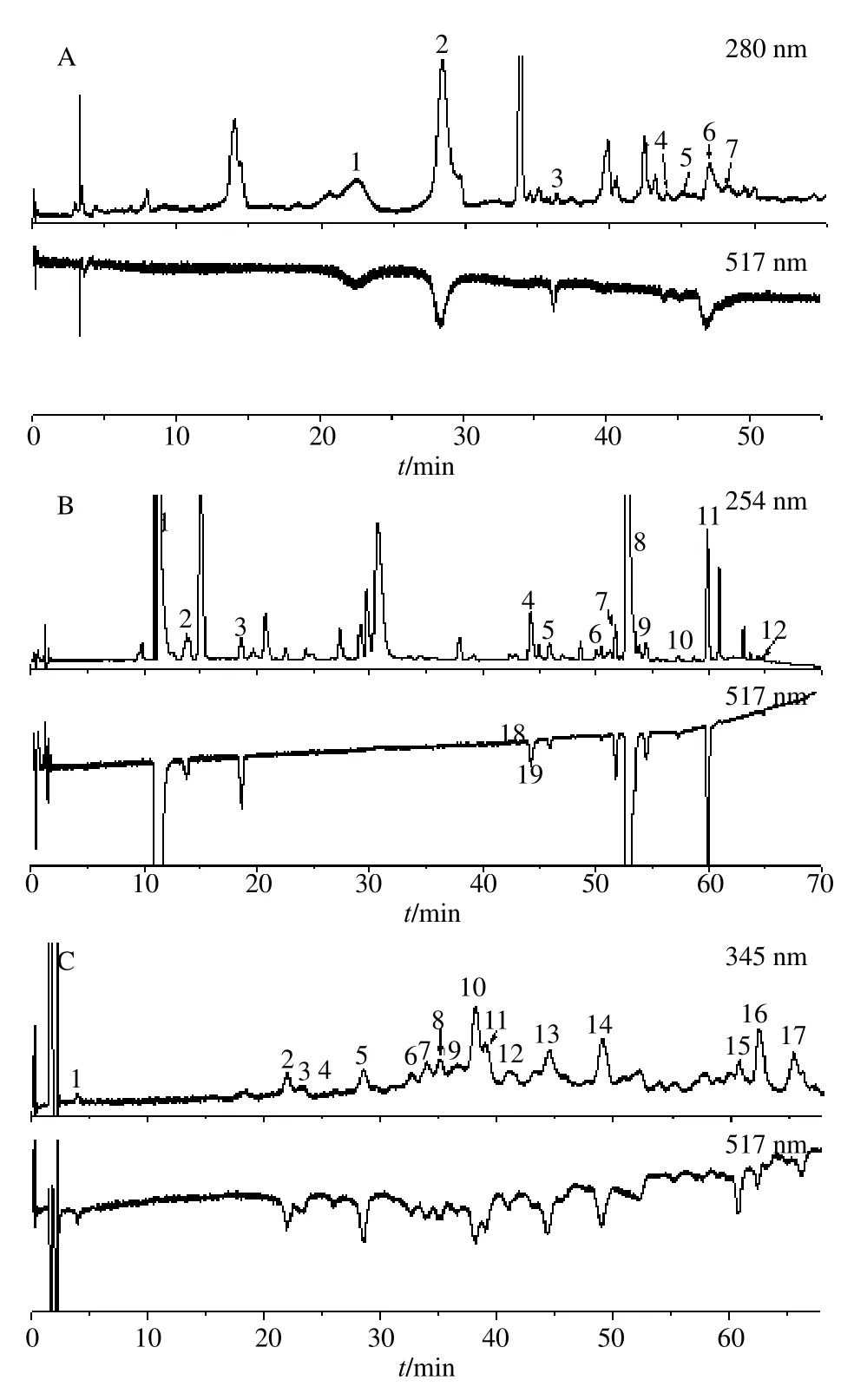
图2 金银花不同流分 (A~C) 的HPLC-DPPH 筛选图谱Fig.2 H PLC-DPPH screening ch romatogram o f honeysuckle fraction A, B and C
3.2 提取物的在线筛选
3.2.1 在线筛选条件优化 本研究所用在线筛选条件是在本课题组前期建立的在线抗氧化筛选模型[26]基础上进行了适当调整。重点针对DPPH 溶剂、DPPH 浓度、DPPH 体积流量和反应池规格(内径和长度)等进行优化考察。
由于流分A、B、C 的色谱分析均采用乙腈-水为流动相,为了保证基线稳定,研究选取3 种不同体积分数(50%、80%、100%)的乙腈作为DPPH溶解溶剂进行了对比优化。结果表明,针对该实验体系80%乙腈水为溶剂时基线较为平稳。通过对比3 个不同浓度的DPPH 溶液(0.6、6、60 μmol/L)的筛选效果,可以看出在一定范围中筛选效果随着浓度的增大而增大,直至平稳。但过大的浓度影响基线的稳定性。因此,选择60 μmol/L 作为最适浓度用于筛选。另外,针对不同色谱分离条件需优化调整DPPH 溶液泵入体积流量,本研究结合各组分色谱条件对0.2、0.4、0.6、0.8、1.0 mL/min 5 个DPPH溶液泵入体积流量进行分析,结果表明在合适的范围内随着泵入体积流量的增大,倒峰峰高不断增高,渐趋平稳。但相应可知,过大的体积流量会造成基线的强烈波动影响筛选灵敏度。因此,流分A 筛选体积流量确定为0.8 mL/min,流分B 和C 筛选体积流量确定为0.4 mL/min。
反应池规格会影响反应时间的长度,从而影响筛选效果。反应池规格包含反应管内径和反应管长度两项。本实验对2 种内径(0.18、0.25 mm)和3个长度(5、10、15 m)进行优化分析。研究结果表明:反应管越短,峰宽越窄,负峰分离度越高;反应管越长,峰高越高,负峰分离度越差。反应管内径越小,峰宽越窄,负峰分离度越高;反应管内径越大,峰高较高,分离度越差。综合考虑以上因素,确定内径为0.25 nm,长度为10 m 的PEEK 管为流分A 最适反应池,确定内径为0.25 nm,长度为10 m 的PEEK 管为流分B、C 最适反应池。
3.2.2 抗氧化成分的筛选 采用最优化的色谱分析条件和在线筛选条件对金银花提取物的3 个组分进行抗氧化成分在线筛选,结果见图2。从图2 可以看出,金银花提取物A、B、C 3 个流分均实现了较好的色谱分离,色谱峰的数量较金银花提取物的色谱图(图1)明显增加,且色谱峰信号强度适中,可以满足在线筛选的需求。最终,在A 组分中共筛选出7 个具有抗氧化活性的化合物,B 组分中共筛选出12 个具有抗氧化活性的化合物,C 组分中筛选出17 个抗氧化活性成分。综合上述筛选结果发现,经过离线二重分离分析后,在金银花不同极性组分中共筛选出36 种具有抗氧化活性的化学成分,研究结果明显优于文献报道中金银花中的抗氧化成分数量[30]。
3.3 抗氧化成分的ESI-Q-TOF/MS 鉴别
按最优化的HPLC 条件和ESI-Q-TOF-MS 条件对流分A、B、C 分别进行高分辨飞行时间质谱分析,根据各化合物的精确相对分子质量、特征吸收波长,并参照文献报道[31-33]对筛选出的抗氧化活性成分进行鉴别,结果见表1。其中,初步鉴定出12种活性成分。另外,由表1 信息结合各类化合物的光谱特征可以看出金银花中筛选出的抗氧化成分以有机酸类为主,同时含有部分黄酮类成分等,以化合物B4 为例,其m/z609.133 2 为 [M-H]-峰,碎
片离子含有300.028 3 且其在254、327 nm 处有较大吸收,符合黄酮类化合物甲醇溶液在200~400 nm 的区域内存在2 个主要的紫外吸收带——峰带I(300~400 nm)和峰带II(220~280 nm)的特征,因此结合文献报道[34]鉴定化合物B4 为黄酮类化合物芦丁;研究表明金银花中有机酸类化合物紫外特征吸收光谱最大值约在280、330 nm[35],化合物B8m/z515.115 9 为 [M-H]-峰,且含有离子峰 [M+H]+517.131 9 和 [M+Na]+539.113 6,因此初步鉴别B8为有机酸类化合物异绿原酸,结合出峰顺序等因素判定其为异绿原酸A。
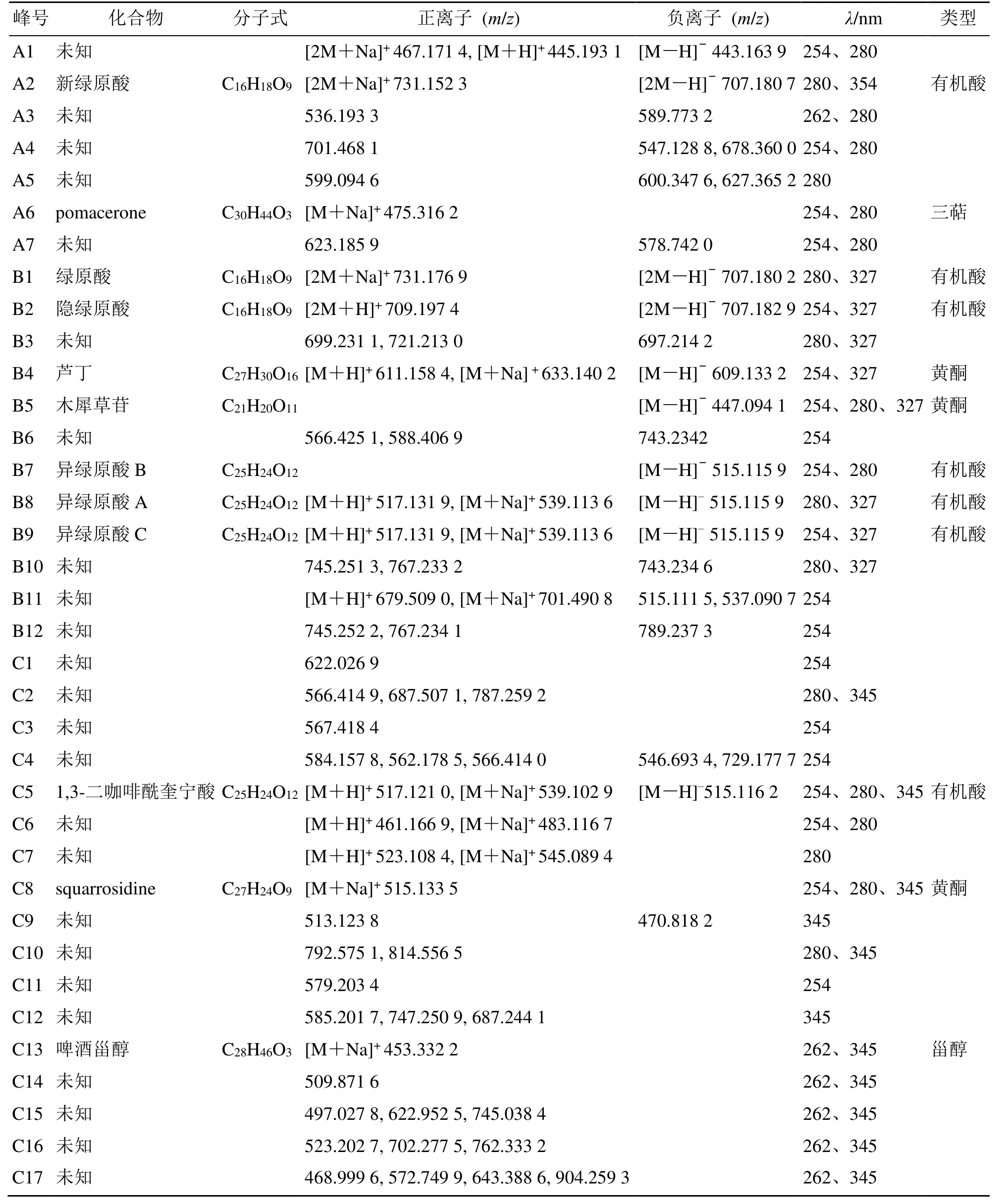
表1 金银花中抗氧化成分ESI-Q-TOF-MS 鉴别Table 1 ESI-Q-TOF-MS identification of antioxidants in Lonicerae Japonicae Flos
3.4 活性验证
本研究采用化合物体外DPPH 自由基清除试验来实现单体化合物的活性验证。测定了其中9个化合物的抗氧化活性及IC50值,结果见表2。结果表明,这9 个化合物均具有一定的抗氧化活性且在一定范围内呈现良好的量效关系。其中异绿原酸B 的IC50值最小(19.0 μmol/L),表明其抗氧化活性最好。对比各化合物的IC50值,得出抗氧化活性顺序为:异绿原酸B>异绿原酸A>1,3-二咖啡酰奎宁酸>异绿原酸C>芦丁>隐绿原酸>绿原酸>维生素 C>新绿原酸>木犀草苷。其中,有7 种成分的抗氧化活性明显优于阳性对照维生素C。该结果进一步表明金银花的抗氧化活性是其中所含多种抗氧化成分共同作用的结果。
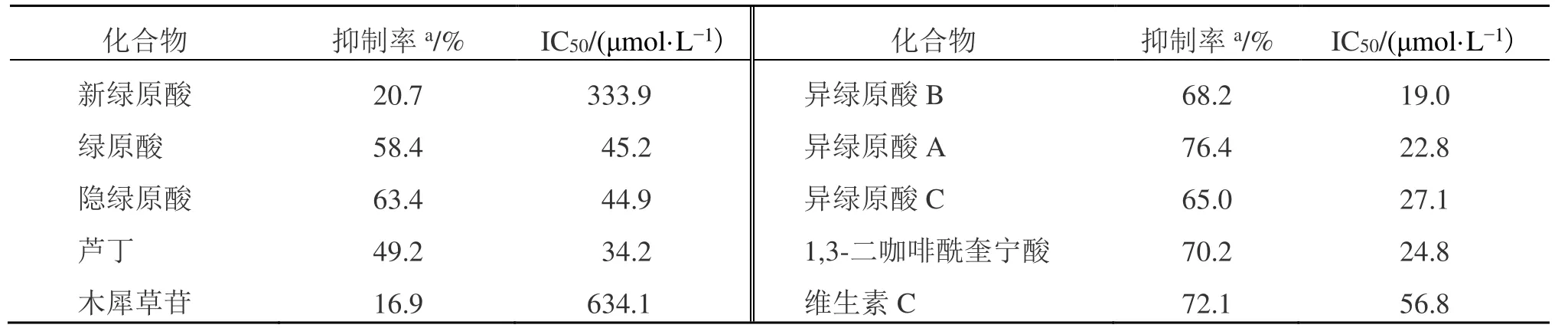
表2 金银花中抗氧化成分活性验证Table 2 Antioxidant activity verification of components in Lonicerae Japonicae Flos
4 讨论
本研究建立了离线二维色谱-DPPH-ESI-Q- TOF/MS 法系统筛选金银花中抗氧化活性成分的方法。通过该发法从金银花提取物中共筛选出36 种具有抗氧化活性的成分,采用高分辨质谱鉴别出12种,体外DPPH 自由基清除活性验证实验表明,其中7 种成分的抗氧化活性优于阳性对照(维生素C)。该方法克服了金银花化学成分种类多、含量和极性差异较大而造成的抗氧化成分筛选假阴性问题。为后续从复杂体系中较为全面的筛选抗氧化活性成分提供了新的研究思路和方法技术支持。
利益冲突所有作者均声明不存在利益冲突

