血清uMtCK、AHSG及NGAL与胃癌患者病理参数及临床预后的关系
陈瑶
胃癌是我国常见的消化道恶性肿瘤疾病之一,且多数患者胃癌早期症状隐匿,确诊时多于处于胃癌进展期或晚期,患者生存预后较差。因此,对于探索胃癌相关的肿瘤标志物和血清学指标,反映胃癌的生物学特点,提高胃癌的诊断率和患者生存率一直是临床研究的热点内容。近年来,关于血清中线粒体肌酸激酶(mitochondrial creatine kinase,MtCK)在肿瘤中的异常表达及作用引起了临床学者的关注,其包括广泛型线粒体肌酸激酶(uMtCK)和肌节线粒体肌酸激酶(sMtCK)2 种,其中uMtCK 被认为在前列腺癌、肝癌等恶性肿瘤中存在过表达[1]。胎球蛋白A(alpha2-Heremans-Schmid glycoprotein,AHSG)为肝细胞合成和分泌的一类糖蛋白,其可通过基质胶促进肿瘤细胞的侵袭转移,AHSG 在多种恶性肿瘤中均存在异常表达[2]。中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase-associated lipo-calin,NGAL)为lipocalin 家族的一员,研究证明NGAL 与炎症、细胞分化与凋亡、免疫反应、组织重构及多种肿瘤的发生发展密切相关;且其表达与肿瘤浸润、转移和预后关系密切[3-4]。因此,本研究对血清uMtCK、AHSG 及NGAL 与胃癌患者病理参数及临床预后的关系进行了探究,以探讨三者作为胃癌有效诊断和预后指标的可行性。
1 资料与方法
1.1 一般资料
选取本院消化内科2017年1月至2019年1月收治的85 例胃癌患者作为研究组,纳入标准:①均符合中华医学会消化内镜学分会及中国抗癌协会肿瘤内镜专业委员会制定的《中国早期胃癌筛查及内镜诊治共识意见(2014年)》[5]关于胃癌的诊断标准;②均对本研究知情自愿签署知情同意书;③此前未接受放化疗、手术及其他抗肿瘤药物治疗;④临床资料完整。排除标准:①合并肝肾等器质性病变者;②合并其他恶性肿瘤者;③复发性胃癌患者及其他胃肠道疾病者;④感染、免疫系统疾病、造血系统疾病者;⑤无法配合完成研究者。其中,男44 例,女41 例,年龄平均(61.5±3.8)岁,患者组织类型、Lauren's 分型、肿瘤分化程度、TNM 分期、浸润深度、淋巴结转移、远处转移、血管侵犯患者分布见表2。另选择同期于本院门诊健康体检的志愿者85 例作为对照组,其中男46 例,女39 例,年龄平均(61.1±3.5)岁,均自愿参与本研究,能够配合完成各项检查。本研究获得医院伦理委员会批准通过。
1.2 方法
1.2.1 病理参数统计
统计所有胃癌患者性别、年龄(≤60 岁,>60岁)、组织类型(未分化腺癌、管状腺癌、粘液腺癌、印戒细胞癌)、Lauren's 分型(肠型胃癌、弥漫性胃癌、混合型胃癌)、肿瘤分化程度(低分化、中分化、高分化)、TNM 分期(Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期)、浸润深度(T1、T2、T3、T4)、淋巴结转移(N0、N1、N2、N3)、远处转移(M0、M1)、血管侵犯(有或无)等临床病理参数。
1.2.2 血清指标检测
所有研究对象均收集5 mL 空腹静脉血,3 000 r/min 离心10 min,收集血清。采用酶联免疫吸附试验检测血清uMtCK、AHSG 及NGAL 水平,uMtCK 试剂盒购自上海圻明生物科技有限公司,AHSG 试剂盒购自美国Epitope Diagnostics,Inc 公司,NGAL 试剂盒购自上海依科赛生物制品有限公司。均按照试剂盒说明书所述进行步骤操作,读取吸光度值,绘制标准曲线,并计算血清uMtCK、AHSG 及NGAL 浓度。
1.2.3 随访
所有胃癌患者随访2~3年,统计期间患者任何原因导致的死亡情况,并分为生存组和死亡组,对比2 组胃癌患者血清uMtCK、AHSG 及NGAL 水平差异情况。
1.3 统计学分析
采用SPSS 20.0 统计学软件进行数据分析,计量资料以()表示,两两比较用t检验,多组间采用单因素方差分析;Cox 多因素回归分析影响胃癌患者预后的独立因素。P<0.05 为差异有统计学意义。
2 结果
2.1 研究组和对照组血清uMtCK、AHSG 及NGAL 水平比较
研究组血清uMtCK、AHSG 及NGAL 水平均高于对照组,差异有统计学意义(P<0.05)。见表1。
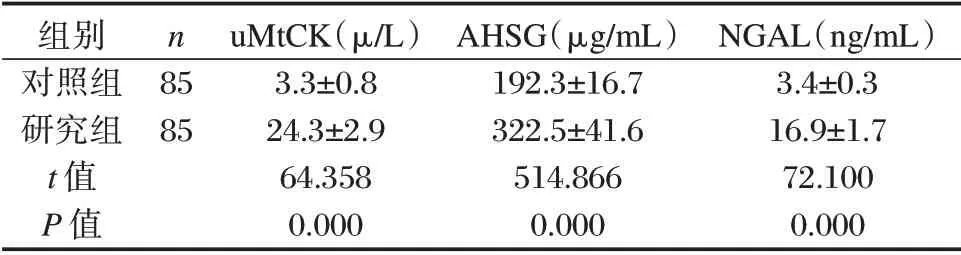
表1 研究组和对照组血清uMtCK、AHSG 及NGAL 比较Table 1 Comparison of serum uMtCK,AHSG and NGAL levels between the study group and the control group
2.2 胃癌患者血清uMtCK、AHSG 及NGAL 水平与临床病理参数的相关性分析
不同年龄、性别、组织类型、Lauren's 分型胃癌患者血清uMtCK、AHSG 及NGAL 水平比较均差异无统计学意义(P>0.05)。不同肿瘤分化程度、TNM 分期、浸润深度、淋巴结转移、远处转移、血管侵犯胃癌患者血清uMtCK、AHSG 及NGAL 水平比较,差异有统计学意义(P<0.05)。见表2。
表2 胃癌患者血清uMtCK、AHSG 及NGAL 水平与临床病理参数的相关性分析(±s)Table 2 Correlation analysis of serum uMtCK,AHSG and NGAL levels and clinicopathological parameters in patients with gastric cancer(±s)
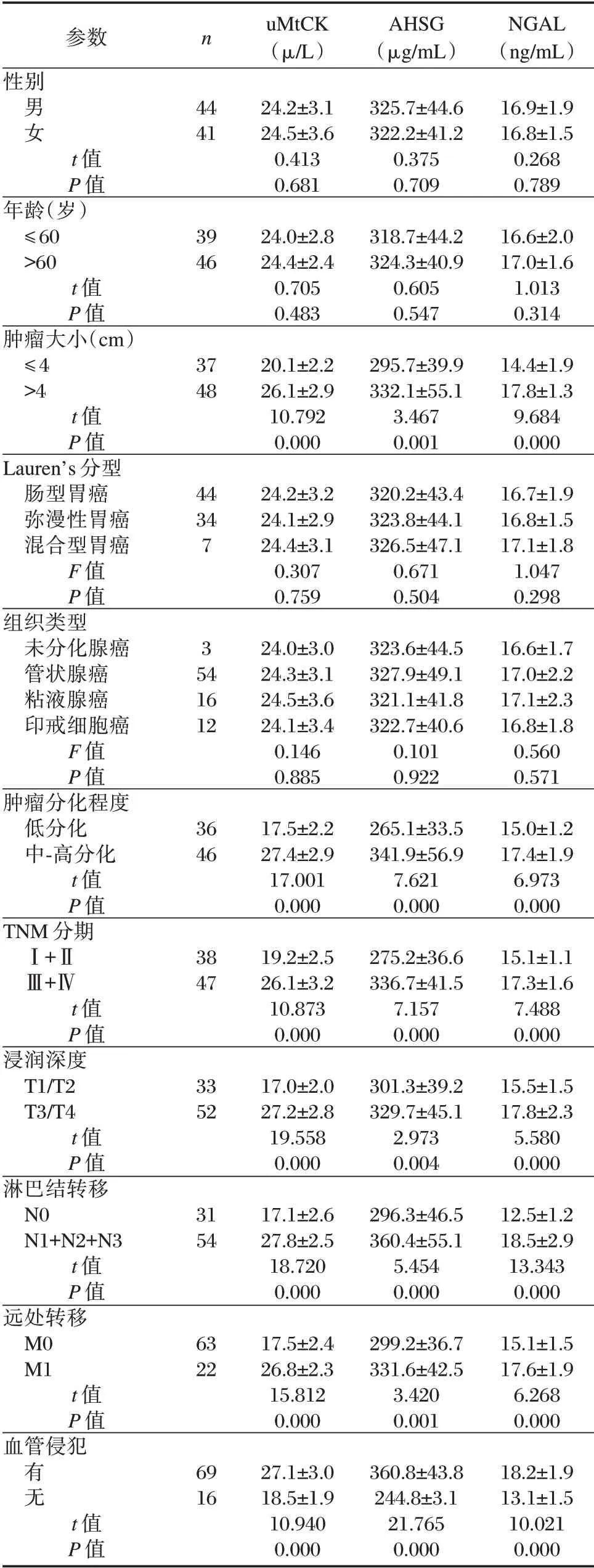
表2 胃癌患者血清uMtCK、AHSG 及NGAL 水平与临床病理参数的相关性分析(±s)Table 2 Correlation analysis of serum uMtCK,AHSG and NGAL levels and clinicopathological parameters in patients with gastric cancer(±s)
参数性别n男女44 41 t 值P 值年龄(岁)≤60>60 t 值P 值肿瘤大小(cm)≤4>4 t 值P 值Lauren's 分型肠型胃癌弥漫性胃癌混合型胃癌F 值P 值组织类型未分化腺癌管状腺癌粘液腺癌印戒细胞癌F 值P 值肿瘤分化程度低分化中-高分化t 值P 值TNM 分期Ⅰ+ⅡⅢ+Ⅳt 值P 值浸润深度T1/T2 T3/T4 t 值P 值淋巴结转移N0 N1+N2+N3 t 值P 值远处转移M0 M1 t 值P 值血管侵犯39 46 37 48 44 34 7 3 54 16 12 36 46 38 47 33 52 31 54 63 22有无69 16 t 值P 值uMtCK(μ/L)24.2±3.1 24.5±3.6 0.413 0.681 24.0±2.8 24.4±2.4 0.705 0.483 20.1±2.2 26.1±2.9 10.792 0.000 24.2±3.2 24.1±2.9 24.4±3.1 0.307 0.759 24.0±3.0 24.3±3.1 24.5±3.6 24.1±3.4 0.146 0.885 17.5±2.2 27.4±2.9 17.001 0.000 19.2±2.5 26.1±3.2 10.873 0.000 17.0±2.0 27.2±2.8 19.558 0.000 17.1±2.6 27.8±2.5 18.720 0.000 17.5±2.4 26.8±2.3 15.812 0.000 27.1±3.0 18.5±1.9 10.940 0.000 AHSG(μg/mL)325.7±44.6 322.2±41.2 0.375 0.709 318.7±44.2 324.3±40.9 0.605 0.547 295.7±39.9 332.1±55.1 3.467 0.001 320.2±43.4 323.8±44.1 326.5±47.1 0.671 0.504 323.6±44.5 327.9±49.1 321.1±41.8 322.7±40.6 0.101 0.922 265.1±33.5 341.9±56.9 7.621 0.000 275.2±36.6 336.7±41.5 7.157 0.000 301.3±39.2 329.7±45.1 2.973 0.004 296.3±46.5 360.4±55.1 5.454 0.000 299.2±36.7 331.6±42.5 3.420 0.001 360.8±43.8 244.8±3.1 21.765 0.000 NGAL(ng/mL)16.9±1.9 16.8±1.5 0.268 0.789 16.6±2.0 17.0±1.6 1.013 0.314 14.4±1.9 17.8±1.3 9.684 0.000 16.7±1.9 16.8±1.5 17.1±1.8 1.047 0.298 16.6±1.7 17.0±2.2 17.1±2.3 16.8±1.8 0.560 0.571 15.0±1.2 17.4±1.9 6.973 0.000 15.1±1.1 17.3±1.6 7.488 0.000 15.5±1.5 17.8±2.3 5.580 0.000 12.5±1.2 18.5±2.9 13.343 0.000 15.1±1.5 17.6±1.9 6.268 0.000 18.2±1.9 13.1±1.5 10.021 0.000
2.3 存活组与死亡组血清uMtCK、AHSG 及NGAL 水平比较
直至本研究随访结束,85 例胃癌患者中存活62 例,死亡23 例。存活组胃癌患者血清uMtCK、AHSG 及NGAL 水平均低于死亡组,差异具有统计学意义(P<0.05)。见表3。
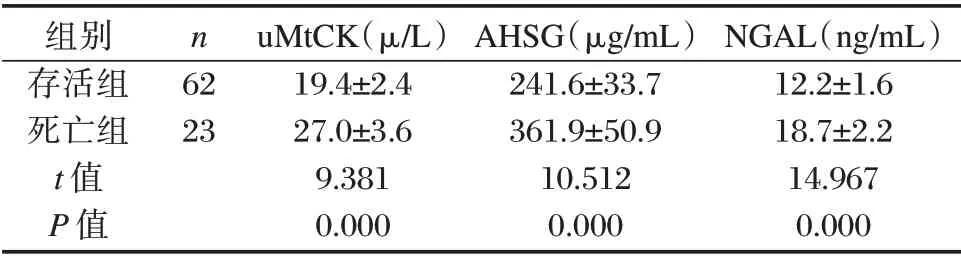
表3 存活组与死亡组血清uMtCK、AHSG 及NGAL 比较Table 3 Comparison of serum uMtCK,AHSG and NGAL levels between the survival group and the death group
2.4 Cox 多因素回归分析
Cox 多因素回归分析结果显示,uMtCK、AHSG 及NGAL 升高为影响胃癌患者预后的独立危险因素。见表4。
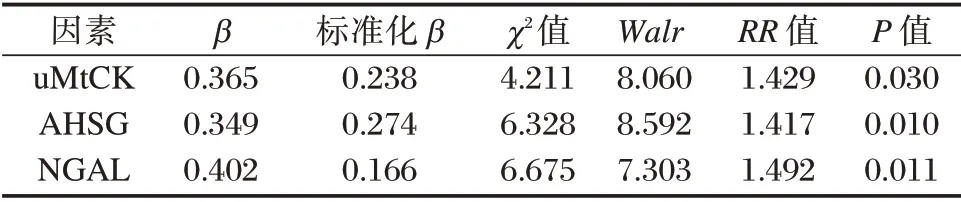
表4 Cox 多因素回归分析结果Table 4 Cox multivariate regression analysis results
3 讨论
近年来,恶性肿瘤的发病率在全球范围内呈逐渐上升的趋势,严重威胁了人类的身体健康和生存质量。胃癌等恶性肿瘤的早发现与其预后关系密切,因此对于临床寻求敏感性和特异性高、无创、易操作的理想肿瘤标志物具有重要意义。
MtCK 为肌酸激酶(creatine kinase,CK)的同工酶之一,可催化肌酸和三磷酸腺苷之间的磷酸键可逆转移并促进三磷酸腺苷的生成。MtCK 又可分为uMtCK 与sMtCK,uMtCK 为低聚的线粒体CK,是巨分子酶的一种,uMtCK 在肾脏、脑和平滑肌等组织或器官中表达,近年来多项研究报道uMtCK 在肿瘤患者病理组织或(和)血清中存在过表达,uMtCK常伴随各种肿瘤出现,提示其可能为一种有效的潜在肿瘤标志物[6-7]。AHSG 是肝细胞合成的一种磷酸化糖蛋白,为半脱氨酸蛋白酶抑制因子超家族成员。AHSG 参与了人体胰岛素抵抗、骨骼代谢调节、恶性肿瘤迁移和侵袭过程[8-9]。研究显示[10],AHSG可介导肿瘤细胞黏附作用,其可激活肿瘤细胞MAP和P13K/AKT 激酶信号,还可介导肿瘤外泌体形成,促进肿瘤细胞生长、运动和侵袭。NGAL 在多种肿瘤发生发展红发挥重要作用,但其在不同肿瘤中的作用有所差异。研究认为[11],NGAL 可抑制机体基质金属蛋白酶降解,参与食管癌、乳腺癌等肿瘤细胞的分化、侵袭和转移,并具有加速肿瘤进程的作用。本研究结果显示,在胃癌患者中血清uMtCK、AHSG 及NGAL 水平相较于健康人群血清水平明显升高,在研究中,NGAL 可作为潜在的新型新型综合治疗靶标[12];Shi 等[13]研究认为,AHSG 与胃癌的发生发展关系密切,可作为为鉴定为胃癌的诊断生物标志物;而等研究对于uMtCK 的生物学特性阐述中指出,其与肿瘤的发生发展及预后的关系密切。
本研究结果提示,血清uMtCK、AHSG 及NGAL与胃癌临床病理特征指标存在密切相关性。uMtCK可提高肿瘤细胞对能量需求的适应性,保护肿瘤细胞抵抗凋亡,并参与线粒体凋亡途径和肿瘤细胞适应性代谢过程。有研究指出[14],AHSG可作为血清化学引诱剂,通过基质胶促进肿瘤细胞的侵袭。研究认为[15],NGAL 还可促进皮-间质转化,从而改变肿瘤微环境,进而在肿瘤的侵袭和转移中发挥作用。本研究中结果提示,血清uMtCK、AHSG 及NGAL 高水平患者往往在近期随访期间面临着更高的死亡风险。Cox 多因素回归分析结果提示,uMtCK、AHSG及NGAL 升高不仅与胃癌额恶性程度及病情严重程度存在相关性,也预示着胃癌患者预后不良,可作为胃癌患者评估病情严重程度和预后的潜在指标。
综上所述,胃癌患者血清uMtCK、AHSG 及NGAL 存在异常升高的情况,且与胃癌进展、转移及不良预后存在密切相关性,检测相关指标水平有助于胃癌患者的诊断和预后评估。

