山莓茎抗氧化及抑制亚硝化作用
谢华松,杨泽森,魏爱红, ,朱铨娣,庄远杯, ,张声源, *
1. 嘉应学院(梅州 514031);2. 广东省山区特色农业资源保护与精准利用重点实验室(梅州 514031);3. 嘉应学院医学院客家药用生物资源研究所(梅州 514031)
各种自由基所引发的氧化损伤是导致体内各组织器官损伤、病变的重要原因之一,人类许多重大疾病如糖尿病、癌症、心脑血管疾病、神经系统退行性病变、动脉粥样硬化等均与由自由基引起的氧化损伤密切相关[1-2]。亚硝胺的前体物质亚硝酸盐和胺类大量存在腌制食物中,这些前体物质在胃液酸性条件下极易转化为亚硝胺,亚硝胺、苯并芘和黄曲霉素是世界公认的三大强致癌物质[3]。研究表明,天然植物中的黄酮、多糖、有机酸、酚类等成分均具有良好的抗氧化活性和抑制亚硝化作用[4-5]。寻找安全有效、新型、天然的抗氧化及抑制亚硝化活性成分成为国内外学者的研究热点,对食品药品行业具有重要意义。
山莓(Rubus corchorifolius)是蔷薇科悬钩子属植物,也叫作龙船泡、牛奶泡、悬钩子、泡儿刺、三月泡、树莓等,广泛分布在中国除东北三省、内蒙古、新疆、西藏以外的其他各省、市、自治区,在海拔300~1 500 m的向阳山坡、溪边、山谷、荒地和灌木丛中生长[6-8]。在中国,山莓作为药用植物有悠久的用药历史,《本草纲目》《本草拾遗》《食疗本草》《名医别录》等多部古代医药典籍里都详细记载山莓的主要功效,且用药部位不一,药效也不尽相同[9]。山莓根性味微苦、辛、平,具有祛风除湿的功效,主治风湿腰痛、痢疾、白带、小儿疳积等症;叶性微苦,具有消肿解毒的功效,主治多发性脓肿、乳腺炎等症;果性味微甘、酸、温,具有涩精益肾、助阳明目之功效,主治肾虚、遗精、遗尿等症[8,10-11]。可见,山莓药用部位不同时,其药效不同,其潜在药用价值较高。
山莓全株含黄酮类、鞣质、香豆素化合物、酚性成分和皂苷等[6],基于国内外研究事实,推测山莓全株有潜在的抗氧化和抑制亚硝化活性,但国内外学者对山莓茎抗氧化、抑制亚硝化活性研究少见报道。试验对山莓茎进行抗氧化和抑制亚硝化活性评价,以期发现其抗氧化和抑制亚硝化活性最佳萃取部位,为山莓潜在的其他药理作用及综合开发利用提供参考价值和科学依据。
1 材料与方法
1.1 植物来源
山莓茎采自广东省梅州市梅江区百岁山。
1.2 试剂
1, 1-二苯基-2-三硝基苯肼(DPPH,上海阿拉丁生化科技股份有限公司);2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,上海阿拉丁生化科技股份有限公司);磷酸二氢钠(NaH2PO4·2H2O,上海阿拉丁生化科技股份有限公司);十二水磷酸氢二钠(Na2HPO4·12H2O,上海阿拉丁生化科技股份有限公司);铁氰化钾(K3[Fe(CN)6],上海阿拉丁生化科技股份有限公司);三氯乙酸(C2HCl3O2,上海阿拉丁生化科技股份有限公司);对氨基苯磺酸(上海阿拉丁生化科技股份有限公司);无水柠檬酸(C6H8O7,上海阿拉丁生化科技股份有限公司);盐酸萘乙二胺(上海阿拉丁生化科技股份有限公司);维生素C(纯度≥98%,西陇科学股份有限公司);其他试剂均为分析纯。
1.3 仪器与设备
UV-1800型紫外-可见分光光度计(日本岛津公司);Q-Gard A2型超纯水仪(德国Millipore公司);BT125D型电子分析天平(德国Sartorius公司);BS110s型电子分析天平(德国Sartorius公司);GL-25M型高速离心机(上海赵迪生物科技有限公司);JP-100S型超声波清洗器(深圳市洁盟清洗设备有限公司);WJX-A1000型高速多功能粉碎机(浙江省永康市红太阳机电有限公司);pHSJ-3F型pH计(上海精科仪器有限公司)。
1.4 试验方法
1.4.1 山莓茎不同极性萃取部位样品的制备
将采摘处理后的山莓茎置于50 ℃烘箱干燥,经粉碎机粉碎,称取的质量为642.51 g,按料液比1︰1(g/mL)加入无水乙醇超声提取3次,合并提取液后减压浓缩得到22.2 g乙醇提取物。取17.2 g乙醇提取物分散于水中,依次用石油醚、乙酸乙酯、正丁醇各萃取3次,收集各个有机层萃取液,进行减压浓缩,干燥,得到石油醚层、乙酸乙酯层、正丁醇层和水层4个不同极性萃取部位,储存于冰箱,备用。
1.4.2 抗氧化活性评价
此部分试验参照国内外期刊曾报道的方法[12-14,17]。
1.4.2.1 DPPH法[12,17]
精密移取1.0 mL不同质量浓度的样品或VC溶液,分别加入1.0 mL 0.1 mmol/L DPPH无水乙醇溶液,置于暗处,室温反应20 min,以无水乙醇溶剂做空白对照,测定其在波长517 nm处的吸光度(Ai);测定1.0 mL 0.1 mmol/L DPPH无水乙醇溶液与1.0 mL无水乙醇混合后在波长517 nm处的吸光度(A0);测定1.0 mL无水乙醇溶液与1.0 mL样品溶液在波长517 nm处的吸光度(Aj)。并根据式(1)计算出样品和VC溶液对DPPH自由基的清除率。
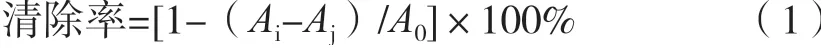
1.4.2.2 ABTS法[13,17]
将7.0 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾等体积混合,置于暗处反应12~16 h,制备得到ABTS工作液。ABTS工作液用10 mmol/L磷酸缓冲溶液(pH 7.4)进行稀释,直到工作液在734 nm处吸光度为(0.70±0.02),避光室温保存备用。分别精密移取100 μL不同质量浓度的样品和VC溶液于试管中,各试管加入3.9 mL ABTS工作液,振荡,于暗处室温反应10 min,测定其在波长734 nm处的吸光度(Ai)。同法测定3.9 mL ABTS工作液与100 μL无水乙醇混合后在波长734 nm处的吸光度(A0),3.9 mL 10 mmol/L磷酸缓冲溶液与100 μL样品溶液在波长734 nm处的吸光度(Aj)。根据公式计算出样品和VC溶液对ABTS自由基的清除率。计算公式同式(1)。
1.4.2.3 普鲁士蓝法[14,17]
精密吸取2.5 mL不同质量浓度的样品、2.5 mL的PBS缓冲液(0.2 mol/L、pH 6.6)和2.5 mL K3Fe(CN)6溶液于10 mL试管中充分摇匀后,在50 ℃下恒温水浴反应20 min,急速冷却,加入2.5 mL三氯乙酸溶液,充分摇匀后转移到10 mL离心管中,在6 000 r/min下离心10 min,取2.5 mL上清液于试管中,依次加入2.0 mL蒸馏水与0.5 mL FeCl3溶液混合均匀。用不同质量浓度的VC标准溶液重复上述操作,以吸光度为纵坐标(Y),以标准VC溶液浓度(μmol/mL)为横坐标(X),绘制标准曲线,试验结果表示为μmol VC/g(即铁还原力大小用每克样品的VC当量表示)。
1.4.3 抑制亚硝化作用评价
此部分试验参照国内期刊曾报道的方法[15,17]。
1.4.3.1 盐酸萘乙二胺法
精密吸取1.0 mL不同质量浓度的样品于25 mL具塞比色管中,分别依次加入2.0 mL pH 3.0的柠檬酸-磷酸氢二钠缓冲液,2.0 mL 5 μg/mL亚硝酸钠溶液,混匀。在37 ℃下水浴1 h,取出,加入2.0 mL 0.4%对氨基苯磺酸,混匀,静置5 min后,各加入1.0 mL 0.2%盐酸萘乙二胺溶液,加蒸馏水至刻度,混匀,静置15 min后在538 nm下测定吸光度,同时用VC做对照试验。根据式(2)计算出样品和VC溶液对亚硝酸盐的清除率。
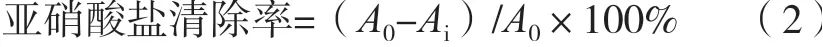
式中:A0为空白反应体系的吸光度;Ai为样品反应体系的吸光度。
1.4.4 数据处理和相关性分析
采用Origin和SPSS对数据进行处理分析,所有试验数据均为3次重复试验结果,以平均值±标准差(x±s)表示。利用单因素方差分析和Duncan法检验多组数据间差异的显著性,以p<0.05为具有统计学显著差异。IC50值是指清除率50%时样品所需要的质量浓度,利用Origin软件根据不同质量浓度样品溶液的清除率绘制曲线并对各曲线线性拟合,进而求出IC50值。
2 结果与分析
2.1 体外抗氧化活性结果
2.1.1 DPPH法
山莓茎各萃取部位对DPPH自由基的清除能力测定结果见图1。山莓茎不同极性萃取部位和VC清除率在一定质量浓度范围内随质量浓度增大而增大,表现出良好的剂量依赖效应。山莓茎各萃取部位的清除率在质量浓度在0.001~0.050 mg/mL范围内增幅较大,乙酸乙酯层、正丁醇层和水层在质量浓度0.050~0.200 mg/mL范围对DPPH自由基的清除能力趋于平衡。与阳性对照物VC对比,山莓茎各萃取部位对DPPH自由基的清除能力均弱于VC。山莓茎各萃取部位对DPPH自由基的清除能力强弱依次为乙酸乙酯层>正丁醇层>水层>石油醚层。质量浓度为0.025 mg/mL时,乙酸乙酯层的清除率为85.14%,正丁醇层、水层和石油醚层分别为58.29%,43.48%和8.97%。
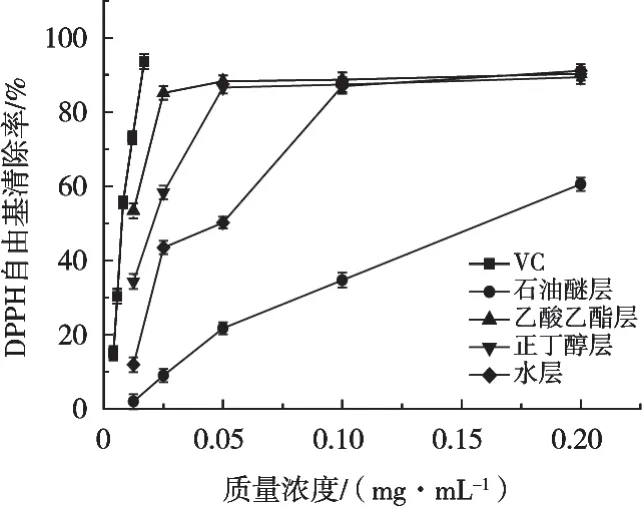
图1 山莓茎对DPPH自由基清除能力的影响
2.1.2 ABTS法
山莓茎清除ABTS自由基能力测定结果及IC50分别见图2和表1。山莓茎不同极性萃取部位及VC的清除率在一定质量浓度范围内随质量浓度增大而增大,表现出良好剂量依赖效应。质量浓度为0.025~0.050 mg/mL时,乙酸乙酯层对ABTS自由基的清除能力趋势大于VC,质量浓度为0.050~0.080 mg/mL时,VC对ABTS自由基能力的清除趋势大于山莓茎各萃取部位。山莓茎各萃取部位对ABTS自由基的清除能力强弱依次为乙酸乙酯层>水层>正丁醇层>石油醚层。质量浓度为0.20 mg/mL时,乙酸乙酯层的清除率为88.30%,正丁醇层、水层、石油醚层分别为43.85%,51.22%和8.99%。
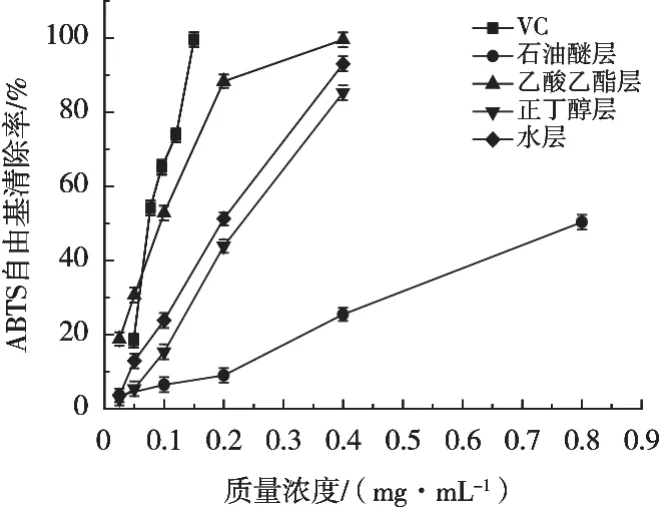
图2 山莓茎各萃取部位及VC 对ABTS自由基的清除能力
表1 山莓茎各萃取部位和VC对ABTS自由基清除能力的IC50值(±s,n=3)
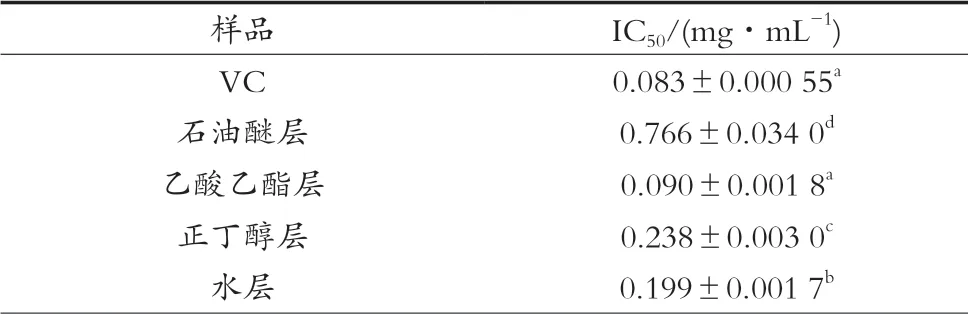
表1 山莓茎各萃取部位和VC对ABTS自由基清除能力的IC50值(±s,n=3)
注: 同竖肩标字母不同表示差异显著 (p<0.05)。
样品 IC50/(mg·mL-1)VC 0.083±0.000 55a石油醚层 0.766±0.034 0d乙酸乙酯层 0.090±0.001 8a正丁醇层 0.238±0.003 0c水层 0.199±0.001 7b
由表1可知,山莓茎各萃取部位对ABTS自由基的清除能力存在显著性差异(p<0.05),乙酸乙酯层对ABTS自由基清除能力比石油醚层、正丁醇层和水层强,但山莓茎不同极性萃取部位对ABTS自由基的清除能力均弱于VC。
2.1.3 普鲁士蓝法
VC对铁离子还原能力的测定结果见图3。以VC质量浓度(mg/mL)为横坐标,吸光度(A)为纵坐标绘制标准曲线,如图3所示,得到回归方程Y=36.768X-0.013 5,R2=0.998 7。根据山莓茎各萃取部位测出的吸光度和标准曲线计算出铁还原能力。
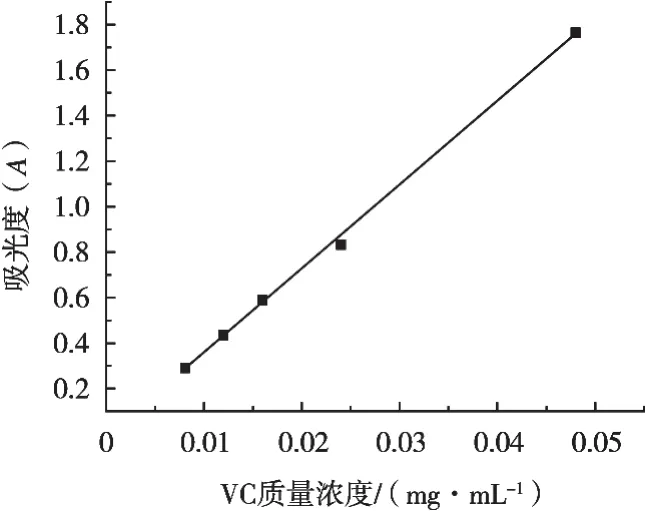
图3 VC的铁还原能力
山莓茎各萃取部位铁还原能力的测定结果见图4。正丁醇层的铁还原能力最强,为(77.08±4.82)μmol VC/g,其次是乙酸乙酯层(57.89±4.32)μmol VC/g、水层(54.67±4.95)μmol VC/g和石油醚层(15.62±1.72)μmol VC/g,图4中的字母不同表示差异显著(p<0.05),用单因素方差分析和Duncan法对山莓茎各萃取部位的铁还原能力处理,结果显示正丁醇层的铁还原能力与VC、石油醚层及乙酸乙酯层存在显著差异(p<0.05),乙酸乙酯层的铁还原能力与水层不存在显著差异(p>0.05)。
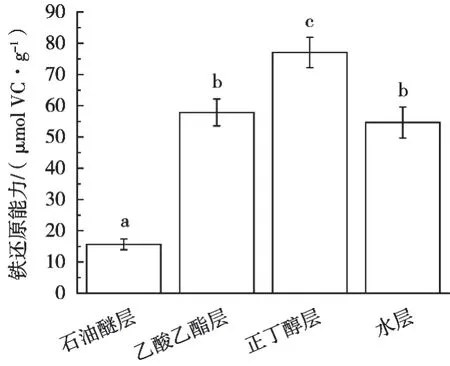
图4 3个产地莲雾果实的铁还原能力
2.2 体外抑制亚硝化作用结果
2.2.1 盐酸萘乙二胺法
山莓茎清除ABTS自由基能力测定结果及IC50分别见图5和表2。在模拟人体胃液条件下,山莓茎不同极性萃取部位对亚硝酸盐表现出一定程度的清除作用,且清除率在一定质量浓度范围内随质量浓度增加而增加,表现出良好的剂量依赖效应。乙酸乙酯层的质量浓度为10 mg/mL时,其对亚硝酸盐的清除率为80.78%,正丁醇层、水层、石油醚层对亚硝酸盐的清除率分别为69.03%,35.45%和16.18%。
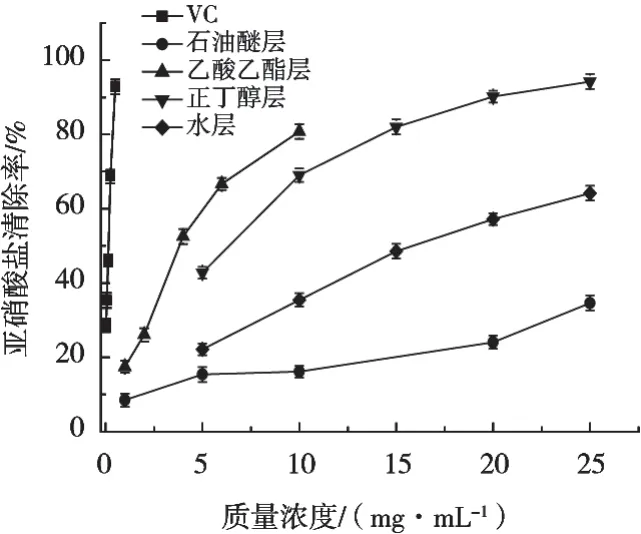
图5 山莓茎各萃取部位对亚硝酸盐的清除率
表2 山莓茎各萃取部位及VC对亚硝酸盐清除作用的IC50值(±s,n=3)
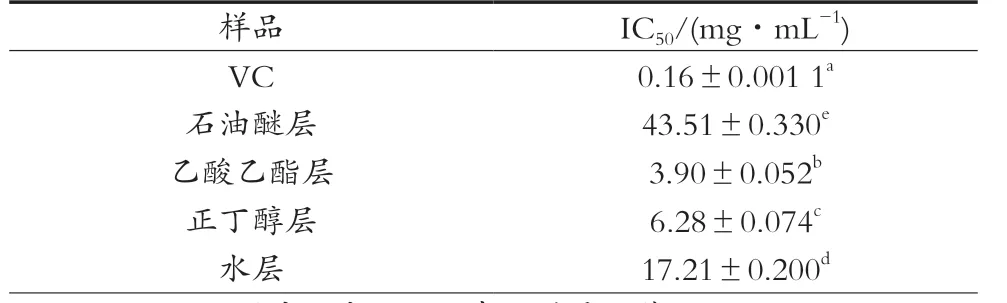
表2 山莓茎各萃取部位及VC对亚硝酸盐清除作用的IC50值(±s,n=3)
注: 同列肩标字母不同表示差异显著 (p<0.05)。
样品 IC50/(mg·mL-1)VC 0.16±0.001 1a石油醚层 43.51±0.330e乙酸乙酯层 3.90±0.052b正丁醇层 6.28±0.074c水层 17.21±0.200d
由表2所示,山莓茎各萃取部位对亚硝酸盐清除能力有显著差异(p<0.05),乙酸乙酯层清除亚硝酸盐的能力最强,但山莓茎各极性部位其清除亚硝酸盐的能力弱于VC(IC50=0.16±0.001 1 mg/mL)。
3 讨论
采用DPPH法、ABTS法和普鲁士蓝法3种方法对山莓茎不同极性萃取部位的抗氧化活性进行评价,结果显示在3种方法中,山莓茎不同极性萃取部位均呈现出不同程度的活性,其中乙酸乙酯层对DPPH自由基、ABTS自由基清除能力最强,正丁醇层的铁还原力能力最强,但是在各个评价体系中抗氧化能力强弱却存在差异,DPPH法的强弱顺序为乙酸乙酯层>正丁醇层>水层>石油醚层,ABTS法的强弱顺序为乙酸乙酯层>水层>正丁醇层>石油醚层,普鲁士蓝法的强弱顺序为正丁醇层>乙酸乙酯层>水层>石油醚层,推测其中原因是抗氧化活性的3个评价方法的原理和作用机制不一样。抑制亚硝化结果显示,在模拟人体胃酸条件下,山莓茎不同极性萃取部位均具有一定的抑制亚硝化能力,乙酸乙酯层对亚硝酸盐的清除能力最强,但乙酸乙酯层、水层、正丁醇层、石油醚层的抑制亚硝化能力均弱于阳性对照品VC。在后续研究中可对乙酸乙酯层进行分离提纯以寻找抑制亚硝化作用活性成分。
4 结论
从天然植物中寻找具有抗氧化和抑制亚硝化作用的活性成分,是药品食品领域的研究热点之一。探究山莓茎4个不同极性萃取部位(石油醚、乙酸乙酯、正丁醇和水层)体外抗氧化、抑制亚硝化活性,由结果可知,山莓茎不同极性萃取部位均有抗氧化作用,乙酸乙酯层对DPPH自由基、ABTS自由基清除能力最强,正丁醇层的铁还原力能力最强;山莓茎各极性萃取部位均有抑制亚硝化作用,乙酸乙酯层是抑制亚硝化作用的最佳萃取部位。试验结果有助于阐明山莓茎药食两用科学内涵,为山莓综合开发利用提供参考价值。

