颌骨多发性嗜酸性肉芽肿长期追踪1例
司钰辰 刘倩 侯海娟 黄萍
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院牙周病科,成都610041
嗜酸性肉芽肿(eosinophilic granuloma)、汉-许-克病 (Hand-Schuller-Christian disease) 和勒-雪病(Letterer-Siwe disease)合称为朗格汉斯组织细胞增生症 (Langerhans cell histiocytosis,LCH)。其中骨嗜酸性肉芽肿最常见[1],可发生于任何年龄,为孤立性或多发性,常侵犯颅骨、肋骨、骨盆、长骨、椎骨、面骨等[2]。其中颌骨嗜酸性肉芽肿临床表现多样,影像学表现无特异性,极难与颌面部的肿瘤、囊肿或牙体牙髓及牙周疾病等鉴别[3-4]。
本文报道1例长期追踪的颌骨多发性嗜酸性肉芽肿病例并回顾相关文献,总结颌骨嗜酸性肉芽肿的发病率、临床表现、组织病理学特点、诊断、治疗及预后等,以提高对该疾病的认识与诊治水平。
1 病例报告
患者,女,37 岁。2003 年1 月因“双侧后牙疼痛松动、咀嚼无力伴牙龈反复肿痛3年”于四川大学华西口腔医院牙周病科就诊。临床检查见,全口牙龈红肿,探诊出血;A6、A7、B6、B7 牙冠完整,探诊深度3~9 mm,松(-);C6 牙远中根颈部探及根面缺损,冷(++),叩(+),C5、C6牙邻接面探诊深度6~9 mm;D5、D6 牙冠完整,探诊深度4~8 mm。X 线片示:D5 远中及D6 近中牙槽骨角形吸收至根尖,呈“深坑状”(图1 左)。诊断:慢性牙周炎;C6、D5、D6牙髓牙周联合病变;C6 牙根外吸收?治疗:牙周基础治疗;C6、D5、D6牙根管治疗及冠修复。
2004 年—2005 年,患者多次复诊,诉牙齿仍有不适伴松动,D5 牙因松动Ⅲ度拔除(图1 右),余牙仍探及深牙周袋,继续行牙周基础治疗并定期复诊,但牙周情况控制不佳。
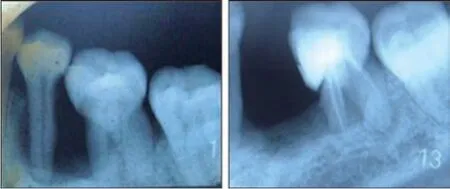
图 1 2003年初诊X 线片(左)及2005年拔除D5牙后X线片(右)Fig 1 Radiographs at first diagnosis in 2003(left)and after D5 extraction in 2005(right)
2009 年7 月患者因“左耳流脓20 年伴听力下降,突眼3 年伴血性分泌物1 月”于外院就诊。辅助检查:颞骨CT 示左侧中耳乳突破坏,左颞颌关节窝、颞鳞部及岩部大面积骨质破坏,左侧蝶窦骨质破坏,左侧蝶孔区密度增高,左侧眼眶后壁骨质缺损,左中颅窝前壁、左眼眶上壁及左颞骨鳞部骨质破坏(图2 上)。MRI 示:颅骨局限性骨质破坏,病变区长T 信号增强明显(图2 中)。实验室检查:血沉加快,嗜酸粒细胞增加。初步诊断为:颌骨嗜酸性肉芽肿。治疗方案:全麻下行左侧乳突入路扩大颞骨切除,颧骨肿物切除。病理诊断:左侧乳突腔、左侧颞骨朗格汉斯组织细胞增生症(图2 下);免疫组织化学示:肿瘤细胞CD1a(+++),CD68(局部+),S-100(+++)。
2009 年 8 月查体见右耳后约 2 cm×1.5 cm 包块,质中,轻度压痛,移动度差。CT 示右侧颞骨可见一孔状缺损,全麻下行右颞部嗜酸性肉芽肿切除术。2009 年10 月查体见颈部多个包块,行放射治疗。
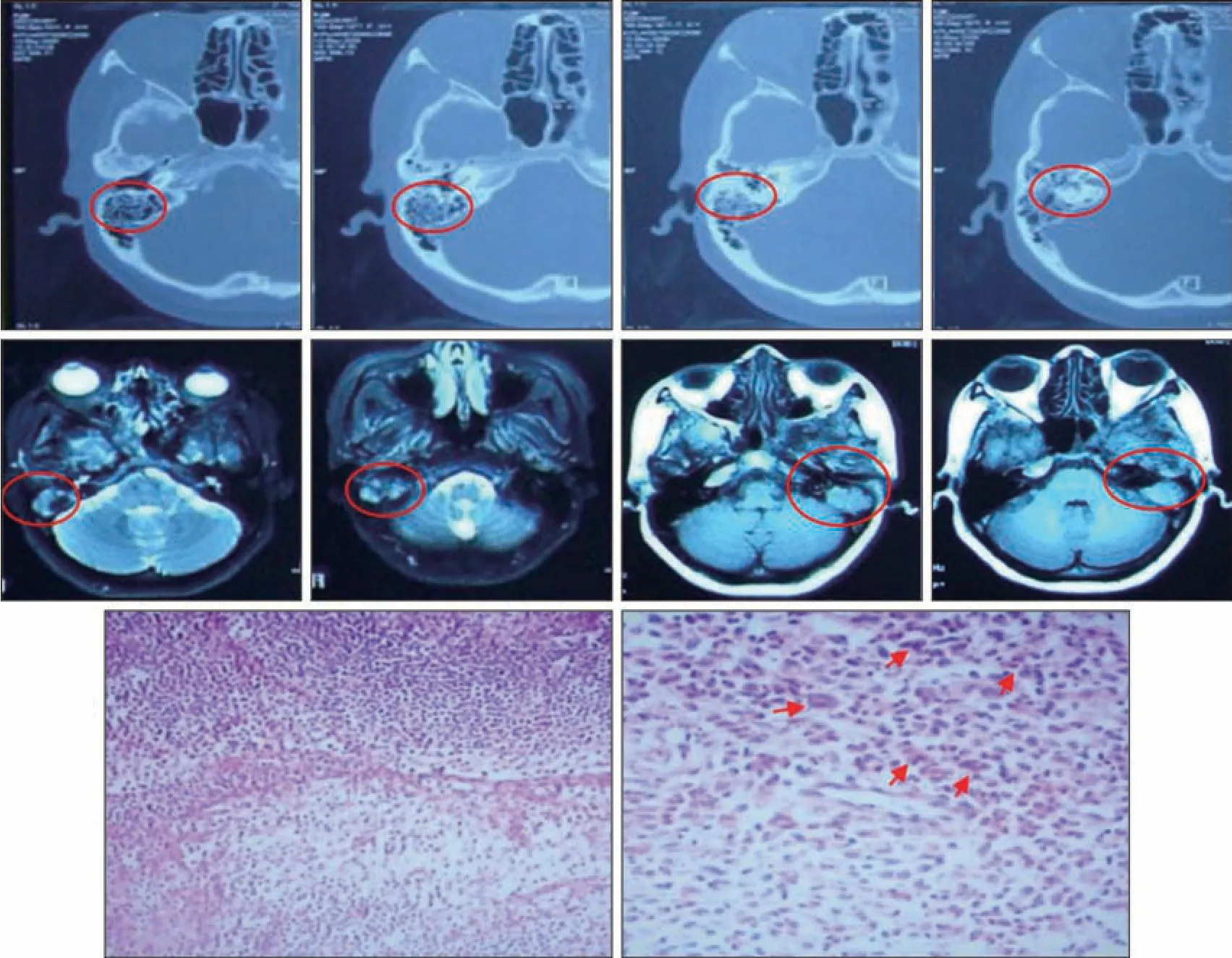
图 2 2009年确诊为颌骨嗜酸性肉芽肿Fig 2 The patient was diagnosed with eosinophilic granuloma of the jaw in 2009
2009 年11 月患者于牙周科复诊。全景片示:A6、B6牙槽骨吸收至根尖1/3,C6牙远中根吸收,D6 牙近中根吸收(图3 左)。诊断:慢性牙周炎伴颌骨嗜酸性肉芽肿;C6、D6 牙根外吸收。治疗:分次行C5-C7、D5-D7牙翻瓣术+同期C6、D6牙拔除,并取C6 牙周围牙槽骨送病理检查(图3 中、右)。病理检查示:正常牙槽骨、牙骨质,可见肉芽组织,未见明显的嗜酸性粒细胞。血液检查:白细胞、红细胞正常,嗜酸性粒细胞略高,在正常范围内,可能与近期接受放疗有关,建议密切观察。
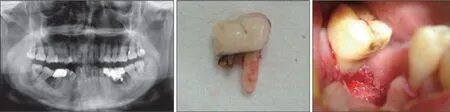
图 3 2009年牙周手术相关检查及治疗Fig 3 Relevant examination of periodontal surgery in 2009
2011 年9 月患者复诊,诉“左右后牙牙龈溃烂”,检查见A6、A7、B6、B7牙颊腭侧、C7牙舌侧牙龈溃烂,无触压痛(图4 上)。根尖片见A6、A7、B6、B7 牙槽骨吸收至根尖,C7 牙近中可见坑凹状骨质密度降低影(图4 中)。锥形束CT 示A6、A7、B6、B7 牙槽骨吸收破坏至根尖,双侧上颌窦底部均已穿透,左侧上颌窦底部破坏明显,双侧上颌窦下份黏膜增厚。C7 牙近中部分牙槽骨不规则吸收。A8、B8、C8阻生牙,紧邻上述骨质破坏及病变区域。转颌面外科诊治,行手术治疗。全麻下行A6A7A8、B6B7B8、C7C8 牙拔除术+双侧上颌骨及右下颌骨病变刮除术。术后病理诊断:右上颌、左上颌、右下颌骨朗格汉斯细胞组织增生症(图4 下)。免疫组织化学:S-100(+),CDla(++),Langerin(+),CD20(-),CD68(+)。基因检测:BRAF V600E基因突变,突变频率10%。
2012 年至2019 年,于牙周科定期牙周维护治疗。
2020 年2 月患者复诊,口内牙龈愈合良好(图5 左)。全景片及CBCT 示C1、D1 牙根尖见低密度影像(图5 中、右)。此时患者已明确诊断颌骨多发性嗜酸性肉芽肿,结合该患者病史,高度怀疑C1 到D1 牙整个区域颌骨多发性嗜酸性肉芽肿。建议密切观察。
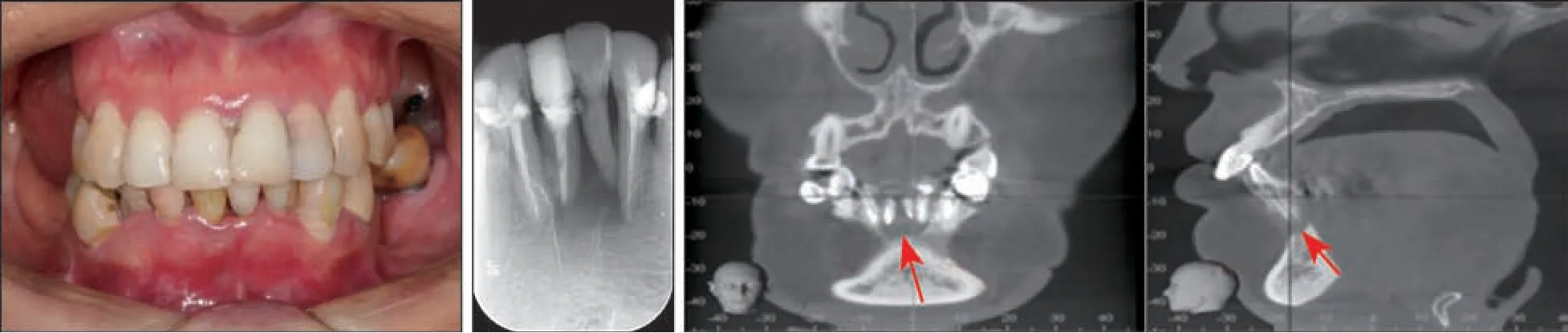
图 5 2020年复诊口内照及影像学检查Fig 5 Oral photographs and radiographic examinations of patient in 2020
2 讨论
嗜酸性肉芽肿是朗格汉斯组织细胞增生症的一种,以骨嗜酸性粒细胞肉芽肿最为常见,占50%~60%[1],可发生于任何年龄[2],主要表现为骨的孤立性或多发性病损,预后良好。其中,发生于颌骨的嗜酸性肉芽肿因其容易累及重要器官,常带来较大危害,且临床表现及影像学表现与颌骨常见疾病相似,极易误诊漏诊。和其他两类朗格汉斯组织细胞增生症一样,该病发病机制不明,主要以骨组织中病理性朗格汉斯细胞异常克隆增生为主[5]。2010 年 Badalian-Very 等[6]首次在 56% 的LCH 患者中发现BRAF V600E 突变,提示该病可能是克隆性肿瘤性疾病。
2.1 临床及影像学表现
颌骨嗜酸性肉芽肿临床表现无特异性,与发病部位有关。发生于口腔内者,常见以下症状:牙龈肿胀、萎缩、溃烂伴疼痛;或牙齿松动、疼痛,牙槽骨不规则吸收、附着丧失,出现深牙周袋等,此时易误诊为侵袭性牙周炎或慢性牙周炎;也可能表现为牙槽突肿胀触痛或患区牙痛,拔牙后疼痛无缓解[7]或拔牙创口不愈合等[8]。发生于颌骨者:可出现颌骨膨隆肿胀、疼痛等,此时易误诊为颌骨囊肿、骨肉瘤等疾病;当颌骨破坏严重时可出现病理性骨折[9]。病变区周围淋巴结可伴有肿大[10]。
其影像表现分为3 类[11]:即牙槽突型、颌骨体型以及混合型。牙槽突型主要表现为牙槽嵴不规则性破坏吸收,骨吸收严重者病变区牙可呈“漂浮状”,类似牙周炎影像表现。颌骨体型主要表现为颌骨溶骨性或穿凿性破坏,单囊或多囊,骨破坏边缘不清晰;颌骨下缘可呈现“船底状”[12],有时可出现骨膜反应[13],易误诊为骨肉瘤;病变累及皮质骨时,可出现骨皮质连续性破坏,病理性骨折形成。混合型时上述影像学表现均可出现。当颌骨嗜酸性肉芽肿位于牙槽骨或根尖处且范围较小时,易误诊为牙周炎、根尖周炎或颌骨囊肿。当病变范围较大或呈多灶性时,易误诊为颌骨骨髓炎或恶性肿瘤。
回顾本文病例,患者2003 年初诊时,因其临床表现及影像学检查与常见的牙周炎类似,因此诊断为“慢性牙周炎”,并进行常规牙周基础治疗,但病情反复、疗效欠佳,且双侧后牙骨质破坏加重。直到2009年患者出现了显著的颞部病变,才确诊为嗜酸性粒细胞肉芽肿。因此高度怀疑,患者在2003 年就诊时,就已患有颌骨多发嗜酸性粒细胞肉芽肿,但因其临床表现及影像学检查无特异性,因此未进一步进行相关筛查。
2.2 诊断及治疗
颌骨嗜酸性肉芽肿的确诊主要依据病理诊断[5,12]。组织病理学表现为受累部位大量组织细胞增生、嗜酸性细胞浸润[14]。免疫组织化学中,CD1a、S-100 蛋白和HLA-DR 等可作为朗格汉斯细胞的免疫组织化学标志物[2]。1987年国际组织细胞协会提出朗格汉斯组织细胞增生症的诊断标准:光学显微镜下朗格汉斯细胞浸润,同时电镜下病变细胞胞质存在Birbeck 颗粒或(和)病变细胞表面CD1a 染色阳性[15]。大部分患者实验室检查可发现嗜酸性粒细胞增加或血沉加快等。
颌骨嗜酸性肉芽肿为良性病变,有一定自愈性,预后良好[16-17],但也存在1.6%~25%的复发率[3],BRAF V600E 基因突变会导致该病的复发风险增加[18]。该病的治疗方法包括手术治疗、放疗及化疗。手术治疗以刮除术为主,常用于较易到达的孤立性病灶[4],可最大限度保留颌骨,减少颌骨缺损。但因刮治时的安全边界不清,刮治不彻底,可能引起复发[12-13]。对于大的骨缺损导致骨连续性破坏或当病灶区呈多发性,刮除术可能引起病理性骨折时,可行颌骨切除术并同期骨移植,以恢复功能和外形[19-20]。放疗多用于手术不易达到的部位,或在手术治疗后小剂量使用放疗,以降低复发的风险。对于放疗的剂量,目前无统一的标准。Bhaskar 等[21]推荐其最大剂量为l 000 cGY,对发育中的儿童患者应严格控制放疗剂量或尽量避免放疗。化疗多用于手术治疗及放疗后复发的病例或弥散性的嗜酸性肉芽肿病例,其远期效果还有待进一步观察。
结合该病例,患者2009 年颞部手术治疗采用扩大切除术,考虑到该类疾病多属良性病变,因此该手术方案仍然值得商榷,应谨慎选择手术方式。同年11 月,牙周手术后病理结果未见嗜酸性粒细胞浸润,血常规也示嗜酸性粒细胞在正常范围,可能与患者近期放疗有关。2011 年患者颌面外科术后再次确诊为颌骨嗜酸性粒细胞肉芽肿,并发现伴有BRAF V600E 基因突变,突变频率10%。因此,该患者颌骨散在多发、反复发作的嗜酸性粒细胞肉芽肿,可能与其基因突变有一定关系,推测该患者今后仍然存在较高复发风险。2020 年锥形束CT 示C1-D1 牙根尖区域见低密度影像,结合病史,高度怀疑C1-D1 牙区嗜酸性粒细胞肉芽肿复发,考虑该病多系良性病变,暂不考虑手术,因此建议患者密切观察。
2.3 伴有BRAF V600E 基因突变的颌骨嗜酸性肉芽肿
BRAF 基因是RAF 基因家族之一,其第15 外显子1 799 位核苷酸可发生T→A 转换突变,即密码子600 突变(如V600E)。BRAF V600E 可通过激活RAS/RAF/MAPK 信号通路,调节细胞周期、增殖、分化和凋亡等,是细胞恶性变的标记之一[22]。BRAF V600E 表达在 25%~60% 的 LCH 病例中出现[23-25]。Wei 等[26]及程晓华等[27]报道中国成人LCH 患者中BRAF V600E 阳性率分别为56%和58%。Berres 等[28]发现 BRAF V600E 基因突变发生在髓系树突状细胞中会形成高风险的LCH,提示BRAF 基因和LCH 预后密切相关。研究证实,BRAF V600E 基因突变会导致LCH 预后变差[29]或复发风险增加[18],但也有研究[24-25,30]认为基因突变与临床预后无关。
BRAF V600E基因小分子抑制剂,如威罗菲尼(Vemurafenib)和达拉菲尼(Dabrafenib),靶向治疗BRAF V600E 阳性的黑色素瘤已取得显著疗效[31-32]。目前也有研究[33-34]表明,BRAF 抑制剂可减少BRAF V600E 突变的LCH 患者的复发。威罗菲尼治疗BRAF V600E 阳性的LCH 研究的开展[33-35],可能为反复发作和难治性LCH 患者带来希望。
结合本病例,该患者伴有BRAF V600E 基因突变,因此本病例患者颌骨嗜酸性肉芽肿多次复发,可能与该基因突变相关。如若BRAF抑制剂可减少BRAF V600E 突变的LCH 患者的复发,那么能一定程度上改善该患者的复发风险及生活质量,但仍然需要大量的临床实验评估其治疗潜力和必要的治疗时间。
利益冲突声明:作者声明本文无利益冲突。

