体外沉默异戊二烯基半胱氨酸羧基甲基转移酶基因对舌鳞状细胞癌迁移和侵袭的影响
周男 迟增鹏 李文健 赵开 王少如 王奇民 童磊 何宗轩 韩红钰 王莹 陈正岗
1.潍坊医学院口腔医学院,潍坊261021;2.大连医科大学口腔医学院,大连116044;3.青岛大学口腔医学院,青岛266003;4.青岛大学附属青岛市市立医院口腔医学中心,青岛266071;5.青岛大学附属医院口腔颌面外科,青岛266005;6.济南市第四人民医院口腔科,济南250031
舌鳞状细胞癌(tongue squamous cell carcino‐ma,TSCC)是最常见、最恶性的口腔癌之一,生存率低、发病率高,并且年轻患者发病率呈上升的趋势[1],其具有很强的快速局部转移和侵袭的倾向[2],患者经系统治疗后预后较差[3]。目前,TSCC的治疗主要采用手术、放疗和化疗相结合的综合治疗模式。随着基础研究发展,各种肿瘤生物治疗方法,尤其是靶向治疗技术发展较快。
Rho 蛋白是小GTPase 的Ras 超家族成员,其功能是二磷酸鸟苷(guanosine diphosphate,GDP)和三磷酸鸟苷(guanosine triphosphate,GTP)调节的开关[4-5]。活性的RhoGTPases 能与下游效应子结合,刺激控制肌动蛋白重组并调节细胞形状、极性、动力、黏附以及信号通路等多种功能[6]。Rho蛋白的羧基端有CAAX序列(其中C代表半胱氨酸,A是脂肪族氨基酸,X 是末端任意氨基酸),Rho 蛋白的活化和定位是通过CAAX 序列的翻译后修饰决定的。首先进行半胱氨酸残基的异戊二烯化,然后进行AAX 序列的蛋白水解。异戊二烯基半胱氨酸羧基甲基转移酶(isoprenylcysteine car‐boxylmethyltransferase,ICMT) 参与翻译后修饰的最后一步,即催化异戊烯化半胱氨酸的羧基甲基化,这种翻译后修饰对维持信号蛋白的正常功能具有重要意义[7]。Ras超家族的GTPase 家族成员几乎都含有CAAX 基序,其中Rho 家族与肿瘤的侵袭转移关系密切[8-9],而ICMT 可调节RhoGTPases(如RhoA、Rac1)的正确膜定位和活性[10]。因此,抑制CAAX蛋白翻译后甲基化的酶ICMT是肿瘤治疗的一个有希望的靶点。本研究通过探讨IC‐MT 对人 TSCC CAL-27 和 SCC-4 细胞迁移及侵袭的影响及相关通路,为其的靶向治疗提供一定的参考依据。
1 材料和方法
1.1 主要材料和试剂
人TSCC 细胞系CAL-27 购于中南大学高等研究中心,人SCC-4 细胞系由山东大学口腔医学院馈赠,Dulbecco’s改良培养基(dulbecco’s modified eagle medium,DMEM)高糖培养基、胰蛋白酶(Gibco公司,美国),胎牛血清(BI公司,以色列),青霉素、链霉素(Gibco 公司,美国),TB Green Premix Ex TadTM试剂盒(TAKARA 公司,日本),实时定量聚合酶链反应(polymerase chain reac‐tion,PCR)引物ICMT、RhoA、磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAP‐DH)合成(上海生工生物工程有限公司),小干扰RNA(small interfering RNA,siRNA)片段设计、合成、脂质体转染试剂(广州锐博生物科技有限公司)。兔抗人多克隆抗体ICMT(Proteintech 公司,美国),兔抗人多克隆抗体RhoA、基质金属蛋 白 酶 (matrix metalloproteinase, MMP) -2、MMP-9(Abcam 公司,英国),兔抗人多克隆抗体Rho 关联含卷曲螺旋结合蛋白激酶1(recombinant Rho associated coiled coil containing protein kinase 1,ROCK1)、GAPDH(CST 公司,美国),羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗(CST 公司,美国),细胞膜蛋白与细胞浆蛋白抽提试剂盒(上海碧云天生物技术有限公司),Tran‐swell小室(Corning公司,美国)。
1.2 细胞培养
CAL-27 和 SCC-4 细胞于 5 mL 含 10% 胎牛血清、1%青霉素和链霉素的DMEM培养基的培养瓶(25 cm2)中培养,放置于37 ℃、5%CO2恒温培养箱中。瓶底细胞长至约90%后,弃原培养基,磷酸盐缓冲溶液(phosphate buffer saline,PBS)冲洗,加入1 mL 胰蛋白酶置于37 ℃环境下消化3~5 min,显微镜下观察到细胞间隙增大,胞质回缩后立即加入等量的含血清培养基终止消化,按顺序吹打瓶底细胞,避免出现气泡,将细胞悬液吸取至 15 mL 离心管中 1 000 r·min-1离心 5 min,弃上清,向离心管中加入10 mL 培养基,反复吹打为单细胞悬液,按1∶2的比例传代至新培养瓶中。
1.3 siRNA转染
构建3 条针对ICMT 基因序列的特异性ICMT-siRNA(表1)和1 条阴性序列作为对照。转染分组分为实验组(细胞转染ICMT-siRNA),空白组(细胞仅加转染试剂,不转染siRNA),阴性对照组(细胞转染无关siRNA 序列)。转染前1 d 将对数生长期的 CAL-27 和 SCC-4 细胞以每孔 5×105个的密度接种于6 孔板,细胞密度长至30%~50%进行转染。严格按照转染说明书进行操作。转染48 h后,检测基因的表达。
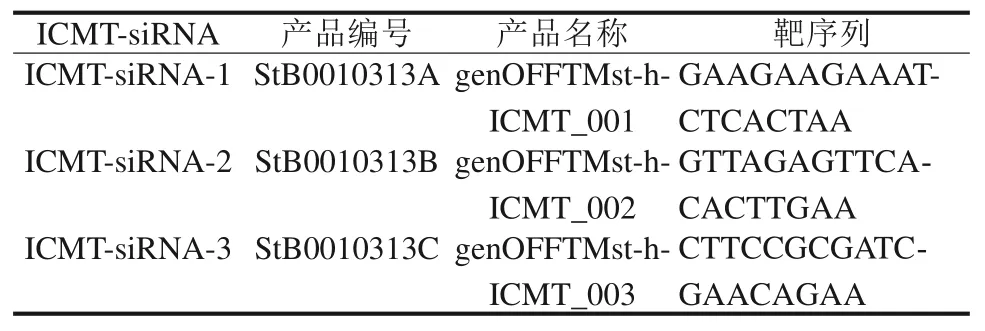
表 1 针对ICMT基因序列设计3条ICMT-siRNATab 1 Three ICMT-siRNA sequences designed for IC‐MT gene
1.4 qRT-PCR检测各组ICMT、RhoA的mRNA表达
每组细胞转染48 h 后,分别提取各组细胞的总RNA,并使用紫外光分光光度计以测定RNA 的含量。反转录合成互补DNA(complementary DNA,cDNA),以此cDNA为模板行PCR扩增反应。GAPDH为内参照。ICMT引物序列:上游5’-CGGCATCCTTCTTACGTCGG-3’,下游5’-CCACACTGTCAGGGCATAGC-3’;RhoA 引物序列:上游 5’-TGTGGCAGATATCGAGGTGGATGG-3’,下游5’-GGCCTCAGGCGATCATAATCTTCC-3’;GAPDH引物序列:上游5’-GCACCGTCAAGGCTGAGA‐AC-3’,下游5’-TGGTGAAGACGCCAGTGGA-3’。PCR 反应条件:95 ℃ 30 s,然后 95 ℃ 5 s,60 ℃30 s,共40 个循环。由ABIPRISM 7000 荧光定量PCR 仪完成自动荧光信号实时监测及数据分析。利用 2-ΔΔCt公式计算 mRNA 相对表达量,其中 ΔCt=Ct目的基因-Ct内参基因、ΔΔCt=ΔCt实验组-ΔCt对照组,Ct 值即循环阈值。根据ICMT 的mRNA 的表达明确沉默效率以进行后续实验。
1.5 蛋白质免疫印迹法检测蛋白的表达
提取转染48 h 后的各组细胞的总蛋白以及膜蛋白,二喹啉甲酸(bicinchoninic acid,BCA)试剂盒测定蛋白质的浓度。100 ℃下变性5 min,每泳道等量上样50 μg 蛋白用10%聚丙烯酰胺凝胶电泳分离,电泳后用湿转法转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂牛奶室温摇床封闭PVDF 膜1 h 后,加入一抗(ICMT,1∶1 000;RhoA,1∶5 000;ROCK1,1∶1 000;MMP-2,1∶1 000;MMP-9,1∶1 000;GAPDH,1∶5 000),4 ℃过夜。用三羟甲基氨基甲烷缓冲盐水 (triethanolamine buffered saline,TBST) 洗膜后与IgG 二抗(1∶50 000)室温孵育2 h,再用TBST 洗膜3 次,电化学发光法显色、曝光。用Image J软件分析蛋白条带的灰度值。
1.6 Transwell侵袭实验
将已铺好基质胶的Transwell 小室置于24 孔板,上室与下室分别加入500 μL 无血清培养基,37 ℃培养箱水化2 h。已转染的细胞消化、离心后,PBS 冲洗,加入无血清培养基重悬成单细胞悬液,计数使密度调整为每毫升3×105个,上室加入 500 μL 细胞悬液,下室加入 750 μL 含血清培养基,置培养箱48 h 取出,PBS 冲洗,干棉签轻擦去上室未迁细胞,PBS冲洗。甲醛室温固定30 min,吸干固定液,0.1%结晶紫染色30 min。PBS 冲洗,置显微镜下观察拍照,随机选取5个不同视野计数穿膜细胞数,取均值,实验重复3次。
1.7 细胞划痕实验
将已转染的细胞接种于6孔板,培养至细胞密度达90%时,用200 μL 枪头在中央沿直尺垂直划痕。PBS冲洗3次,加无血清培养基于培养箱内培养,于显微镜下分别观察0、24、48 h 的划痕愈合情况并拍照,计算24 h 及48 h 的相对愈合面积,即0 h 划痕面积分别减去24、48 h 的划痕面积,其差值分别除以0 h划痕面积。实验重复3次。
1.8 统计学分析
用SPSS 22.0 软件分析各组结果,计量资料两两比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 ICMT、RhoA的mRNA表达水平
实时荧光定量PCR 结果显示,转染ICMT-siR‐NA 后实验组ICMT 的mRNA 表达水平明显下降(P<0.05)。各实验组mRNA 表达量相比,ICMT-siRNA-1 和ICMT-siRNA-3 两组沉默效率较高,作为实验组进行下一步研究。RhoA 的mRNA 表达各组的差异无统计学意义(P>0.05)(图1)。
2.2 蛋白的表达水平变化
蛋白质免疫印迹实验结果显示,实验组ICMT蛋白表达水平明显下降(P<0.05),RhoA 蛋白各组表达水平无明显改变(P>0.05);实验组RhoA膜蛋白表达水平明显下降(P<0.05),ROCK1蛋白表达下降(P<0.05),MMP-2、MMP-9 的表达降低(P<0.05)(图2、3)。
2.3 ICMT-siRNA对细胞迁移能力的影响
细胞划痕实验显示(图4),24、48 h 的实验组相对愈合面积均明显小于空白、阴性对照组,差异有统计学意义(P<0.05),表明细胞的迁移能力降低。
2.4 ICMT-siRNA对细胞侵袭能力的影响
Transwell侵袭实验示(图5),转染48 h后实验组侵袭细胞数明显低于空白、阴性对照组,差异有统计学意义(P<0.05),表明细胞侵袭能力降低。
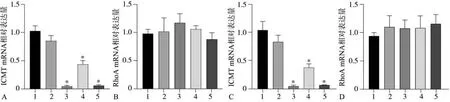
图 1 转染ICMT-siRNA后ICMT、RhoA mRNA的表达Fig 1 Expression of ICMT and RhoA mRNA after ICMT-siRNA transfection
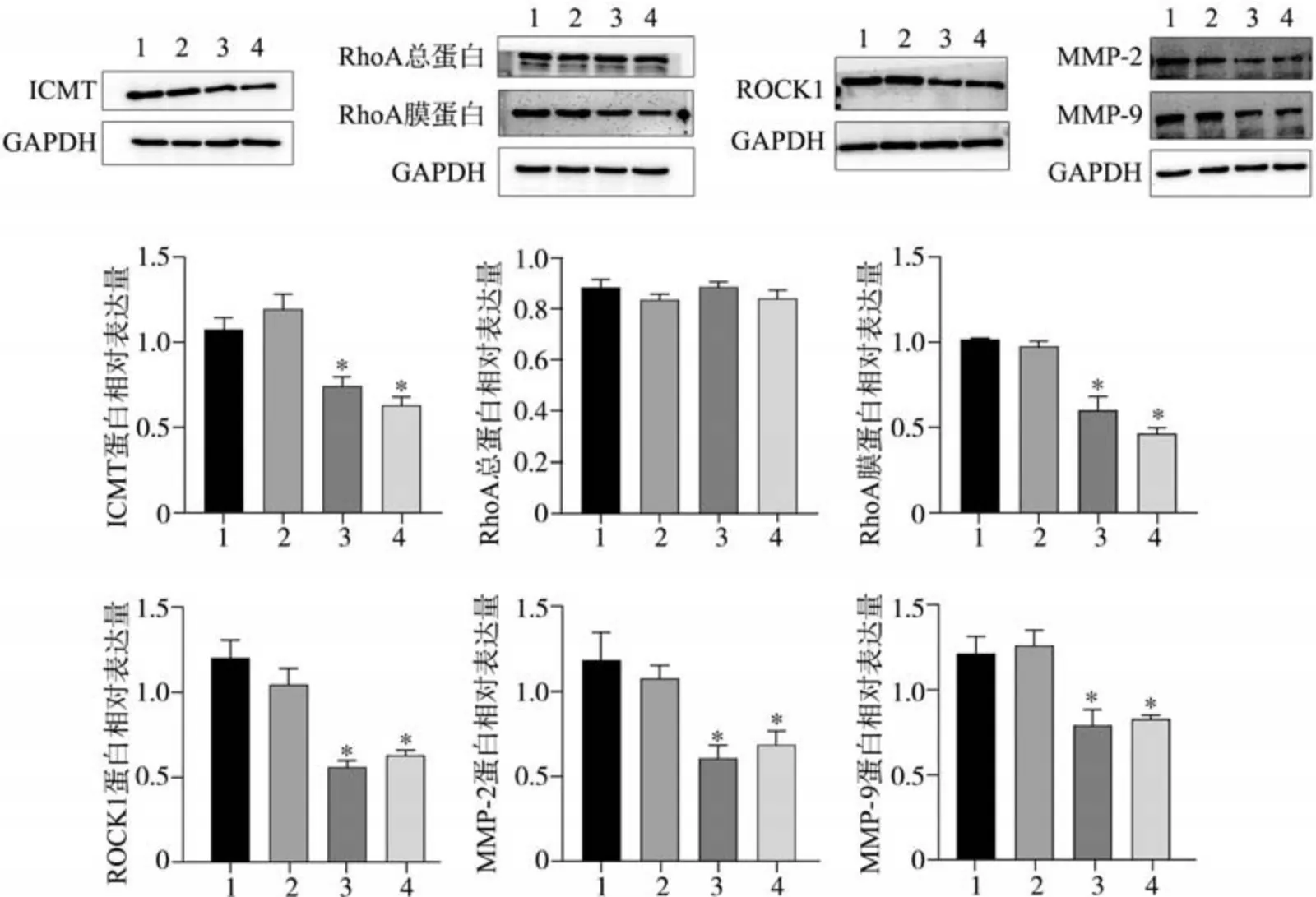
图 2 CAL-27细胞转染ICMT-siRNA后蛋白的表达Fig 2 The Expression of protein after ICMT-siRNA transfection of CAL-27 cells

图 3 SCC-4细胞转染ICMT-siRNA后蛋白的表达Fig 3 The Expression of protein after ICMT-siRNA transfection of SCC-4cells
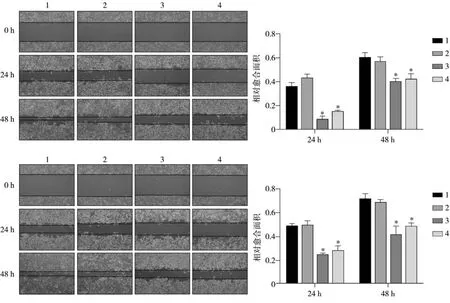
图 4 划痕实验结果 倒置相差显微镜 ×40Fig 4 The results of scratch test inverted phase contrst microscope × 40
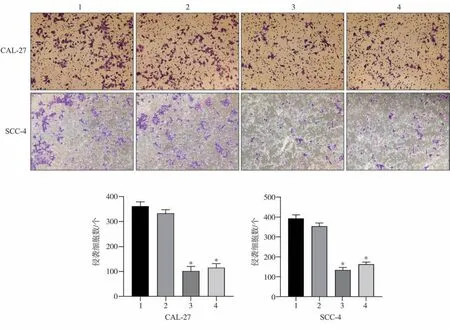
图 5 Transwell侵袭实验结果 倒置相差显微镜 ×100Fig 5 The results of Transwell invasion assay inverted phase contrast microscope ×100
3 讨论
口腔癌是全球的第六大恶性肿瘤,近90%的口腔癌为口腔鳞状细胞癌。TSCC 约占原发性口腔鳞状细胞癌的30%,随着年龄的增长和临床分期的增加,生存率逐渐下降[11]。局部浸润和远处转移是死亡的主要原因,因此探讨促进其浸润和转移的分子机制很有必要。
蛋白质的翻译后修饰在细胞生物学的许多方面起着至关重要的作用。ICMT 作为一种翻译后修饰的酶,主要修饰CAAX 蛋白,包括小GTPase,如Ras和Rho蛋白[12]。ICMT 的甲基化对Ras和Rho蛋白在细胞中的正确膜定位和活化至关重要。Rho蛋白能够通过影响肌动球蛋白聚合和收缩、细胞黏附等来调控细胞的形态和运动[13]。有研究[14]表明,当ICMT 活性降低时,影响Rho 蛋白甲基化,RhoGDI 与Rho 蛋白的结合亲和力增强从而削弱了RhoGTP 结合和激活Rho 蛋白的能力,从而抑制Rho 蛋白信号转导和Rho 蛋白介导的生物学行为,该研究明确了ICMT催化的甲基化在肿瘤细胞转移中的作用。
RhoA 是Rho 家族的一个成员,在乳腺癌、胃癌、头颈鳞状细胞癌、膀胱癌、结直肠癌和宫颈癌中高表达[15-20]。对鼻咽癌的研究[21]表明,抑制ICMT 可抑制鼻咽癌细胞的RhoA 活性,从而抑制RhoA 介导的下游信号转导。并且有研究[22]发现,抑制ICMT 甲基化减少了高转移MDA-MB-231 乳腺癌细胞系的侵袭和迁移,其影响归因于RhoA 功能受损,从而进一步阐明了甲基化在RhoGTPases功能中的作用。此外还有研究[23-24]证实,ICMT 在肺癌、胰腺癌中发挥重要作用,但其对口腔鳞状细胞癌的影响尚未见相关报道。
本实验将ICMT-siRNA 转染至TSCC CAL-27和SCC-4 细胞中沉默ICMT 基因,从而降低了IC‐MT 蛋白的表达,RhoA 蛋白表达无明显改变,但RhoA 膜蛋白的表达降低,细胞的迁移和侵袭能力降低,推测ICMT 可能通过影响RhoA 的甲基化和膜定位以降低RhoA 活性来影响TSCC 细胞的迁移和侵袭,但并不影响RhoA 的表达,推测ICMT 基因与舌癌的迁移和侵袭有关。本实验还发现ICMT表达降低后RhoA 下游蛋白ROCK1 表达降低,MMP-2、MMP-9蛋白表达量降低。
Rho 关联含卷曲螺旋结合蛋白激酶(ROCK1和ROCK2),也是丝氨酸/苏氨酸激酶,是结合活性RhoA 的最佳效应蛋白。ROCK 的激活可能导致不同的细胞事件,特别是细胞骨架的变化,影响细胞-细胞或细胞-基质黏附和细胞迁移[25]。有研究[26]报道,RhoA 定位在细胞膜上,在那里它可以被激活,并通过向ROCK 和肌动球蛋白发出信号来促进侵袭和转移。RhoA 还可通过ROCK 信号通路参与血管内皮生成因子诱导的肿瘤血管生成,并能促进肿瘤细胞透过脉管内皮从而发生远处转移[27]。本实验通过沉默ICMT 基因,抑制了RhoA的甲基化使RhoA 未能正确定位于细胞膜而活性降低,ROCK1 表达量降低,推测ICMT 影响TSCC迁移及侵袭可能与RhoA-ROCK信号通路有关。
肿瘤细胞的迁移侵袭需要改变细胞和细胞基质的黏附和重塑细胞外基质。MMP 一个庞大的蛋白酶家族,它能降解基底膜和细胞外基质,在肿瘤的发生、生存、侵袭和转移中起着重要作用,尤其是MMP-2 和MMP-9,在多种肿瘤中发挥作用[28],能降解Ⅳ型胶原,有淋巴结转移和加速新的毛细血管生成的作用。在TSCC中,由于其肿瘤侵袭和转移率高,死亡率也较高,MMP-2和MMP-9的表达与TSCC 的早期诊断、局部复发、转移和生存率有关,因此可作为患者预后不良的风险潜力的指标[29]。本实验中,抑制ICMT 表达后,MMP-2 和MMP-9 表达降低,迁移侵袭能力下降,推测ICMT 通过参与对RhoA 等蛋白的翻译后修饰,降低了蛋白活性,间接影响舌癌的迁移及侵袭。
综上所述,ICMT-siRNA 可以抑制ICMT 的表达,从而抑制RhoA 的甲基化,使细胞膜上RhoA的表达降低,降低了其活性,而不改变胞内RhoA蛋白的总量。RhoA 下游ROCK1 表达降低,推测这可能与RhoA-ROCK 通路受到抑制有关。MMP-2和MMP-9的表达降低,也证实了TSCC细胞的迁移侵袭能力的下降。因此,ICMT 在TSCC 细胞迁移、侵袭中可能发挥了重要作用,有望成为治疗TSCC 的有效靶点,但其具体机制仍待进一步研究。
利益冲突声明:作者声明本文无利益冲突。

