聚乙烯微塑料对玉米根际土壤微生物群落结构的影响*
丁 峰,赖金龙,季晓晖,罗学刚,**
(1.西南科技大学生命科学与工程学院 绵阳 621010;2.西南科技大学生物质材料教育部工程研究中心 绵阳 621000;3.陕西理工大学化学与环境科学学院 汉中 723000)
微塑料(<5 mm)作为一种新型的环境污染物越来越受到人们的关注,其种类包括聚乙烯(polyethylene,PE)、聚丙烯(polypropylene,PP)、聚苯乙烯(polystyrene,PS)、聚氯乙烯(polyvinyl chloride,PVC)、聚酯类(polyethylene terephthalate,PET)及聚酰胺(polyamide,PA)等[1-2]。根据微塑料来源可分为初生微塑料和次生微塑料。其中,次生微塑料的来源主要包括农用地膜的降解、污泥的沉积以及大气中的微塑料颗粒的沉降。据调查陆地生态系统中的微塑料主要来源于农用地膜的降解[3-4]。农用地膜经过1季或多季使用后会降解,逐渐粉化后残留在土壤中导致土壤中聚乙烯微塑料残留量明显增加,已对土壤环境造成严重污染[5]。
研究表明,微塑料进入土壤后可能会影响土壤理化性质和功能[6],并随土壤中微塑料的迁移而影响土壤微生态系统。此外,微塑料颗粒可以吸附重金属、有机污染物等,当这些吸附了污染物的微塑料被土壤里的生物摄食后,可转移到更高级的营养体并蓄积,进而对动植物产生不利影响[7-8]。例如,Laganà等[9]研究发现微塑料可以作为载体,吸附多种对抗生素具有耐受性的细菌,从而使污染物更加容易对动植物和人体造成危害。Wang等[10]使用含2000 mg·kg−1PVC的土壤培养加州蚯蚓(Metaphire californica)时发现,PVC能够显著降低蚯蚓肠道中的绿湾菌门(Chloroflexi)和酸杆菌门(Acidobacteria)细菌的丰度。罗小凤等[11]对土壤白符跳(Folsomia candida)的研究发现,微塑料对土壤白符跳的成长率、繁殖率以及成活率有显著影响,通过影响跳虫的死亡、繁殖和体长等降低土壤中跳虫的生物量。陈玉玲[12]的研究证明低密度聚乙烯微塑料能引起蚯蚓的氧化应激反应,并且能够影响赤字爱胜蚯蚓(Eisenia foetida)的正常生长。Liu等[13]的研究表明,在向土壤中添加两种不同浓度的微塑料颗粒后,30 d后微塑料对土壤酶活性、有机碳含量等化学性质产生影响,且高浓度微塑料影响更大。微塑料沉积在土壤中,将土壤中的有害物质吸附在表面,会使土壤的理化性质发生改变,与土壤中的难溶颗粒结合在一起,形成土壤团聚体,进而影响土壤微环境[14]。
目前,有关农田土壤聚乙烯微塑料的环境生物学效应研究主要集中在以下几个方面:1)微塑料对农作物,例如小麦(Triticum aestivum)、绿豆(Phaseolus minimus)等的发芽和幼苗的毒理作用以及作物的农艺性状[15-16];2)微塑料在作物种植季对土壤酶活性、理化性质及微生物群落结构等的影响;3)土壤中聚乙烯微塑料的提取、降解特性研究以及一些能够降解聚乙烯微塑料的微生物筛选和降解特性研究。例如,张祯明等[17-18]以L9(34)设计正交试验,发现微塑料分子量因素对土壤理化性质有显著影响,土壤自身性质对土壤微生物群落结构的影响大于聚乙烯微塑料;樊有国[5]研究发现聚乙烯2000(分子量)和LLDPE对土壤酶活性影响较大。然而,有关不同分子量微塑料对作物根际土壤微生物多样性的影响却鲜有报道。因此,本研究在前期研究基础上,以玉米(Zeamays)为试材,采用外源添加3种分子量聚乙烯微塑料模拟土壤微塑料污染,分析添加聚乙烯微塑料后玉米根际微生物群落结构的变化,为评估聚乙烯微塑料对土壤环境的影响提供一定的理论依据。
1 材料与方法
1.1 植物材料与处理
试验所用玉米品种为‘成单19’,购自于四川省绵阳市龙门农贸市场。选用分子量为2000、5000和10万以上的聚乙烯粉末(分子量分别为1952、5014和101 282,粒径0.15~0.20 mm;购自中国石油化工有限公司茂名分公司)模拟聚乙烯微塑料。据估算,农业生产地膜覆盖使用量为90 kg·hm−2,模拟覆膜50年,折算出土壤聚乙烯微塑料污染浓度为2.12 g·kg−1[5]。因此,本研究共设置5个处理,分别为未添加聚乙烯也未种植玉米的对照(CK0)、未添加聚乙烯但种植玉米的对照(CK)、添加2000分子量聚乙烯种植玉米(T1)、添加5000分子量聚乙烯种植玉米(T2)和添加10万以上分子量聚乙烯种植玉米(T3)。采用5号加仑盆(27.5 cm×31 cm×22 cm),盆底预留孔径,每盆装15 kg土壤;分别称取所需的聚乙烯粉末95.4 g与土壤混匀,再装盆,保持最大持水量,静置1周后播种。每盆土壤播种玉米10粒,待玉米长至两叶一心时,进行匀苗,每盆留苗5株,每隔两天浇水1次。常规田间管理,每隔20 d施1次肥料,玉米生长120 d时取样。每个处理设置3个重复。
1.2 测定方法
1.2.1 玉米矿质元素含量测定
于玉米抽穗期取样,每盆中选取长势相近的3株玉米,洗掉根部土壤,按根、茎、叶处理,装信封,带回实验室。将样品在105 ℃下杀青15 min,随后在85 ℃烘干至恒重,并测定各部位干重。使用样品粉碎机粉碎玉米各部位,分装。取0.100 g粉碎好的玉米各部位样品,加入10 mL浓HNO3和1 mL 30%H2O2在微波消解仪(意大利Milestone公司)消解,消解好的各部位样品使用0.45 μm微孔滤膜过滤,使用TAS-990AFG原子吸收分光光度计测定玉米各部位元素含量。
1.2.2 土壤微生物群落的高通量分析
玉米抽穗期采集根际土壤样品。将玉米整株从土壤中挖出后,抖掉与根系结合松散的土,用刷子将与根际结合紧密的土壤刷下来作为根际土壤样品。将土壤样品混匀后用灭菌的密封袋装好密封保存,迅速带回实验室。采用DNA抽提试剂盒提取土壤基因组DNA,之后利用琼脂糖凝胶电泳检测DNA纯度和浓度,取适量的样品于离心管中[19]。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物[20],Takara公司的Takara Ex Taq高保真酶进行PCR,确保扩增效率和准确性[21]。细菌多样性鉴定对应区域为16S V3-V4区(前段引物为343F-5′- TACGGRAGGCAGCAG-3′;后端引物:798R-5′- AGGGTATCTAATCCT-3′),真菌ITS多样性鉴定对应区域:ITS(前端引物:ITS1 F-5′-CTTGGTCA TTTAGAGGAAGTAA-3′;后端引物:ITS2-5′-GCT GCGTTCTTCATCGATGC-3′)[22]。
PCR产物在上海欧易生物医学科技有限公司进行双端测序,使用Trimmomatic软件对原始双端序列去杂。去杂后的双端序列利用FLASH软件拼接,测序数据进行预处理生成优质序列。采用Vsearch软件,根据序列的相似性,将序列归为多个OTU,参数为序列相似度大于或等于97%被归为一个OTU单元。使用QIIME软件包挑选出各OTU的代表序列,并将所有代表序列与数据库进行比对注释。16S使用Silva(version123)数据库比对,物种比对注释使用RDP classifier软件,保留置信区间大于0.7的注释结果。ITS 使用Unite数据库比对,物种比对注释使用blast软件[23-24]。
1.3 数据处理与分析
采用QIIME软件对测序数据进行分析、计算土壤微生物的多样性[25-26],利用SPSS 22.0对玉米各部位矿质元素含量进行分析,使用Origin 2017绘图,采用Adobe lllustrator CS6进行图片排版。
2 结果与分析
2.1 聚乙烯微塑料对玉米矿质元素含量的影响
不同分子量聚乙烯微塑料污染对玉米不同部位矿质元素含量影响如表1所示。结果显示,随着聚乙烯分子量的增加,不同部位矿质元素含量基本呈上升的趋势。
K含量在根和茎中呈现相似趋势,均为T1>T2>T3>CK;在叶中为T1>T3>T2>CK。各部位T1、T2、T3间存在显著差异;不同部位K含量表现为茎>根>叶;不同处理下,玉米K含量在根、茎、叶间存在显著差异。
Ca含量在根、茎、叶中变化趋势不同,根为T3>T1>T2>CK,茎为T2>T1=CK>T3,叶为T1>T3>CK>T2。各部位T1、T2、T3间存在显著差异。不同部位Ca含量为叶>根>茎,根和叶中各处理与CK之间存在显著差异,茎T2处理与CK差异显著;不同处理下玉米Ca含量在根、茎、叶间存在显著差异。
Mg含量在根、茎、叶中变化趋势各不相同。根中T3处理的Mg含量最大,较CK显著增加41.9%;茎中T2处理Mg含量最高,叶中T1处理Mg含量最高。各部位Mg含量由高到底为叶>根>茎。不同部位T1、T2、T3间存在显著差异,不同处理下根、茎、叶间差异显著。
玉米根、茎、叶Fe含量在不同处理下差异显著。根中T1处理Fe含量最大,较CK显著增加48.2%;茎中T3处理Fe含量最大;叶中T2处理Fe含量最大,较CK显著增加59.3%。各部位Fe含量为根>叶>茎。不同处理下玉米Fe含量在根、茎、叶间存在显著差异。
Cu在玉米根、茎、叶中含量各不相同。根中T2处理Cu含量最大,较CK显著增加38.6%;茎中T3处理对Cu含量影响最大,较CK增加26.3%;叶中T3处理Cu含量最大。不同部位Cu含量表现为根>茎>叶。根中各处理对Cu含量有显著影响,茎、叶中的影响不显著。玉米根中,T1、T2、T3之间Cu含量存在显著差异;茎中T2、T3之间差异不显著,但均与T1间差异显著;叶中T1、T2之间和T2与T3之间差异不显著,但T1和T3差异显著。T1和T3处理下,根与茎和叶中Cu含量均存在显著差异,但茎和叶间差异不显著,T2处理下,Cu含量在根、茎、叶中存在显著差异。
玉米根、茎、叶Mn含量T1、T2、T3处理与CK差异显著。根中T1处理最大,茎中T2最大,叶中T2最大;不同部位Mn含量表现为叶>根>茎。不同部位T1、T2、T3间存在显著差异,各处理下玉米Mn含量在根、茎、叶间存在显著差异。
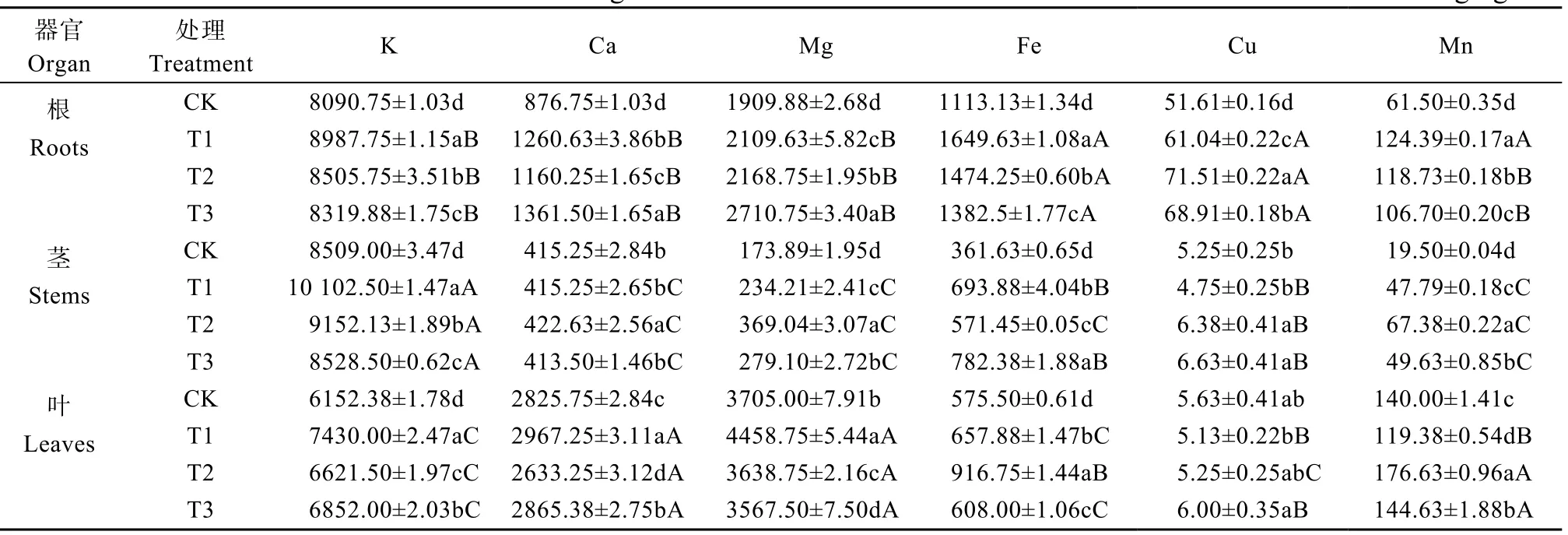
表1 不同分子量聚乙烯微塑料对玉米不同部位矿质元素含量的影响Table 1 Effect of polyethylene microplastics with different molecular weights on mineral elements contents of different organs of corn mg·kg−1
2.2 微塑料对土壤微生物群落多样性的影响
结果显示,5个处理中,细菌丰度远大于真菌丰度。玉米土壤共含有51 902个细菌有效序列,其中共同OTU(操作分类单元)为891。Coverage指数均>0.9(表2),说明样品中的细菌序列基本上被测出,即本次测序结果能反映出样本的真实结果。由表2可知,CK处理的物种丰度最高,T1处理的有效OTU数最少,各处理有效OTU数不存在显著差异。Chao1指数越大,代表样品中菌群的丰富度越高。本研究中,T1处理的Chao1指数最小,T3处理最大。Shannon指数和Simpson指数越高,说明微生物群落多样性越高。本研究中,各处理的Simpson指数相同,而Shannon指数T1处理最小,说明T1处理细菌群落多样性最低。各处理的Shannon指数和Simpson指数与CK间无显著差异。5种处理下土壤中细菌OTU主成分分析结果(图1A)显示,除CK外,其他4个处理的3个重复分别聚在一起,具有较高的重复性。5个处理间彼此相距较远,且T1处理与其他处理间相距最远,说明添加聚乙烯微塑料后,土壤中细菌群落结构发生了较大差异,添加不同分子量的聚乙烯微塑料对土壤细菌群落结构具有较大的影响,且添加分子量为2000的聚乙烯微塑料的影响最大。
所有玉米土壤样本共获得18 295个真菌有效序列,依据97%序列相似性对所有序列进行聚类后发现,5个处理共有序列282个。Coverage指数均>0.97,说明样品中的真菌序列已基本被测出,即本次测序结果能反映出样本的真实结果。T3处理下的Chao1指数、Shannon指数较CK增加,Simpson指数相同,说明T3处理下微生物多样性增加,且各处理的Shannon指数和Simpson指数与CK相比不存在显著差异。5种处理下土壤中真菌OTU主成分分析结果(图1B)显示,5个处理间彼此相距较远,说明在添加不同分子量的聚乙烯微塑料后,土壤中真菌群落发生了差异,且10万以上分子量的聚乙烯微塑料影响最大。
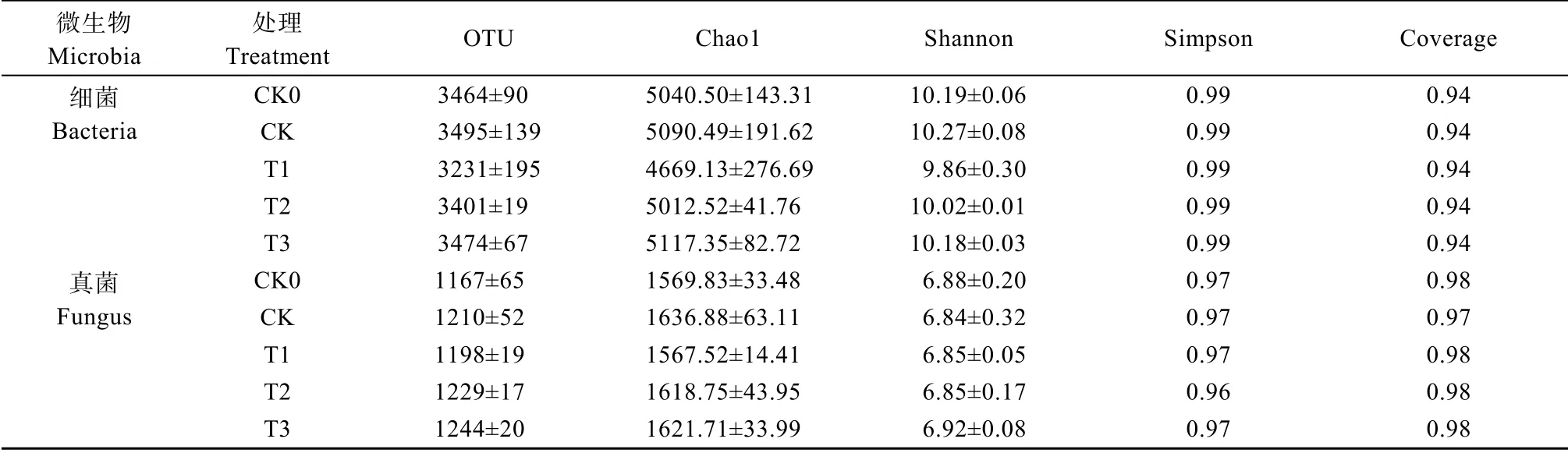
表2 不同分子量聚乙烯微塑料对玉米土壤细菌和真菌多样性的影响Table 2 Effects of polyethylene microplastics with different molecular weights on diversity indexes of soil bacteria and fungi of corn
2.3 微塑料对土壤微生物群落纲水平组成的影响
由图2A可知,土壤细菌群落主要由γ-变形杆菌纲(Gammaproteobacteria)、α-变形杆菌纲(Alphaproteobacteria)、δ变形菌纲(Deltaproteobacteria)、拟杆菌纲(Bacteroidia)、芽单胞菌纲(Gemmatimonadetes)、放线菌纲(Actinobacteria)、酸微菌纲(Acidimicrobiia)、Acidobacteriia、Thermoleophilia、Nitrospira、Ignavibacteria、Thermoanaerobaculia等组成。不同处理土壤样品中细菌菌纲构成相似。进一步分析发现,γ-变形杆菌纲在各处理中均占有较大的优势,最大丰度为42.7%,出现在T1处理;最小丰度出现在CK中,为33.3%;除T1与CK之间存在差异较大外,T2和T3与CK间及T1、T2、T3间差异也不明显。其次是α-变形杆菌纲,最大丰度为19.3%,出现在CK中;最小丰度出现在T1中,为15.6%;除T1与CK之间存在差异较大外,T2和T3与CK间及T1、T2、T3间差异也不明显。δ变形菌纲最大丰度为12.5%,出现在CK;最小丰度出现在T1,为9.0%,T1、T2与CK之间差异较大,T3与CK相似,T1、T2、T3之间无明显差异。从图2A可以看出,T1处理除γ-变形杆菌纲外,其余菌纲较CK丰度减少,表明2000分子量聚乙烯对土壤细菌群落影响最大。
通过对测序结果分析、归类,得出土壤真菌群落在纲水平上的分布特征(图2B)。结果显示土壤真菌群落主要由粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)、伞菌纲(Agaricomycetes)、散囊菌纲(Eurotiomycetes)、被孢霉纲(Mortierellomycotina cls Incertae sedis)、球囊菌纲(Glomeromycetes)、银耳纲(Tremellomycetes)、盘菌纲(Pezizomycetes)、锤舌菌纲(Leotiomycetes)、Wallemiomycetes、壶菌纲(Chytridiomycetes)、Archaeorhizomycetes、茶渍纲(Lecanoromycetes)、酵母菌(Saccharomycetes)、李基那地衣纲(Lichinomycetes)等组成。不同处理土壤样品中真菌菌纲构成相似。进一步分析发现,粪壳菌纲在各处理中均占有较大的优势,最大丰度为26.9%,出现在T3;最小丰度出现在CK,为22.6%,T1、T2、T3间及其与CK之间差异不明显。其次是座囊菌纲,最大丰度为14.8%,出现在T1;最小丰度出现在CK,为12.3%,T2和T3处理也增加了粪壳菌纲的丰度;T1、T2、T3之间及其与CK之间差异不明显。
2.4 微塑料对土壤微生物群落科水平组成的影响
通过对测序结果分析、归类,得出土壤细菌群落在科水平的分布特征(图3A)。结果显示土壤细菌群落主要由伯克氏菌科(Burkholderiaceae)、亚硝化单胞菌科(Nitrosomonadaceae)、芽单胞菌科(Gemmatimonadaceae)、鞘脂单胞菌科(Sphingomonadaceae)、假单胞菌科(Pseudomonadaceae)、噬几丁质菌科(Chitinophagaceae)、Microscillaceae、Solimonadaceae、Dongiaceae等组成,不同处理土壤细菌菌科构成相似。伯克氏菌科在每个处理中都是最多的,除T1处理外,T2和T3与CK间及T1、T2、T3间相近。其次是亚硝化单胞菌科,最大丰度为9.1%,出现在T1;除T1外,T2和T3与CK间及T1、T2、T3间相近。
通过对测序结果分析、归类,得出土壤真菌群落在科水平上的分布特征(图3B)。结果显示土壤真菌群落主要由丛赤壳科(Nectriaceae)、孢菌科(Pleosporaceae)、粉褶菌科(Entolomataceae)、被孢霉科(Mortierellaceae)、球囊霉科(Glomeraceae)、角担菌科(Ceratobasidiaceae)、毛球壳科(Lasiosphaeriaceae)、蜡伞科(Hygrophoraceae)、毛壳菌科(Chaetomiaceae)、节担菌科(Wallemiaceae)、排腔科(Dothioraceae)、伏革菌科(Corticiaceae)、盘菌科(Pezizaceae)等组成。各处理优势科均为丛赤壳科、孢菌科和粉褶菌科,不同处理土壤真菌菌科构成相似。每个处理丰度最高的是丛赤壳科真菌,最高的是T3处理,相对丰度为10.4%;CK处理丰度最低,为8.9%;除T3外,T1和T2与CK间及T1、T2、T3间相近。其次是孢菌科,相对丰度最多的是T3处理,为4.7%;最小为CK,相对丰度为4.4%;除T3外,T1和T2与CK间及T1、T2、T3之间差异不明显。T3处理下丛赤壳科真菌、孢菌科较CK显著增加。
3 讨论
本研究发现,玉米矿质元素如Fe、Cu在根中最多,这与詹爱军等[27]的研究一致。Ca、Mn、Mg叶中积累最多,这与沈涛等[28]关于云南薯蓣属(Dioscorea)矿质元素指纹图谱研究相似。Liu等[13]研究发现微塑料通过影响土壤微生物活动,促进矿质元素在植物-土壤之间的迁移。本研究中,添加不同分子量聚乙烯微塑料后,玉米各部位矿质元素含量较CK增加,这主要是因为微塑料添加改变了土壤理化性质,适应微塑料的土壤微生物活动增强,使微生物胞外酶的分泌增加[29],促进土壤的K、Ca、Mg等矿质元素的释放,加速了矿质元素在土壤-植物体之间的迁移转化[13],因此植物体各部位的矿质元素含量较CK显著增加。
一般来讲,微生物群落多样性指数越高,群落结构越复杂,稳定性越好[30]。Huang等[31]在研究LDPE对微生物群落组成和酶活力的影响中发现,聚乙烯的加入能显著提高土壤中脲酶和过氧化氢酶的酶活性,16S-rRNA高通量测序结果显示土壤微生物的多样性并没有显著变化,但微生物多样性明显低于对照组。本研究中发现在添加聚乙烯微塑料后,细菌群落数较CK减少,但不存在显著差异,各处理Shannon指数和Simpson指数与CK并无显著差异,这说明聚乙烯微塑料能够改变土壤细菌群落结构;真菌群落除T1外,其余处理较CK增加,各处理之间不存在差异显著性,各处理Shannon指数和Simpson指数与CK并无显著差异,这说明高分子量聚乙烯微塑料对土壤真菌具有促进作用。
本试验发现,在聚乙烯微塑料污染的土壤中,细菌丰度远大于真菌丰度,这与Yang等[32]的土壤中微生物以细菌为主的结论相同。玉米根际微生物在不同处理下群落纲水平和科水平组成具有一定的相似性。纲分类水平上,细菌优势菌纲为γ-变形杆菌纲、α-变形杆菌纲、δ变形菌纲等,真菌优势菌纲为粪壳菌纲、座囊菌纲、伞菌纲等。科分类水平上,细菌优势菌科为伯克氏菌科、亚硝化单胞菌科、芽单胞菌科等,真菌优势菌科为丛赤壳科、孢菌科、粉褶菌科等。T1处理下除变形杆菌纲、伯克氏菌科细菌丰度增加外,其他细菌科的丰度较CK大幅度减少。这主要是因为低分子量聚乙烯微塑料发生了降解,聚乙烯中所含的增塑剂、稳定剂等有害物质释放到土壤中,使细菌生长活动受抑[33]。而变形杆菌纲产生的次生代谢物或植物激素可以有效防治病虫害,促进植物正常生长[34],在玉米应对聚乙烯微塑料胁迫中有至关重要作用;伯克氏菌科为生物降解、生物控制及促进植物生长的根圈微生物[35],因此这两类细菌受到的危害较低,丰度较CK增加。T3处理下土壤细菌和真菌的丰度较CK都较大幅度增加,主要是因为高分子量聚乙烯微塑料不容易发生降解,且降解过程中由于链的分子量、结晶度不同而存在差异,低分子量的聚乙烯可以穿过微生物的生物膜,从而被微生物吸收和降解[33],土壤中高分子量微塑料在降解过程中由于分子链较大不能直接穿过细胞膜进入微生物体内,经过一系列的非生物因素如光、温度以及生物因素等的作用下,逐步转化成小分子,经过降解的小分子或者是乙烯单体被微生物细胞吸收降解,生成可被植物吸收利用的能源如CO2和CH4等[36],因此T3处理的土壤微生物丰度较CK增加。
4 结论
本试验以玉米为研究对象,分析了添加不同分子量聚乙烯微塑料下玉米矿质元素含量变化及微生物群落的变化特征。矿质元素含量在玉米各部位存在差异,Fe、Cu主要集中在玉米根部,Ca、Mn、Mg在叶中分布最多,K主要集中在茎中;且在添加不同分子量聚乙烯微塑料后,不同部位的矿质元素较CK增加,更多的表现为2000分子量聚乙烯处理的影响最大。
利用高通量测序方法分析玉米根际微生物群落结构的差异,发现添加2000分子量聚乙烯微塑料对玉米根际微生物影响最大,除变形杆菌纲、伯克氏菌科细菌丰度增加外,其他细菌科的丰度较CK大幅度减少;而添加10万以上分子量聚乙烯微塑料微生物群落较CK增加。添加聚乙烯微塑料使变形杆菌类、粪壳菌纲、伯克氏菌科、丛赤壳科等较CK大幅度增加,这有利于植物土壤微生态系统应对聚乙烯微塑料的胁迫。本试验为研究微塑料对农用土壤的安全性评价提供了一定的参考依据,同时也为农用土壤中微塑料降解菌的筛选提供了方向。

