影响猪精子耐冻性的候选基因分析
王文君,王小康,徐国强,周翔2,刘榜2
1.华中农业大学农业动物遗传育种与繁殖教育部重点实验室,武汉 430070; 2.生猪健康养殖省部共建协同创新中心/湖北省地方猪品种改良工程技术研究中心,武汉 430070
猪精液冷冻保存技术是促进遗传资源保护、提高优良种公畜利用率、减少公猪养殖量和推动优良种畜跨区域交流的有效举措。特别是在当前非洲猪瘟疫情防控压力下,该技术因其安全、高效等特点而大大降低了种公猪引进和配种造成的疾病传播风险,具有重要的现实意义和长远的战略意义。然而,由于猪精子结构的特殊性,对温度变化特别敏感,使得猪精液冷冻保存技术一直落后于其他动物(如牛),严重制约了其产业化利用。
猪冷冻精液的质量受多种因素影响,主要包括年龄、季节、温度、饲养管理、采精频率、营养水平、冷冻保护剂和精液处理条件等[1]。近年来已有研究通过改善日粮营养水平[2]、加强饲养管理、调整冷冻保护剂成分[3]及优化精液冻存程序[4]等手段提高猪冷冻精液的质量。此外,在相同的外部环境和冻存条件下,不同品种及同一品种的个体之间仍存在精液冻存质量差异,有些个体的精子易于冻存,而有些则较难冻存[5],这种差异称为精子耐冻性。已有研究表明精子耐冻性可能与质膜中长链多不饱和脂肪酸的含量[6]、活性氧的水平[7]、离子通道[8-9]以及一些膜蛋白定位[10]有关。也有从蛋白质[9,11]、RNA[12]和表观遗传学[13]等方面对猪精子耐冻性的差异原因进行的研究,发现并鉴定了多种耐冻性标记物,一些耐冻性物质已经在稀释剂中进行了应用,显著提高了冻存效果[14]。然而,这些研究都是从一些基因产物分析对猪精子耐冻性的影响,而影响猪精子耐冻性的候选基因的研究鲜有报道,若能鉴定出影响猪精子耐冻性的基因,将可通过育种的手段对猪精子耐冻性进行遗传改良,提高猪精液冻存质量。
笔者在对通城猪精液的多次冷冻保存过程中发现,在相同饲养管理、营养水平和冻存条件下,不同个体之间的精子耐冻性存在明显差异。为了探究影响猪精液冻存质量的遗传基础,笔者所在研究团队通过检测不同猪个体精液冷冻前后的精子活力,发现耐冻性差异个体,并结合SNP芯片数据进行FST分析,鉴定猪精子耐冻性差异的关键候选基因,解析猪遗传差异对精子耐冻性的影响。
1 材料与方法
1.1 材 料
以湖北省咸宁市通城县国营种畜场中15个通城猪血统中的22头繁殖公猪(3周岁以内)为试验对象,每个个体在3个不同季节(夏季、秋季和冬季)采集多次精液。
1.2 主要试剂和设备
1)主要试剂。十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)、异丙醇、冰醋酸、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、三羟甲基氨基甲烷(trihydroxymethyl aminomethane,Tris)、蛋白酶K、Tris饱和酚、Tris碱、三氯甲烷、无水乙醇、裂解液(200 mmol/L Tris-HCl、50 mmol/L EDTA (pH=8.0)、400 mmol/L NaCl、1% SDS混匀后定容至1 000 mL)、猪冻精生产套装(北京田园奥瑞公司)、灭菌超纯水。
2)主要设备。采精和精液冻存相关器材:采精保温杯、水浴锅、离心机、程控冷冻仪(IceCube)、精子活力检测显微镜、超净工作台、车载保温箱、精液冷冻箱、液氮罐、封口机。
DNA提取所用仪器:高速冷冻离心机及台式高速离心机(德国Ependorff公司)、HVE-50高压灭菌设备(日本Hirayama公司)、恒温水浴循环仪(郑州长城科工贸公司)、HYQ-2121A型涡旋混匀器、DHG-9145A型电热恒温鼓风干燥箱。
DNA质量检测所用仪器:ND2000核酸/蛋白质浓度测定仪(美国Thermo公司)、电泳仪和电泳槽、WD-9403C紫外仪(北京六一仪器厂)、凝胶成像系统(英国Syngene公司)、自动双重纯水蒸馏器、电子天平。
1.3 精液的采集
采精前对采精杯和采精袋进行消毒处理。使用发情母猪诱导公猪爬跨,并对公猪阴茎周围进行消毒清洗,使用手握法进行精液采集。采精时弃去射精初段的胶状精液,精液呈乳白色时再经过无菌薄膜滤纸过滤到采精杯。
1.4 精液的稀释
稀释所用烧杯、玻璃棒提前消毒处理,载玻片、盖玻片放置于显微镜加热台37 ℃预热。采集出新鲜精液置于37 ℃水浴锅中,并取少量进行镜检,观察精子密度和活力。若镜检合格,则将37 ℃预热的稀释液经玻璃棒缓慢引流至鲜精中等体积稀释,轻轻混匀后再次进行镜检并记录数据。
1.5 精液的冷冻保存和解冻
稀释后质量合格的精液装入收集袋,并置于17 ℃恒温箱中保存,送往湖北省种公牛站进行精液冷冻保存:新鲜精液充分平衡后摇匀以防止精子假死,并在17 ℃条件下2 000 r/min离心10~15 min去掉上清液;用17 ℃的乳糖-卵黄稀释剂(卵黄约占20%)重悬浮精子,使精子密度达到20亿/mL,然后置于盛有17 ℃水的烧杯中,于4 ℃低温操作柜中降温平衡,使精液在2.5~3.0 h缓慢降温至4~5 ℃,并平衡0.5~1.0 h;平衡后,加入等体积的乳糖-卵黄稀释剂(含4%~5%甘油),混匀后立即在低温操作柜中进行0.25 mL细管灌装操作;随后,按照程控冷冻仪的技术要求,使用系统默认的0.25 mL细管冷冻曲线调制参考程序(表1),启动冷冻仪使腔室降至4~5 ℃,并将灌装好的细管精液放入后启动冷冻程序,完成冷冻精液制备。
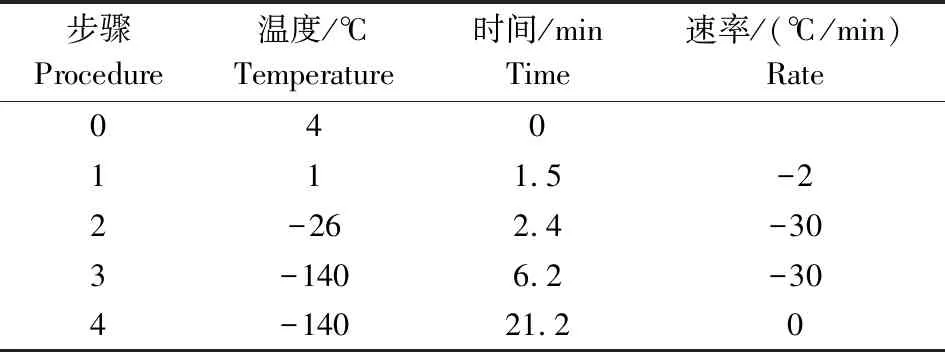
表1 程控冷冻仪(IceCube)0.25 mL细管冷冻曲线调制参考程序Table 1 Reference program of 0.25 mL tube freezing curvemodulation of a computer-controlled rate freezer (IceCube)
冷冻结束后,每个样本取3支细管解冻后进行精子活力检测。细管在37 ℃水浴锅中解冻30 s,剪去细管两端,将精液转移入4 mL离心管中,用预热的解冻液稀释;30 ℃恢复15~20 min后在显微镜下检测解冻后精子质量。
1.6 耐冻和不耐冻个体筛选与统计分析
对22头通城公猪在不同季节多次采集的精液进行冷冻保存,利用显微镜检测冷冻前和解冻后的精子活力并进行排序,筛选出解冻后平均活力最高的3头作为耐冻个体、活力最低的3头作为不耐冻个体。采用SPSS 22.0软件对精子活力数据进行单因素方差分析(one-way ANOVA),利用Student-Newman-Keuls(SNK)法进行差异显著性检验,结果以P<0.05为差异显著。
1.7 DNA提取及质量检测
采集通城猪精子耐冻和不耐冻个体的耳组织并利用苯酚-氯仿法提取基因组DNA。利用ND2000核酸/蛋白质浓度测定仪和0.8%琼脂糖凝胶对提取的DNA质量及浓度进行检测。
1.8 SNP芯片数据处理
1)基因型的判定与SNP质控。使用“中芯一号”全基因组芯片对3头耐冻个体和3头不耐冻个体DNA进行SNP检测。并用PLINK1.9软件对所有SNP位点进行质控,使用的命令为:plink --file inputfile --mind 0.05 --geno 0.05 --maf 0.01 --hwe 0.000001 --recode --out outputfile。
2)利用FST方法进行选择信号的检测。本研究采用群体分化指数FST法对耐冻和不耐冻个体的遗传分化程度进行检验。计算2组间每1个SNP位点的FST值。其计算公式如下:
(1)
其中,HT为组间的分化指数,其计算公式为:
(2)
HS为组内的分化指数,其计算公式为:
(3)
其中,pGFE与pPFE分别为耐冻与不耐冻个体的等位基因频率。
所有操作利用vcftools软件进行,其命令为vcftools --vcf inputfile1 --weir-fst-pop inputfile2 --weir-fst-pop inputfile3 --out outputfile。其中,inputfile1是质控后的SNP分型数据文件;inputfile2是所有耐冻个体号;inputfile3是所有不耐冻个体号。
3)基因注释与功能富集分析。选择FST前1%的SNP位点,利用UCSC数据库(http://genome.ucsc.edu/cgi-bin/hgLiftOver)将SNP位点由猪参考基因组Sscrofa 10.2转换为Sscrofa 11.1,并将其上下游各扩展100 kb作为选择区段,将位于该选择区段内的基因定义为选择信号的候选基因。利用Ensembl网站(http://asia.ensembl.org/biomart/martview/5e4dd39e6faded8f257daef5bccbe765)进行基因注释,使用Metascape在线软件(http://metascape.org/gp/index.html#/main/step1)进行基因功能富集分析。用R3.5.1进行绘图展示。
2 结果与分析
2.1 猪精子的耐冻性具有个体差异
本研究主要使用精液冻存后的精子活力来评价猪精液冻存质量。采集的通城猪精液通过显微镜检测精子活力并记录,图1为22头猪的精子冻存前后的活力检测结果(均值±标准差)。所有个体冻存前的精子活力约为0.6,符合精液冻存前标准。而经精液冻存后,有的个体每次解冻后精子活力均能达到0.4左右,冻存成功;有的个体则降至0.1以下,导致冻存失败。不同个体间存在明显的精子耐冻性差异。由此,筛选出猪精子耐冻个体(32007、28803和29303)和不耐冻个体(32101、27805和2283)各3头。对这6头耐冻性差异个体在冻存前后的精子活力进行统计分析,发现冷冻前(稀释)的精子活力差异不显著,而解冻后的3头耐冻个体和3头不耐冻个体的精子活力之间存在明显差异,进一步证明猪精子的耐冻性具有个体差异(表2)。
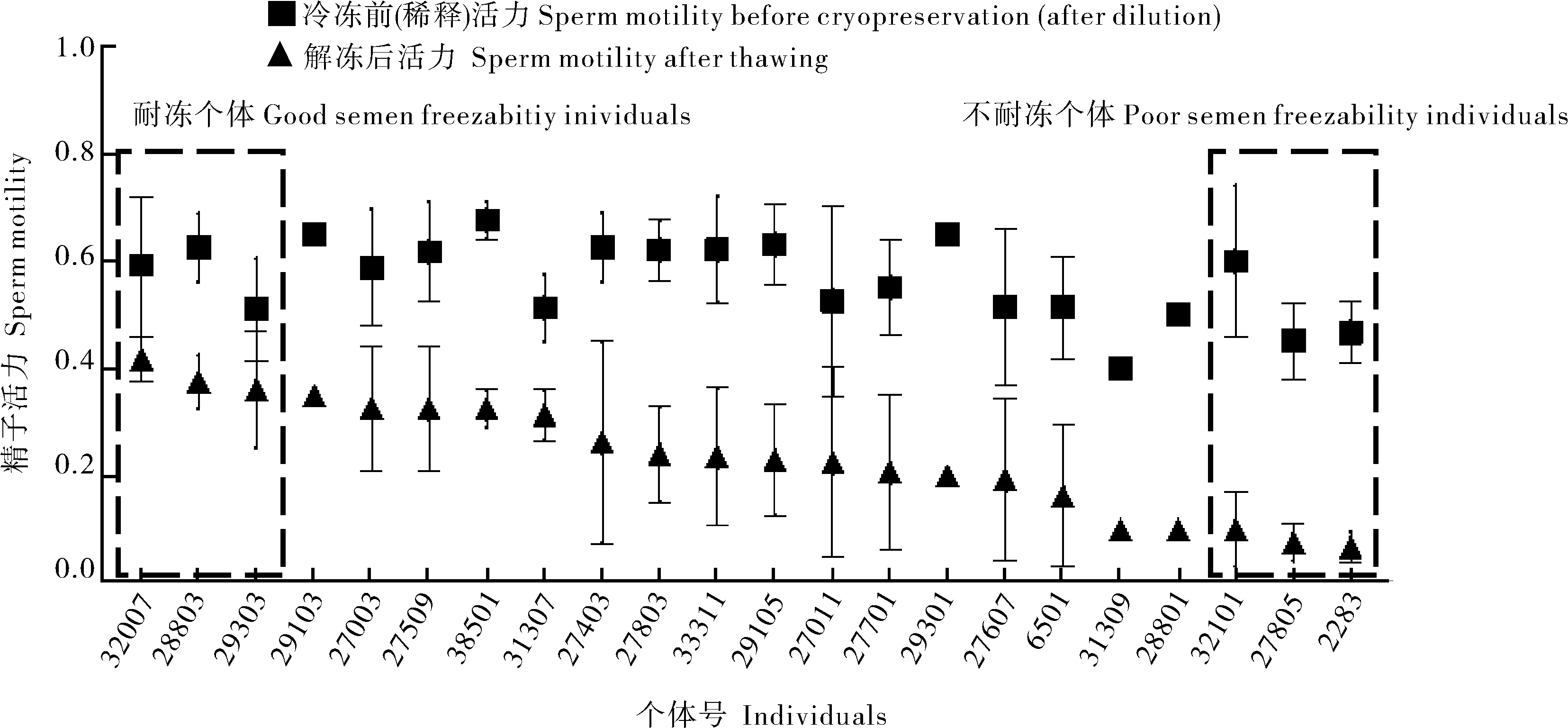
图1 冻存前后精子活力Fig.1 Sperm motility before and after cryopreservation
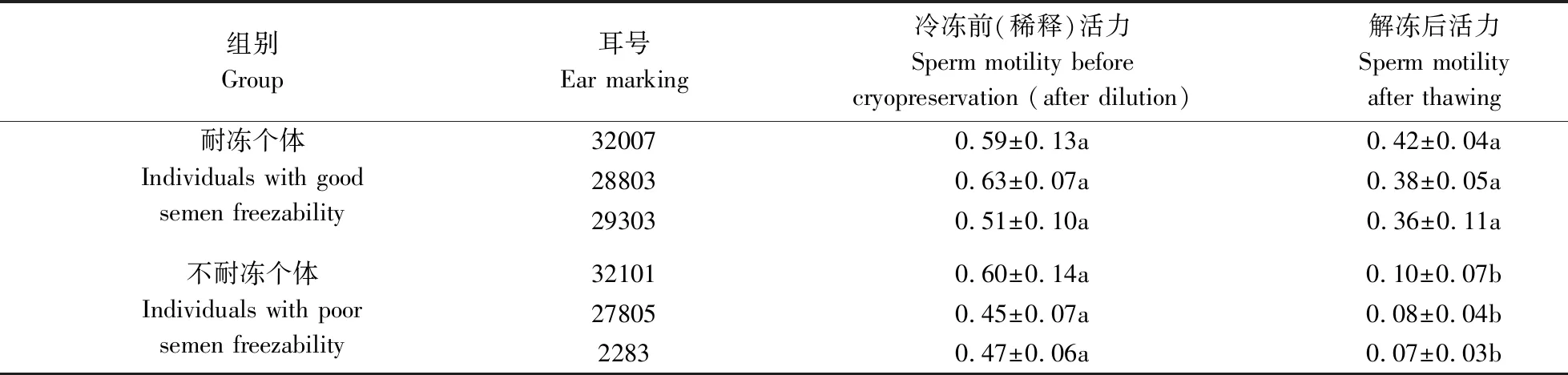
表2 猪精子耐冻和不耐冻个体在冻存前后的精子活力Table 2 Sperm motility before and after cryopreservation for good semen freezability and poor semen freezability individuals
2.2 猪精子耐冻性差异具有遗传基础
绘制上述6个精子耐冻性差异个体的系谱关系图(图2),分析耐冻性差异个体间的亲缘关系。发现3个精子耐冻个体集中于一些亲本,而不耐冻的个体集中于另一些亲本,二者具有明显的聚类差异。说明耐冻个体之间、不耐冻个体之间分别具有较近的亲缘关系,而耐冻和不耐冻个体之间亲缘关系较远,证明猪精子耐冻性差异可能是经由亲本遗传给后代的,具有遗传基础。
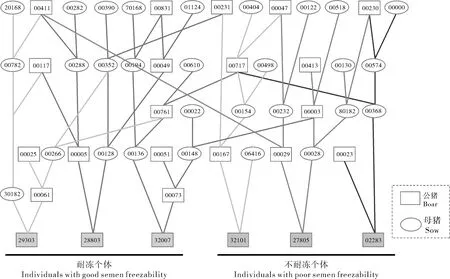
图2 精子耐冻性差异个体的系谱图Fig.2 Genetic relationship of individuals with different sperm freezability
2.3 猪精子耐冻性差异的候选基因筛选
1) 精子耐冻性差异个体的SNP位点分析。精子耐冻性差异个体的全基因组DNA通过“中芯一号”芯片共检测到51 315个SNP位点,基因分型率为98.3%。对SNP分型后的数据进行质控,其中2 222个SNP位点因在所有个体中缺失率>0.05而被剔除,24 116个SNP位点由于最小等位基因频率<0.01被过滤,同时剔除910个未定位到染色体上的位点,最终24 067个SNP位点通过质控。
对质控后的24 067个SNP位点计算得到精子耐冻组和不耐冻组的群体分化指数FST值,FST平均值为0.170 5,表明精子耐冻个体和不耐冻个体间存在较高程度的分化。结合系谱分析结果,推断耐冻个体与不耐冻个体间存在遗传差异。进一步构建FST密度分布图(图3),并选择前1%(FST>0.53)共266个位点作为选择信号发生区域的核心SNP。
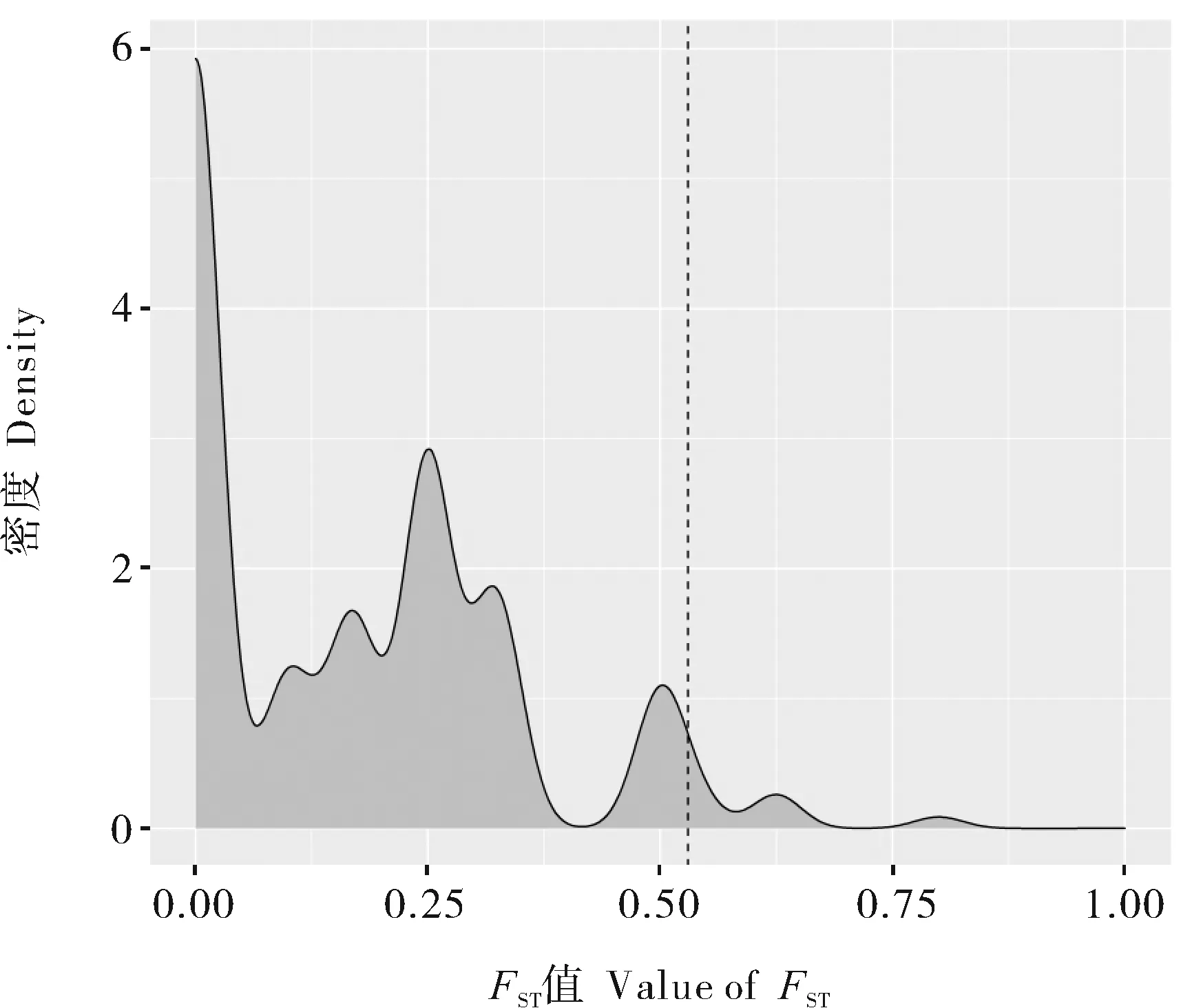
图中虚线表示FST值前1%(FST=0.53)所对应的分界线的值。The dotted line in the figure indicates that the value of the boundary line corresponding to the top 1% (FST=0.53).
2)染色体FST值的分布。根据选择信号所在染色体位置和FST值,在图4中标注了266个核心SNP的分布情况。其中1号染色体上核心SNP数量最多,数目为40个,其次是10号和14号染色体,均为23个核心SNP。但在10号染色体上,核心SNP的分布密度最大。最高的FST值(FST=1)位于11号染色体上。从图4可以看出,猪精子耐冻性相关选择信号在基因组上的分布存在差异。
3)精子耐冻性差异候选基因的筛选和功能富集。通过对266个核心SNP位点上下游各100 kb区段的基因注释,共获得了397个候选基因。利用Metascape在线软件对候选基因进行GO富集分析,共富集到了19条GO条目,主要富集于细胞形态(MNS1、DNAAF4、NANOS1、ATRN等)、膜蛋白定位(CACNB2、RPL31、NDUFA13等)、肌动蛋白细胞骨架(CACNB2、KATNAL2、VIM、LIMK2、ARPC1B等)和离子通道(CACNB2、KCNH2、KCNA3、KCNG4、GRIN2B等)(图5)。同时,还有一些与胞吐、氧化应激、代谢及顶体结构等相关的基因(如ANXA6、TSSK6、SOX5、PRDX1、NEU3、CUBN、MEIG1、PATZ1、SLC4A2、CCDC136、ICA1)可能也与精子耐冻性差异相关。
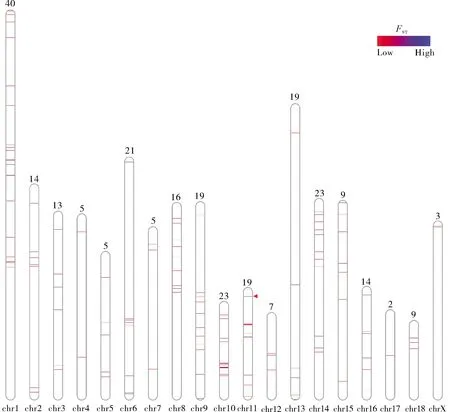
数字表示染色体上的位点数目,横线表示选择信号在染色体上的物理位置,红色三角表示最高的FST值(FST=1)所在位置。The number indicates the number of loci on the chromosome,the horizontal line indicates the physical position of the selection signal on the chromosome,and the red triangle indicates the location of the highest FST value (FST=1).
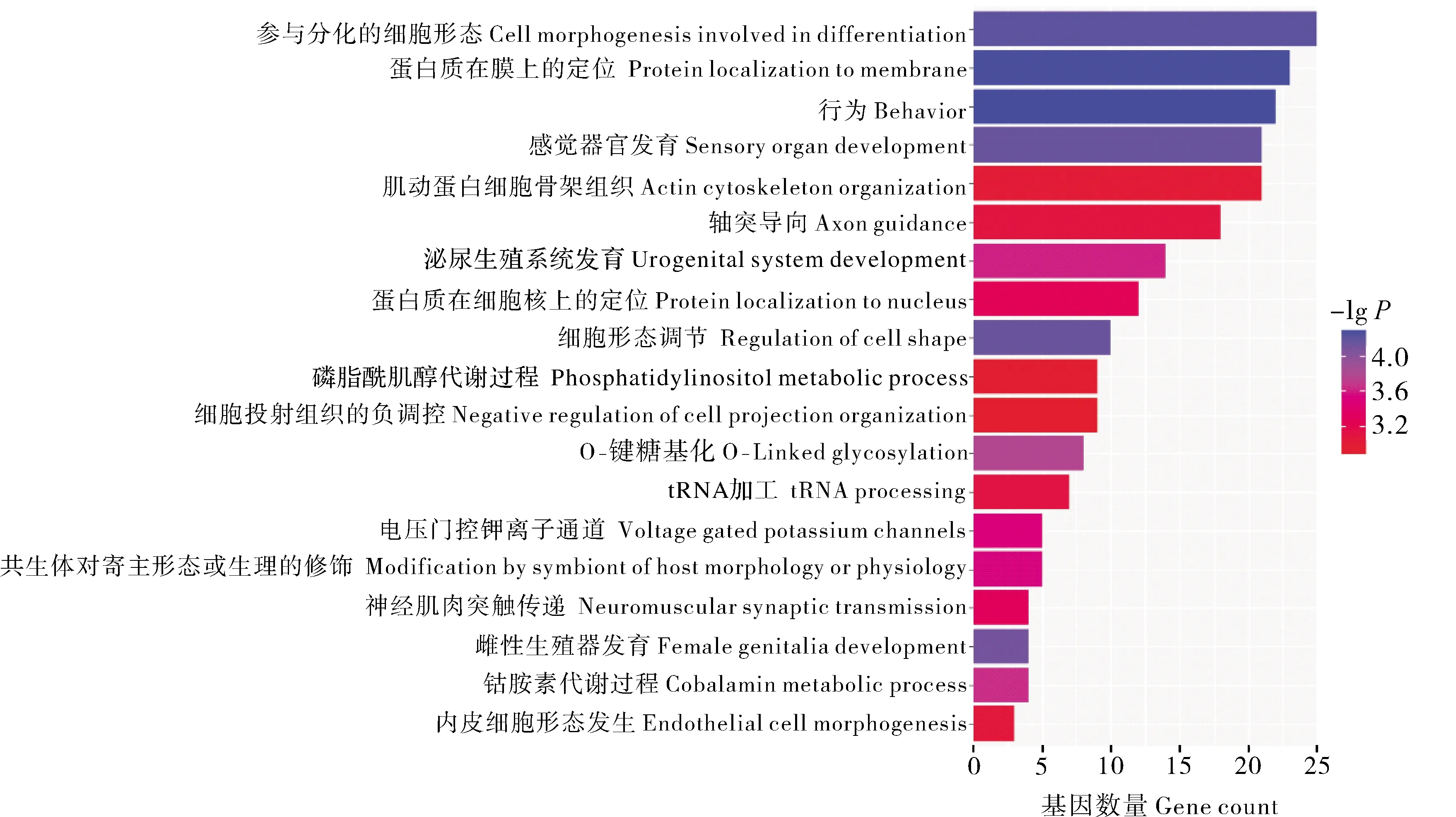
纵坐标表示GO Term,横坐标表示富集到GO Term的基因数目。The ordinate represents GO term and abscissa represents the number of genes enriched in GO term.
3 讨 论
3.1 猪精子耐冻性受遗传因素影响
猪精液冷冻保存技术是利用液氮(-196 ℃)或干冰(-79 ℃)等作冷源,通过程序化的降温处理,将去除大部分精浆的猪精液保存在超低温环境中,达到长期保存的目的。但目前猪精液冷冻保存技术在应用中仍存在一些问题,主要是由于冻融过程会对精子造成一定的冷冻损伤:顶体的完整性受损、质膜的流动性和渗透性被破坏、mRNA和蛋白质降解、精子核内DNA碎片化以及精子运动能力受损等[15]。本研究通过对通城猪精液冷冻保存前后的精子活力进行检测,观察到精子在冻存后的活力存在明显的个体差异(图1),这种差异受多种因素影响。
影响猪精液冻存质量的因素主要包括公猪营养水平、圈养方式、饲养环境以及精液采集频率等[16]。精液处理过程也是影响精液冻存质量的重要环节,主要与稀释比例、稀释液成分及精液冻存程序等相关[17]。因此,本研究对所有公猪有针对性的补充饲料、调至同一营养水平,且保持相同的饲养环境、圈养方式和采精频率,同时在精液冷冻前离心重悬浮至同一密度,并采用完全相同的冷冻保护剂和冻存程序,由此确保相同的环境因素,减少环境因素对猪精液冻存质量的影响。此外,精液冻存质量还受猪的品种、年龄以及个体遗传因素的影响[1]。本研究选用22头3周岁以内的通城公猪个体作为研究对象,排除了品种和年龄的差异。通过对精液冻存前后的精子活力检测和分析,发现不同个体之间的精子耐冻性仍存在差异(图1)。这些不同个体精子耐冻性的差异经过多个季节(从炎热的夏季到寒冷的冬季)的多批次精液冻存验证,其差异性确实存在。结合6个精子耐冻性差异个体的系谱亲缘关系(图2)和FST分析结果(图3),推断该耐冻性差异是受遗传因素影响。目前在长白猪、大白猪、杜洛克等猪品种或群体的研究中也观察到了这种个体间的精子耐冻性差异[18-19],且通过对22头大白猪精子耐冻性差异个体的扩增片段长度多态性(amplified fragment length polymorphism,AFLP)分析,证明了猪精子耐冻性差异存在遗传基础[20]。
3.2 猪精子耐冻性与应激反应、运动、离子通道和膜蛋白等生物学过程相关
冷冻保存对猪精液质量影响的潜在机制目前尚不完全清楚。mRNA和蛋白质表达水平的分析结果发现猪精子耐冻性差异与一些关键生物学过程有关。Fraser等[21]比较了不同耐冻性差异公猪的精子转录组数据,鉴定了几个与炎症和凋亡、精子发生以及能量代谢等相关的基因。Mańkowska等[22]利用RNA-Seq数据研究了猪精子中单核苷酸多态性与解冻后精液质量的关系,发现差异基因主要富集在应激反应、运动、代谢、生殖和胚胎发育等。长非编码RNA(lncRNA)分析表明,猪精子耐冻性差异表达lncRNA的靶基因与信号转导、应激反应、细胞凋亡、运动和胚胎发育等生物学过程有关[23]。此外,蛋白组学分析发现一些精子膜蛋白[11]、顶体结合蛋白(ACRBP)、糖酵解相关蛋白(TPI)[24]、水通道蛋白(AQP3、AQP7、AQP11)[8]以及热休克蛋白和电压依赖性阴离子通道蛋白[9,25]等均与猪精子耐冻性有关,可作为预测公猪精子耐冻性的标记。综上,mRNA和蛋白质水平的研究发现,猪精子耐冻性差异主要与精子的应激反应、运动、离子通道、膜蛋白以及顶体等相关。这与本研究筛选的差异候选基因所富集的生物学过程(膜蛋白定位、肌动蛋白细胞骨架、细胞形态和离子通道等)基本一致(图5),同时也筛选到了一些与胞吐、氧化应激、代谢和顶体结构等相关的基因,这都暗示着一些重要的生物学过程及关键基因可能参与了猪精子对冷刺激的应答反应。
3.3 猪精子耐冻性与基因有关
本研究在膜蛋白定位、肌动蛋白细胞骨架、细胞形态和离子通道等生物学过程鉴定到一些候选基因。其中,KCNG4、ARPC1B、DNAAF4、MNS1、LIMK2、RPL31和VIM等基因被报道与精子的生成和发育相关,可能参与了猪精子耐冻性的调控。KCNG4是钾电压门控通道修饰因子亚群G成员,参与精子发生的后期调控,该基因功能缺失会导致精子表现出头部较小、尾部较短的异常形态,导致雄性不育[26]。ARPC1B是一种雌激素反应基因,是精子发生、成熟精子细胞极性、血-睾屏障完整性和细胞分裂的调节因子[27]。DNAAF4基因在耐冻性个体和不耐冻个体间存在差异,其可以与HSP70和HSP90结合,而HSP70和HSP90都已被证实与猪精子耐冻性有关[25,28],DNAAF4基因的突变会导致原发性睫状体运动障碍,并伴有动力蛋白臂缺失,影响鞭毛运动[29]。MNS1在精子发生、精子鞭毛的组装和纤毛运动功能中起着重要作用[30],MNS1突变可导致雄性不育[31]。LIMK2基因参与抑制精子中肌动蛋白解聚活性,有助于Rho诱导的肌动蛋白细胞骨架的重组[32]。此外,RPL31基因被发现在荷斯坦公牛新鲜和冻融精子转录水平存在显著差异(P<0.05)[33];VIM基因则被认为可作为鉴定弱精的标志物[34]。上述基因在精子耐冻与不耐冻个体间具有显著差异,表明猪精子耐冻性与基因有关,可作为关键候选基因进一步研究其作用机制。

