柠檬酸发酵液中有机酸含量HPLC 法测定
满 云
(蚌埠学院 食品与生物工程学院,安徽 蚌埠233030)
1 引言
柠檬酸是生物体内主要的代谢产物之一。1913年首次报道黑曲霉能生成柠檬酸,柠檬酸生产的方法由提取法变为发酵法,柠檬酸为三羧酸循环过程中的中间产物[1](P229-230)。 柠檬酸发酵液中的其他有机酸主要包括谷氨酸、葡萄糖酸、草酸、苹果酸、乳酸、丙酮酸、乙酸、α-酮戊二酸、丁二酸、富马酸、乌头酸和衣康酸等[2](P65)。 有机酸含量过多,会影响柠檬酸的纯度,降低柠檬酸转化率。
目前对有机酸含量的检测方法很多[3][4](P121)[5-6],高效液相色谱技术应用于有机酸的含量检测也有很多报道[7-14],但已有的报道中测定的有机酸品种有限,同时测定多种有机酸的报道不多。 本实验利用高压液相色谱同时测定柠檬酸发酵液中的有机酸,通过选择适合的流动相pH 值、流速、柱温、检测波长等,拟建立准确可靠、简洁快速有效的检测方法,同时分析柠檬酸发酵液中的12 种杂有机酸,以期为柠檬酸发酵工艺的优化提供了理论依据。
2 材料与方法
2.1 供试材料和试剂
柠檬酸发酵液, 中粮生化柠檬酸生产线提供;乙腈(色谱纯),美国Tedia 公司生产;谷氨酸、葡萄糖酸、草酸、苹果酸、丙酮酸、乳酸、乙酸、琥珀酸(丁二酸)、富马酸(延胡索酸)、乌头酸、衣康酸、柠檬酸标准品,百灵威科技有限公司生产。
2.2 仪器与设备
1200 安捷伦色谱仪;Diamonsil C18 (4.6 mm×250 mm);检测器:PDA 检测器。
2.3 试验方法
2.3.1 标准酸混合液的配制
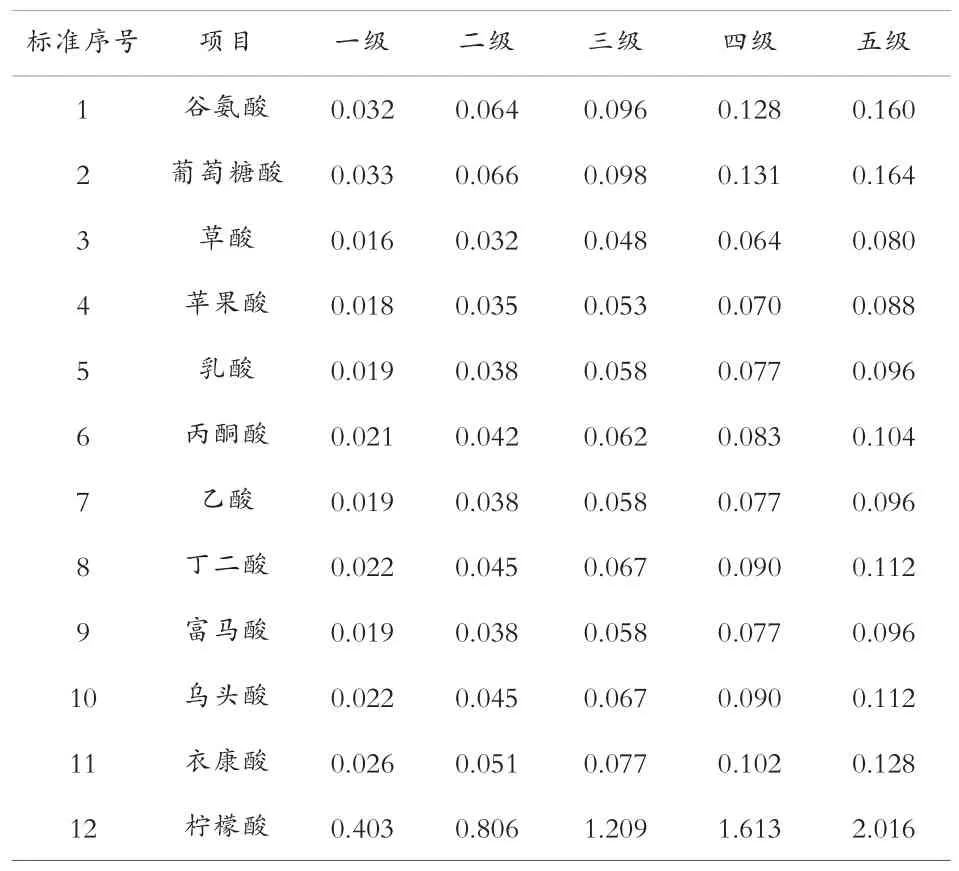
表1 混合标准液的配制 g/100 mL
因杂酸含量不定,为定量准确,配制多级混合标准液。 标准液采用蒸馏水配制,用0.22 μm 的滤膜过滤。 混合标准如表1 所示。
2.3.2 各种有机酸的定性和定量
(1)定性用各种有机酸的单一标准液分别进样,记下保留时间。
(2)定量用五级混合标准液,做标准曲线定量。
2.3.3 色谱条件
色谱柱 Diamonsil C18(4.6 mm×250 mm);流动相为0.1%磷酸溶液∶乙腈=96.5%:3.5%; 流速0.50 mL/min;检测器PDA 检测器;检测波长210 nm;柱温 25 ℃;进样量 10 μL。
2.4 样品前处理
取柠檬酸发酵清液,稀释10 倍,用0.22 μm 的滤膜过滤后进样分析。
3 结果与分析
3.1 色谱分离条件的确定
3.1.1 色谱柱的选择
针对有机酸组系,C18 柱在色谱应用中是应用最为广泛的色谱柱,故选择C18 柱分析。
3.1.2 流动相的选择和配制
(1)磷酸为 0.1%,pH 为 2.0,分离度较好;
(2)用0.1%磷酸与乙腈混合溶液作为流动相,调整磷酸溶液与乙腈的比例分别为90:10、93:7、96:4 和99:1 进行预实验,选好比例范围,再细化流动性配制比例,确定96.5:3.5 为流动相最佳配比。
3.1.3 检测波长的选择
将各种检测用标准酸在200~254 nm 吸光度下进行PDA 扫描,各酸在210 nm 左右均有较大吸收峰,确定适宜检测波长是210 nm。
3.1.4 进样量的选择
用标准有机酸混合液按 5 μL 和10 μL 的进样量进行适宜进样量比较分析,发现 5 μL 进样量时,峰形较小,10 μL 进样量时,峰形适中。
3.1.5 流速的选择
分别以流速 0.4 mL/min、0.5 mL/min、0.6 mL/min、0.7 mL/min、0.8 mL/min、0.9 mL/min 和 1.0 mL/min 进样分析。流速为0.4mL/min、0.5 mL/min 和0.6 mL/min时分离效果较好。 流速高,峰分离度差;流速低,分析时间长, 柱效差。 综合分离度和柱效, 确定0.5 mL/min 流速为最佳流速。
3.1.6 柱温的选择
根据色谱理论[4],柱温是影响柱效和分离度的主要因素。柱温升高可以降低流动相的粘度和提高树脂的传质效率,但是温度过高,不利于色谱柱的维护;同时,分析时间过短,也不利于分离。 因此,在0.5 mL/min 的流速下, 依次升高柱温至20℃、25℃、30℃和35 ℃时,发现柱温为25 ℃时分离效果较好。
3.2 柠檬酸发酵液中各种有机酸的定性与定量
3.2.1 有机酸的定性
分别用单一标准进样,用保留时间给各有机酸定性(见表 2)。
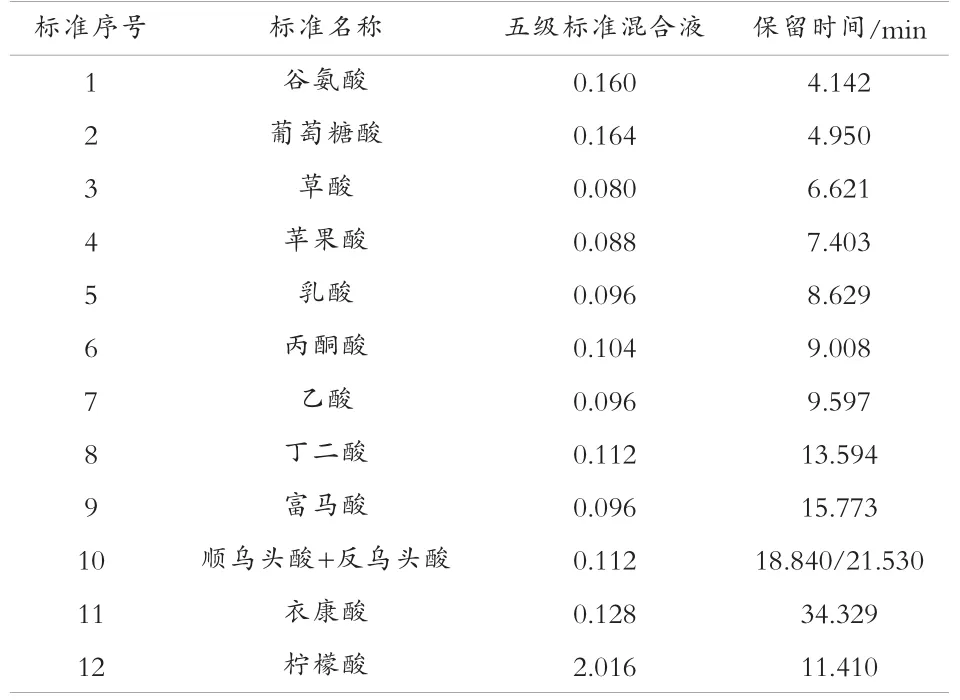
表2 12 种有机酸标准品保留时间
3.2.2 有机酸的定量
利用外标法对柠檬酸发酵液中的有机酸进行定量。 利用五级混合标准液做标准曲线,以各有机酸对照品质量浓度X 对峰面积进行线性回归,相关性R2均大于0.999,色谱图见图1 和图2。
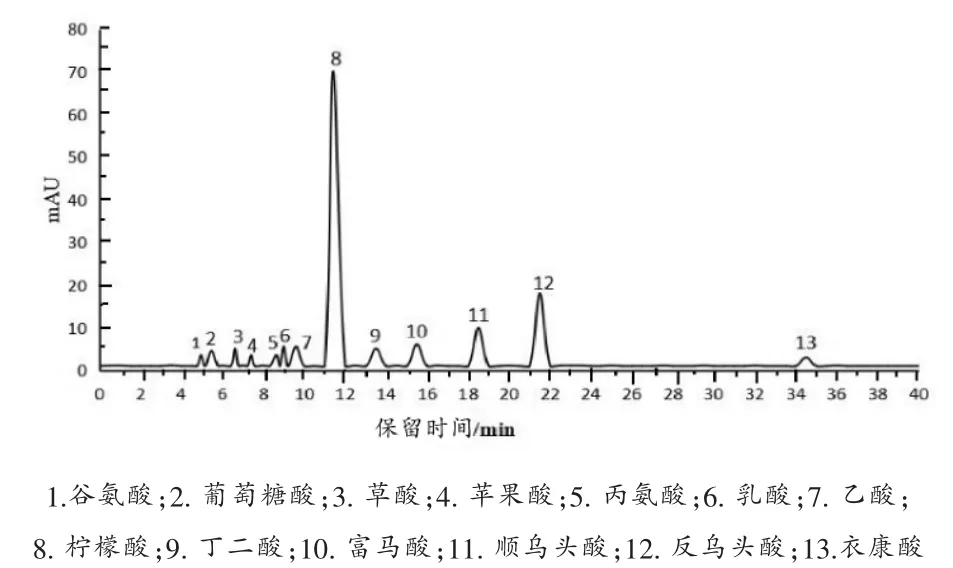
图1 有机酸混标色谱图
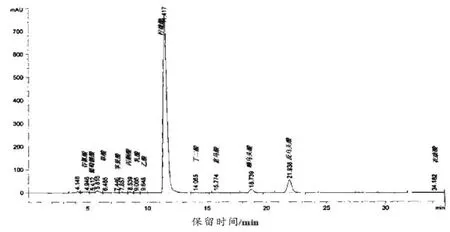
图2 柠檬酸发酵液中有机酸液相色谱图
3.3 重现性和回收率
3.3.1 重现性
将柠檬酸发酵液重复进样5 次,低含量杂酸的重现性如表3。
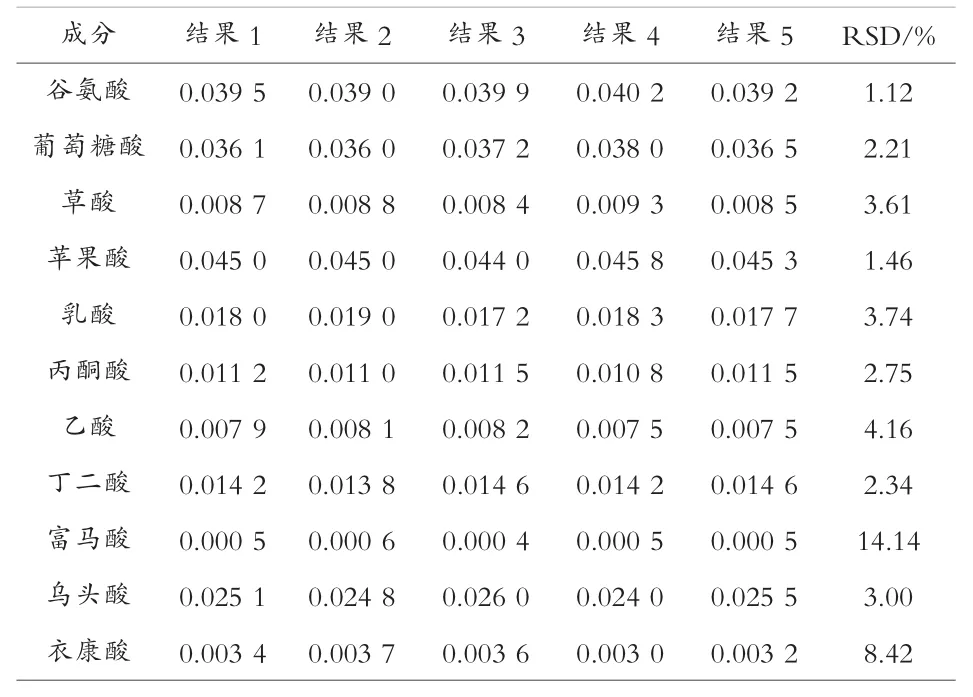
表3 方法的重现性实验结果
从表3 可以看出,除了富马酸、衣康酸几个痕量数据外,各有机酸含量的相对标准偏差(RSD)在0.32%~4.16%之间,重复性较好。
3.3.2 方法的回收率
在柠檬酸发酵清液中加入各种固体标准酸适量,超声混匀,进行高效液相色谱法测定,加入量和检出量的计算回收率结果如表4。
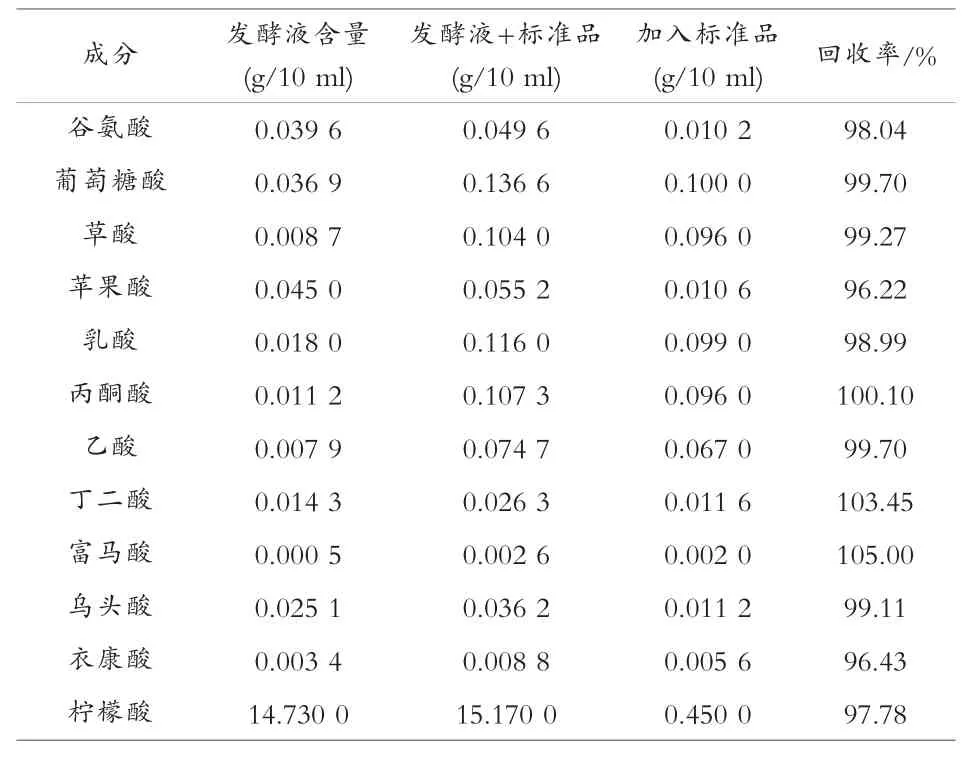
表4 回收率的统计
从表4 可以看出,有机酸发酵液中各有机酸加标回收率为96.22%~105.00%,方法的准确度较高。
3.4 柠檬酸发酵液中各有机酸含量的测定结果
按照前文样品前处理和色谱分离条件,准备测试样品和设置色谱条件。 测定生产菌(SC)在不同温度条件下的发酵,其他工艺条件相同时,发酵终点液中的有机酸含量测定结果见表5。
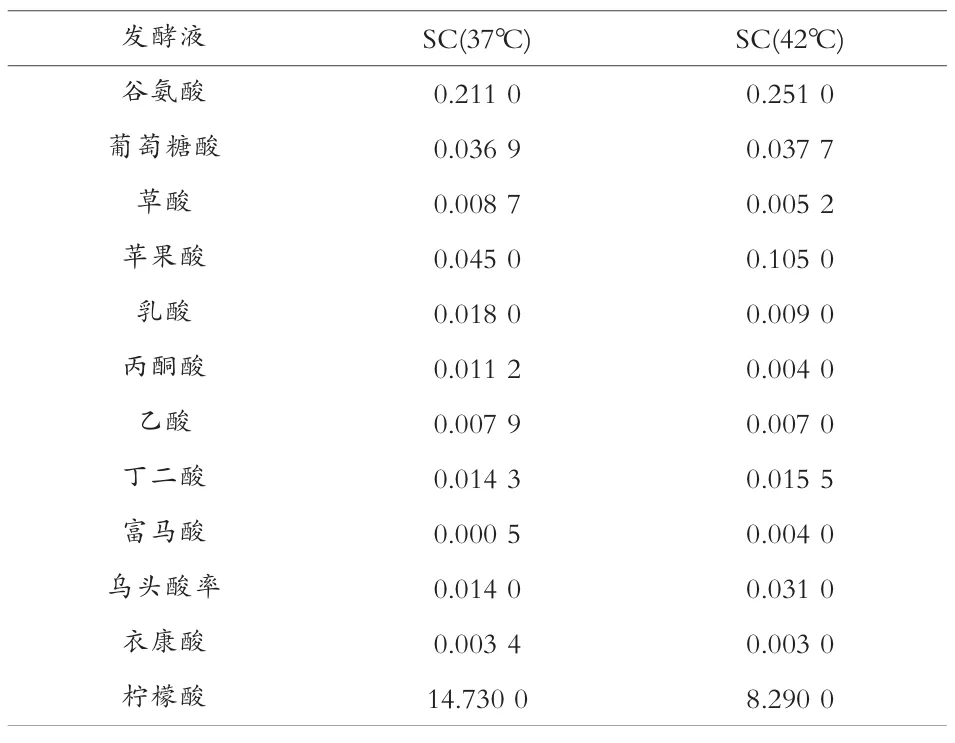
表5 不同发酵温度下发酵终点液中有机酸含量 g/100 mL
由表5 可以看出,发酵温度越高,柠檬酸产酸越低, 谷氨酸等其他杂酸越高, 根据每种杂酸的变化趋势, 还可以进一步分析代谢过程的关键控制点。
测定不同菌种在不同温度下的发酵,例如出发菌(CF)和诱变菌(YB),发酵终点液中主要杂酸含量的测定结果见表6。
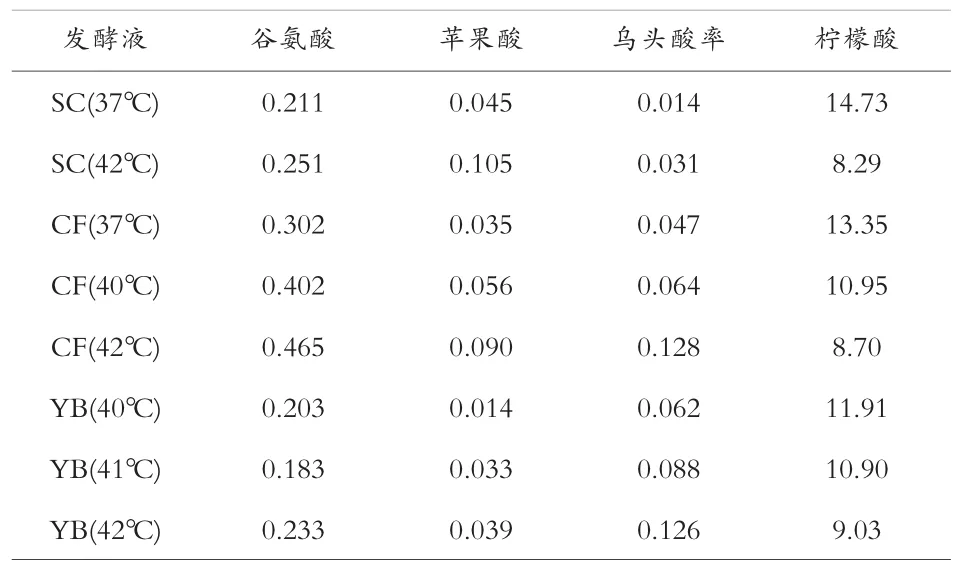
表6 不同发酵温度下发酵终点液中主要有机酸含量 %
由表6 可以看出,谷氨酸等其他杂酸含量随着温度的升高有明显升高。 同时,经过诱变的耐高温菌株,在高温发酵的时候,谷氨酸等杂酸含量有明显降低。 结果表明,HPLC 分析有机酸的方法,可以为菌种、发酵条件及发酵过程分析提供数据支持。
4 结语
本文采用HPLC 法测定柠檬酸发酵液中的12种有机酸杂质含量, 色谱柱为Diamonsil C18 (4.6 mm ×250 mm), 流动相为 0.1%磷酸溶液: 乙腈=96.5%∶3.5%, 流速为 0.50 mL/min, 检测器为 PDA检测器,检测波长为210 nm,柱温为25 ℃,进样量为10 μL。 该方法测得的各有机酸相对标准偏差为0.32% ~ 4.16%,加标回收率为96.22% ~ 105.00%。该方法简便快速、选择性好、准确度高,可适用于柠檬酸不同发酵时间点的数据监控,也可用于监控指导柠檬酸后续提纯过程。

