芪冬活血饮对急性肺损伤小鼠肺泡巨噬细胞iRhom2/TACE信号通路的影响
郑继生 钱景莉 姜娜 魏毅 何海栋 马春芳 蔡宛如 柴秀娟
1.浙江省立同德医院 杭州 310012 2.浙江中医药大学附属第二医院 3.浙江省人民医院
急性肺损伤是一种严重的呼吸系统疾病,具有较高的发病率和死亡率[1],其特征在于肺泡损伤、严重的低氧血症、失控的炎症反应和细胞因子蓄积,部分病例最终发展为急性呼吸窘迫综合征。虽然已进行了大量的研究,但目前尚无特效的治疗方法和药物。肠缺血/再灌注诱导的急性肺损伤继发于过度的全身炎症反应,该炎症反应由再灌注的缺血性肠组织释放促炎性细胞因子和细菌衍生的内毒素两方面因素引起[2-3]。
既往研究证实,肺泡巨噬细胞在维持肺稳态方面起着至关重要的作用[4],巨噬细胞的持续激活是加速急性肺损伤的重要步骤之一[5]。在急性肺损伤过程中,巨噬细胞通过产生促炎性介质、趋化因子和细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素-6(interleukin-6,IL-6)等发挥促炎作用[5-6]。研究发现,巨噬细胞中未活化的菱形蛋白2(inactive rhomboid protein 2,iRhom2)/肿 瘤 坏 死 因子 -α 转 化 酶 (tumor necrosis factor-α convertase,TACE)信号通路在肠缺血/再灌注引起的全身性炎症中起着重要作用[7]。因此,干扰巨噬细胞中iRhom2/TACE通路可能是治疗急性肺损伤的潜在方法。
芪冬活血饮由黄芪、麦冬、虎杖、当归、大黄共五味药物组成,具有抗炎、抗纤维化等多种功效[8]。研究表明,芪冬活血饮可显著减少急性肺损伤小鼠的肺组织中炎症细胞浸润,减轻肺泡间隔水肿、出血和肺泡结构的破坏[8];并可通过Toll样受体4(Toll receptor 4,TLR4)/核因子-κBp65(nuclear factor-κB p65,NF-κBp65)通路减轻脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞炎性反应[8-9]。然而,芪冬活血饮抗炎的具体分子机制尚不清楚。因此,本研究拟探讨芪冬活血饮对肠缺血/再灌注诱导的急性肺损伤小鼠肺泡巨噬细胞中iRhom2/TACE信号通路的影响,为芪冬活血饮治疗急性肺损伤提供进一步的实验依据。
1 材料和方法
1.1 主要试剂 芪冬活血饮由黄芪20g、麦冬12g、虎杖20g、当归12g、大黄6g组成,药物均由浙江省立同德医院中药房提供,由浙江中医药大学制剂室制成质量体积比1:1的汤剂,灭菌处理后,-4℃保存备用;洛斯维尔·帕克纪念研究所(Roswell Park Memorial Institute,RPMI)1640培养基购于美国Gibco公司(批号:31800022);小鼠TNF-α检测试剂盒和IL-6检测试剂盒均购于美国OmnimAbs公司(批号:OM453712、OM440044);末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL)凋亡检测试剂盒购于武汉普健生物科技有限公司(批号:ATK00001);4',6- 二 脒 基 -2- 苯 基 吲 哚 (4',6-diamidino-2-phenylindole,DAPI) 购于美国Sigma公司(批号:D9542);TRIzolTM试剂购于美国Invitrogen公司(批号:15596018);放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液和二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒购于上海碧云天生物技术有限公司(批号:P0013B、P0009);辣根过氧化酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG二抗(1:5 000)购于武汉三鹰公司(批号:SA00001-2);抗磷酸甘油醛脱氢酶(phosphoglyceraldehyde dehydrogenase,GAPDH)抗体(1:5 000)购于杭州科研云生物科技有限公司(批号:ATPA00013Rb);抗iRhom2(1:1 000)和抗TACE抗体(1:1 000)均购于美国abcam公司(批号:ab81342、ab2051)。
1.2 主要仪器 C2500-R-230V型微型高速离心机购于Labnet公司;Multiskan MK3型全自动酶标仪购于Thermo scientific公司;ChemiDocTMXRS+凝胶成像系统为Bio-rad公司产品;UltraVIEW VoX&IX81激光共聚焦显微镜成像系统及BX53正置荧光显微镜均购于Olympus公司;NanoDrop 2000型超微量分光光度计购于Thermo公司。
1.3 实验动物 无特定病原体(specific pathogen free,SPF)级雌性C57BL/6小鼠24只,8~10周龄,体质量(20±2)g,购于上海斯莱克实验动物有限责任公司[实验动物生产许可证号:SCXK(沪)2017-0005]。 小鼠饲养及实验均在杭州科研云生物科技有限公司标准化动物中心进行[实验动物使用许可证号:SYXK(浙)2017-0003]。 所有小鼠均饲养在20~26℃,湿度40%~70%,12/12h光照黑暗交替的环境中。实验前小鼠禁食12h,自由饮水。
1.4 小鼠肠缺血/再灌注诱导急性肺损伤模型的建立所有小鼠被随机分为6组,即正常组、假手术组、模型组、芪冬活血饮低剂量组、芪冬活血饮中剂量组和芪冬活血饮高剂量组。模型组、芪冬活血饮低剂量组、芪冬活血饮中剂量组和芪冬活血饮高剂量组小鼠腹腔内注射50mg·kg-1戊巴比妥钠后,通过夹闭肠系膜上动脉诱发肠缺血,肠缺血期间间断缝合暂时关闭腹腔,关腹后立即腹壁皮下注入1mL的0.9%氯化钠溶液,40min后松开动脉夹,恢复血流灌注,关闭腹腔。假手术组仅开腹后关闭腹腔,不夹闭肠系膜上动脉。正常组不作任何处理。芪冬活血饮低、中、高剂量组小鼠在造模前24、12h以及造模后2、14h分别用2、4、8mL·kg-1芪冬活血饮灌胃,此后每天给药2次,共给药4d。模型组给予等量0.9%氯化钠溶液灌胃。所有实验均按照实验动物的护理和使用指南的指导原则进行,本研究得到了浙江省立同德医院伦理委员会的批准(批准文号:2019032)。
1.5 肺泡巨噬细胞的分离及培养 小鼠脱颈椎处死后,结扎右主支气管,以37℃的0.9%氯化钠溶液1mL灌洗左肺,灌洗后分离右肺,-70℃保存备用。灌洗液停留1min后回收,间隔10min重复灌洗1次,共3次。合并灌洗液并定量,1 200r/min离心10min,取细胞沉淀制成单细胞悬液,高倍镜下行细胞计数,调整细胞浓度为1.5×106个/mL。 随后将单细胞悬液2mL、RPMI 1640培养基7mL和新生胎牛血清1mL铺于6孔板上,充分混匀后于37℃、5% CO2的培养箱内培养,保证巨噬细胞贴壁生长,2.5h后换液并拍照。
1.6 检测指标
1.6.1 小鼠肺泡巨噬细胞TNF-α和IL-6水平检测 以超声细胞破碎仪对巨噬细胞悬液进行超声处理。5 000r/min离心5min后,收集上清液。分别使用小鼠TNF-α检测试剂盒和IL-6检测试剂盒检测肺泡巨噬细胞上清液中TNF-α和IL-6水平,实验重复3次。
1.6.2 小鼠肺泡和细支气管上皮细胞凋亡检测 采用TUNEL染色法检测右肺组织中的凋亡细胞。以4%多聚甲醛固定肺组织,石蜡包埋后行4μm切片。切片脱蜡并水化后,使用TUNEL试剂盒检测肺组织切片中的细胞凋亡情况。在每个切片中随机选择5个视野,400倍光镜下计数,并计算细胞凋亡率,细胞凋亡率(%)=凋亡阳性细胞数/细胞总数×100%。
1.6.3 小鼠肺泡巨噬细胞TACE和iRhom2 mRNA表达检测 采用实时荧光定量聚合酶链反应(Real-timequantitative polymerase chain reaction,RT-qPCR)检测肺泡巨噬细胞中TACE和iRhom2的mRNA表达水平。所有引物均由上海生工生物工程有限公司设计合成。见表1。RT-qPCR反应体系如下:上下游前引物各1μL,2×mix 10μL,H2O 7μL和互补DNA(complementary DNA,cDNA)1μL。 反应条件:95℃预变性2min,1个循环;95℃变性15s,53℃扩增20s,60℃延伸3s,共40个循环。记录每个样品的定量循环 (quantitative cycle,Cq),作为样品中PCR产物量的定量度量。以GAPDH为内参,使用2-ΔΔCq方法计算目的基因mRNA的相对表达水平。

表1 引物序列Tab.1 Primer sequences
1.6.4 小鼠肺泡巨噬细胞TACE和iRhom2蛋白表达检测 采用Western blot法检测TACE和iRhom2蛋白表达。提取肺泡巨噬细胞总蛋白,采用BCA法进行蛋白定量。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离细胞裂解液中的蛋白,并转移至聚偏二氟乙烯膜上,分别加入抗iRhom2(稀释比例:1:1 000)、抗TACE(稀释比例:1:1 000)和抗GAPDH(稀释比例:1:5 000)一抗,孵育过夜后加入过氧化物酶偶联的二抗(稀释比例:1:5 000)孵育。洗膜后电化学发光显影,Image J软件分析条带灰度值。
1.7 统计学分析 应用GraphPad Prism 8.0统计软件进行统计学分析。计量资料以±s表示,多组间差异比较采用单因素方差分析 (one-way analysis of variance,ANOVA),方差齐时进一步两两比较采用最小显著性差异(least significant difference,LSD)法;方差不齐时采用Dunnett法。以P<0.05为差异有统计学意义。
2 结果
2.1 芪冬活血饮改善肠缺血/再灌注诱导的急性肺损伤 各组小鼠肺泡巨噬细胞的形态学差异如图1所示。假手术组贴壁的巨噬细胞数目少于模型组,而且巨噬细胞较圆、无明显触角;模型组巨噬细胞多为有触角状,说明模型组肺泡灌洗液中巨噬细胞的功能、特性可能发生了变化。经芪冬活血饮治疗后,贴壁的巨噬细胞数目减少且形态变圆。

图1 肺泡巨噬细胞的分离和培养Fig.1 Isolation and culture of alveolar macrophages
2.2 各组小鼠肺泡巨噬细胞分泌TNF-α和IL-6的水平比较 ELISA检测结果显示,与假手术组比较,模型组肺泡巨噬细胞分泌TNF-α和IL-6水平显著增加,差异有统计学意义(P<0.0001)。经芪冬活血饮治疗后,肺泡巨噬细胞分泌的TNF-α和IL-6水平显著降低(P<0.01,P<0.001,P<0.0001)。 见图2A、B。
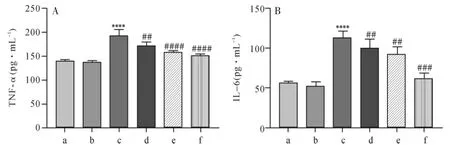
图2 各组肺泡巨噬细胞分泌TNF-α和IL-6水平比较Fig.2 Comparison of secretion of TNF-α and IL-6 by alveolar macrophages in each group
2.3 各组小鼠肺泡和细支气管上皮细胞凋亡情况比较 TUNEL染色结果表明,与假手术组比较,模型组小鼠的肺泡和细支气管上皮细胞凋亡明显增多。芪冬活血饮各剂量组小鼠TUNEL阳性细胞显著减少。随着芪冬活血饮浓度的增加,急性肺损伤小鼠上皮细胞的凋亡水平逐步降低,差异有统计学意义(P<0.05,P<0.01,P<0.001)。 见图3、4。

图3 各组小鼠肺泡和细支气管上皮细胞凋亡情况(TUNEL染色,400×)Fig.3 Apoptosis of alveolar and bronchiolar epithelial cells in each group(TUNEL staining,400×)

图4 各组小鼠肺泡和细支气管上皮细胞凋亡比较Fig.4 Comparison of alveolar and bronchiolar epithelial cells apoptosis in each group
2.4 各组小鼠肺泡巨噬细胞iRhom2和TACE表达比较与假手术组比较,模型组肺泡巨噬细胞中TACE和iRhom2的mRNA表达水平显著增高 (P<0.001,P<0.0001);与模型组比较,芪冬活血饮各剂量组小鼠的肺泡巨噬细胞中,TACE和iRhom2的mRNA表达显著被抑制,且具有浓度依赖性(P<0.05,P<0.001,P<0.0001)。见图5A、B。与假手术组比较,模型组小鼠的肺泡巨噬细胞中TACE和iRhom2的蛋白水平显著增高(P<0.01);而随着芪冬活血饮浓度的增加,各剂量组小鼠肺泡巨噬细胞中TACE和iRhom2的蛋白水平逐步降低(P<0.05)。 见图6。

图5 各组小鼠肺泡巨噬细胞中iRhom2和TACE mRNA水平比较Fig.5 Comparison of iRhom2 and TACE mRNA levels in alveolar macrophages in each group

图6 各组小鼠肺泡巨噬细胞中iRhom2和TACE蛋白水平比较Fig.6 Comparison of iRhom2 and TACE protein levels in alveolar macrophages in each group
3 讨论
中医认为,急性肺损伤属于“肺热腑实”证。根据“清热解毒、祛瘀通腑”为主的治疗原则,采用虎杖、黄芪、麦冬、当归及大黄几味药物组成芪冬活血饮以肺肠合治。此方是名老中医王会仍教授通过长期临床实践而创立的经验方,在临床用于救治急性肺损伤患者具有显著疗效。同时,前期研究及其他相关的实验研究结果显示,芪冬活血饮对急性肺损伤大鼠具有肺保护作用[8-9],然而具体的分子机制尚不明确。本研究旨在通过构建由肠缺血/再灌注诱导的急性肺损伤小鼠模型,探索芪冬活血饮对急性肺损伤小鼠肺泡巨噬细胞iRhom2/TACE信号通路的影响。研究结果显示,经芪冬活血饮干预的急性肺损伤小鼠肺泡巨噬细胞上清液中,炎症因子TNF-α和IL-6水平均显著降低,提示芪冬活血饮能改善肠缺血/再灌注损伤引起的肺部炎症。
研究证实,细胞凋亡是急性肺损伤中另一种可能的病理生理机制[10-12]。本研究提示,与假手术组比较,肠缺血/再灌注诱导的急性肺损伤模型小鼠的肺上皮细胞凋亡显著增加,而芪冬活血饮干预后小鼠肺上皮细胞凋亡程度显著降低。此外,芪冬活血饮还能够抑制急性肺损伤小鼠肺泡巨噬细胞中iRhom2和TACE的mRNA和蛋白表达,提示芪冬活血饮可通过抑制该通路缓解急性肺损伤。
促炎细胞因子水平的过度升高是肠缺血/再灌注继发远端器官损伤的主要因素[13]。在众多的促炎细胞因子中,TNF-α和IL-6在肠缺血/再灌注诱导的急性肺损伤的发生和发展中起着关键作用[7]。临床前和临床研究报道,抑制TNF-α的表达可能会缓解包括克罗恩病在内的多种疾病的炎症过程,而阻断TNF-α可以改善肺微血管通透性[14]。研究发现,IL-6是急性肺损伤患者预后不良的预测因子[7]。本研究结果显示,肠缺血/再灌注诱导的急性肺损伤模型小鼠的巨噬细胞中TNF-α和IL-6水平显著升高,说明TNF-α过度激活可能在肠缺血/再灌注引起的肺损伤中起主要作用;而芪冬活血饮干预后,肺泡巨噬细胞分泌TNF-α和IL-6水平显著下降。
由于TACE对于TNF-α的释放具有重要影响,因此阻断TACE被认为是TNF-α介导的炎症性疾病的治疗方法[13]。既往研究表明,在RAW264.7巨噬细胞中,LPS能够促进TNF-α的分泌,而小干扰RNA(small interfering RNA,siRNA)介导的iRhom2表达降低则显著抑制了TNF-α的分泌[7]。在iRhom2缺陷型巨噬细胞中,其他炎症因子产生显著增加,如IL-1β、IL-6和IL-12[15-17]。此外,Kim等[18]研究提示,急性肺损伤的iRhom2缺陷小鼠的肺组织细胞凋亡程度显著低于野生型小鼠,表明iRhom2缺陷直接和(或)间接抑制了肺组织细胞凋亡。在本研究中,与模型组比较,芪冬活血饮各剂量组小鼠肺损伤程度减轻,小鼠肺泡巨噬细胞中iRhom2/TACE通路的活性受到抑制。
综上所述,本研究结果表明芪冬活血饮能够有效改善肠缺血/再灌注诱导的急性肺损伤,其机制可能与抑制小鼠肺泡巨噬细胞中iRhom2/TACE信号通路有关,但芪冬活血饮治疗急性肺损伤中的具体机制及量效关系值得更深入的研究。

