麦洼牦牛、西藏牛和荷斯坦牛C1 QBP基因及其蛋白表达研究
钟金城,钟 美,益西康珠,王吉坤,柴志欣,王 会,王嘉博
(西南民族大学青藏高原研究院,四川 成都 610041)
牦牛(Bosgrunniens)作为青藏高原的特有牛种,是其它畜种资源无法代替的特殊种质资源[1-3].国内外众多学者已从牦牛的解剖结构[4-6]、生理生化特性[7-8]、低氧适应基因及相关分子机制[9-14]等方面研究了牦牛的高原适应性.Chen等[15]通过对49个现代牛品种和8个古代牛品种的基因组进行对比研究,在基因渐渗分析中发现,牦牛的基因有往西藏牛群体渐渗的现象,渐渗区间的错义突变基因主要参与免疫反应和低氧适应性过程;牦牛在高原适应过程中,免疫反应、氧化应激、低氧适应等相关通路被显著激活.Xin等[16]在对牦牛、三江牛、荷斯坦牛、西藏牛的肺和肌肉组织进行比较转录组分析时,发现牦牛和西藏牛基因组中与免疫相关的基因更活跃,牦牛和西藏牛有11条先天免疫相关的通路被激活,从而降低感染和发病的风险,这些变化可能与牦牛高原适应有关.
C1QBP是高度保守、功能丰富的酸性蛋白,通过结合多种蛋白配体参与细胞免疫、代谢、增殖、凋亡等生物调控过程[17-18].研究表明C1QBP在机体缺氧、缺血造成的氧化应激中发挥重要作用[19-20],C1QBP可通过调控线粒体通透性转变孔的闭合,减少氧化应激引起的细胞死亡[21].Li[22]等研究也表明C1QBP可通过启动Sp1-ZNF32-C1QBP轴保护机体免受氧化应激的影响.在不同浓度的ROS水平下,ZNF32的表达受Sp1调控,调节C1QBP的表达以应对氧化应激.当ROS水平过高,细胞遭受过度的氧化应激时,Sp1抑制ZNF32的表达,从而导致C1QBP表达下调,线粒体功能障碍和抗氧化系统受损,最终导致p38/MAPK途径激活和细胞死亡[23].而C1QBP表达增加可维持线粒体膜电位平衡,将ROS水平降至对细胞活力无害,所以C1QBP基因表达增加有利于机体维持线粒体膜电位平衡和内源性抗氧化系统增强.
目前,牦牛高原适应性的相关研究虽然有大量报道,但与牦牛免疫基因相关的研究鲜有涉及,为探究C1QBP基因在牦牛高原适应性中发挥的作用,本研究对C1QBP基因在麦洼牦牛、西藏牛和荷斯坦奶牛的心脏、脾脏、肺脏、大脑、小脑组织中的mRNA相对表达量,以及小脑组织中C1QBP蛋白的表达进行检测和分析,以期为进一步深入研究C1QBP基因在牦牛高原适应性中的分子调控机制提供基础.
1 材料与方法
1.1 材料
1.1.1 实验样品
于四川省阿坝藏族羌族自治州红原县选取成年健康的麦洼牦牛3头,汶川县选取荷斯坦奶牛3头,西藏自治区昌都市类乌齐县选取西藏牛3头(表1).屠宰后采集其心脏、脾脏、肺脏、大脑和小脑组织,用DEPC水将组织洗净、锡箔纸包裹标记,于液氮保存带回实验室备用.

表1 试验样品信息Table1 Test sample information
1.1.2 主要试剂
Trizol(Life technologies),PrimeScriptTM RT逆转录试剂盒、TB Green©Premix Ex TaqTMⅡ定量试剂盒(宝生物工程大连有限公司),DL-2000 Marker(天根生化科技北京有限公司),蛋白酶抑制剂混合液、高效RIPA组织/细胞裂解液(北京索莱宝生物科技有限公司),5×SDS蛋白上样缓冲液,BCA蛋白浓度测定试剂盒(碧云天生物技术),兔抗C1QBP多克隆抗体、高灵敏ECL发光试剂(生工生物工程(上海)股份有限公司),兔抗β-actin抗体、二抗辣根过氧化物酶(HRP)标记的羊抗/兔(北京博奥森生物技术有限公司),以及其他实验室常规试剂.
1.2 方法
1.2.1 引物设计与合成
参照牦牛C1QBP基因(XM_005906086.2)mRNA的预测序列,利用Primer Premier 5.0软件设计C1QBP基因荧光定量引物和内参β-actin定量引物均由擎科生物工程(上海)股份有限公司合成(表2).
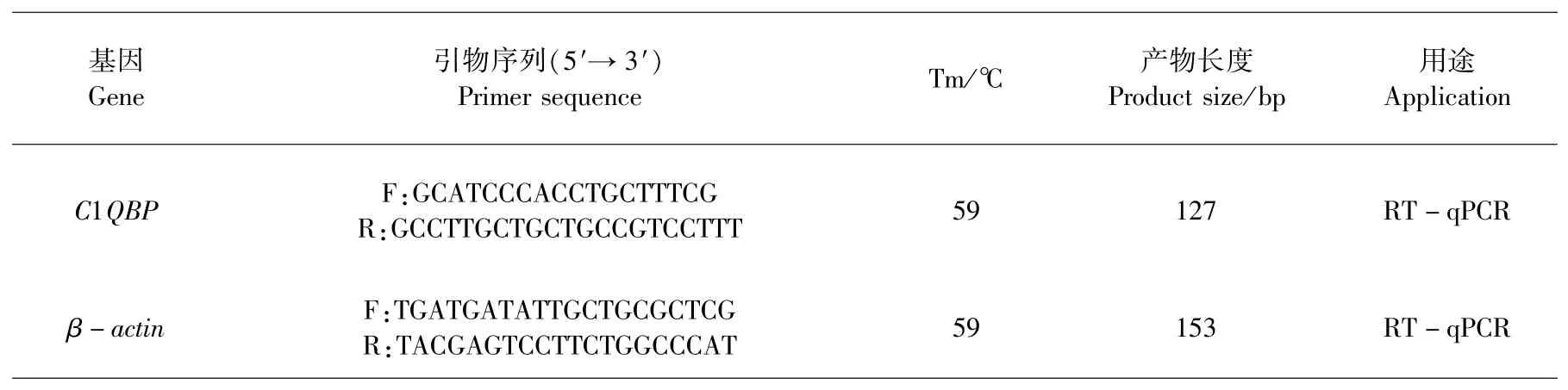
表2 引物序列信息Table 2 Primer sequence information
1.2.2 总RNA提取及反转录
按照Trizol法提取总RNA,用NanoDropTMOne 2 000分光光度计检测RNA样品的纯度和浓度,电泳检测RNA的完整性.使用反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)将提取的总RNA反转录成cDNA,-20℃保存.
1.2.3 Western blot检测
Western blot样品制备、蛋白浓度测定参照“BCA蛋白浓度测定试剂盒”使用说明,收集蛋白以每泳道20μL蛋白上样,经120 min电泳后,电转膜至PVDF膜,用5%脱脂牛奶进行封闭处理;分别加入一抗C1QBP(1∶500),β-actin(1∶5 000),4℃封闭过夜后用TBST洗涤3次,10 min/次;室温孵育二抗(1∶4 000)1 h,TBST洗涤3次后暗室进行ECL显色,分析条带.
1.3 实时荧光定量PCR(Real-time PCR)
用TB GreenTMPremix ExTaqTMⅡ试剂(TaKaRa),检测C1QBP基因在麦洼牦牛、西藏牛和荷斯坦奶牛的心脏、脾脏、肺脏、大脑和小脑组织中的相对表达量.反应程序和体系参考侯孟典等[24]研究方法.并记录熔解度曲线以鉴定引物的特异性,每个样品设置3个生物学重复,3个技术重复,以β-actin为内参基因,得到每个样品的Ct值,利用2-ΔΔCt法计算得到各个样本的相对表达量.利用SPSS22.0程序,分析C1QBP基因在各组织间的差异显著性,GraphPad Prism 5绘制C1QBP基因组织相对表达柱状图.
2 结果与分析
2.1 C1 QBP基因在三种牛各组织中的表达
RT-qPCR结果(图1)表明,C1QBP基因在麦洼牦牛脾脏中的表达最低;心脏中的表达最高,极显著高于脾脏、肺脏、大脑和小脑(P<0.01);肺脏中的表达极显著低于心脏、小脑(P<0.01),显著低于大脑(P<0.05);大脑与小脑间差异不显著(P>0.05).

图1 麦洼牦牛C1 QBP基因组织表达量注:不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05),图2、3同Fig.1 Tissue expressions of C1 QBP gene in Maiwa yak Note:The difference between different capital letters mean extremely significant(P<0.01),different lowercase letters mean significant difference(P<0.05),the same letters mean no significant difference(P>0.05),the same as figure 2 and 3
C1QBP基因在西藏牛心脏组织中的表达量最高(图2),极显著高于脾脏、肺脏、大脑和小脑(P<0.01);肺脏最低(P<0.01);小脑中的表达量显著高于脾脏和肺脏(P<0.05);大脑与小脑间差异不显著(P>0.05).
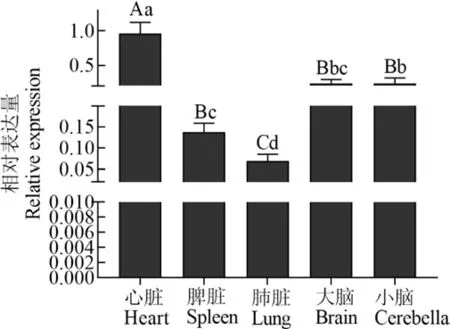
图2 西藏牛C1 QBP基因组织表达量Fig.2 Tissue expressions of C1 QBP gene in Tibetan cattle
C1QBP基因在荷斯坦奶牛心脏组织中表达量最高(图3),极显著高于脾脏、肺脏(P<0.01),显著高于大脑和小脑(P<0.05);肺脏中的表达极显著低于大脑(P<0.01),显著高于脾脏(P<0.05),与小脑差异不显著(P>0.05);脾脏中的表达极显著低于大脑(P<0.01),与小脑差异不显著(P>0.05);大脑和小脑间差异不显著(P>0.05).
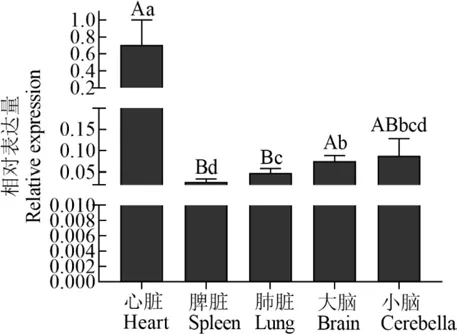
图3 荷斯坦奶牛C1 QBP基因组织表达量Fig.3 Tissue expressions of C1 QBP gene in Holstein cow
2.2 牦牛与普通牛间C1 QB P基因差异表达
从图4可见,C1QBP基因在西藏牛的心脏、大脑和小脑中表达均显著低于牦牛和荷斯坦奶牛(P<0.05),在肺脏中的表达量极显著低于牦牛和荷斯坦奶牛(P<0.01).C1QBP基因在牦牛小脑中的表达显著高于西藏牛和荷斯坦奶牛(P<0.05).

图4 C1 QBP基因在三种牛不同组织中的表达趋势注:误差棒表示标准误;ns:不显著(P>0.05),*:显著(P<0.05),**:极显著(P<0.01),图7同Fig.4 The expression trend of C1 QBP gene in different tissues of bovine animals Note:Error bars expressed standard error;ns:not significant(P>0.05),*:significant difference(P<0.05),**:extremely significant difference(P<0.01),the same as figure 7
2.3 三种牛小脑组织C1QBP蛋白表达
SDS-PAGE纯化结果显示(图5),牦牛、西藏牛和荷斯坦奶牛在25~55 kDa之间有蛋白存在.C1QBP蛋白大小为31 kDa,内参β-actin蛋白大小为42 kDa(图6).

图5 牦牛、西藏牛和荷斯坦奶牛小脑C1QBP的SDS-PAGE结果Fig.5 SDS-PAGE results of C1QBP protein in cerebella of bovine animals
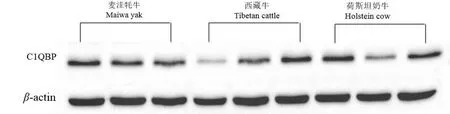
图6 牦牛、西藏牛和荷斯坦奶牛小脑C1QBP的Western blot结果Fig.6 Western blot results of C1QBP protein in cerebella of bovine animals
以C1QBP光密度值/β-actin光密度值表示C1QBP蛋白的相对表达量.Western blot结果显示(图7),C1QBP蛋白在麦洼牦牛、西藏牛和荷斯坦奶牛小脑组织中均有表达.小脑组织中C1QBP蛋白的表达趋势是荷斯坦奶牛最高,西藏牛次之,麦洼牦牛最低.在小脑组织中C1QBP蛋白的表达水平为牦牛显著低于荷斯坦奶牛(P<0.05),西藏牛与麦洼牦牛和荷斯坦奶牛之间差异不显著(P>0.05).

图7 C1QBP蛋白的Western blot灰度值Fig.7 Western blot analysis of C1QBP protein
3 讨论
本研究对C1QBP基因在麦洼牦牛、西藏牛和荷斯坦奶牛各组织中的表达进行检测和分析,发现该基因在三种牛组织中的表达趋势基本一致,心脏组织中的表达均最高,肺脏中存在差异.与C1QBP基因在人[25]和鼠[26]大脑组织中表达量最高的结果存在差异,显示这个基因的组织表达具有物种特异性.C1QB P基因参与机体的免疫反应,且牦牛与西藏牛在高原适应过程中,免疫相关基因表达活跃[15-16],C1QB P基因在麦洼牦牛组织中的表达水平均高于西藏牛(脾脏组织除外),这与牦牛适应高原生态环境条件相一致.C1QBP基因在牦牛与西藏牛组织间的表达趋势不一致,可能与西藏牛在高原环境下,机体产生应激反应,体内免疫能力下降,从而造成其在脾脏中表达量增加有关.因为脾[27]是重要的淋巴器官,可以制造免疫球蛋白、补体等免疫物质,发挥免疫作用,当处于运动、失血、缺氧等应激状态时可将血液排送到血循环中,增加血容量,减轻应激反应.
Chowdhury等[28]研究表明小鼠细胞过表达C1QB P,会诱发细胞产生过量ROS,促使线粒体功能发生障碍,加速细胞凋亡.但C1QB P可通过调控线粒体通透性转变孔的闭合,减少氧化应激引起的细胞死亡[21].Li[22]等研究表明C1QBP表达降低,线粒体功能障碍和抗氧化系统受损,导致p38/MAPK途径激活,细胞死亡[23].因此机体在氧化应激刺激下,C1QB P基因表达增加有利于线粒体维持正常功能和抗氧化系统的增强,本研究结果发现C1QBP基因在除脾脏外的其他组织中,麦洼牦牛表达量显著高于西藏牛与这些研究的结果一致.Western blot结果显示C1QB P的基因表达水平与蛋白表达水平相反,或与mRNA自身存在贮存、转运、降解、翻译调控及产物的翻译后加工有关.
4 结论
本研究对麦洼牦牛、西藏牛、荷斯坦牛C1QB P基因进行组织表达和Western blot分析,结果显示C1QB P基因表达升高有利于维持牦牛线粒体的正常功能和抗氧化系统增强,提高牦牛对高原生态环境条件的适应性.

