免疫检查点HHLA2和PD-L1在肝癌组织中的表达及临床意义
杨静文,唐小童,郭 辉,朱 悦,张甜甜,刘 杨,吴 穷,汪 蕊
肝细胞癌(hepatocellular carcinoma,HCC),简称“肝癌”,是原发性肝癌最主要的病理类型,占原发性肝癌的75%~85%。2018年,全球范围内肝癌发病率位于恶性肿瘤第6位,癌症相关死亡第4位,给人类带来了沉重的健康负担[1]。我国是名副其实的HCC大国和重灾国,约占全世界53.5%的比例,且致死率高达93%[2-3]。HCC起病隐袭,约80%病人在就诊时即为晚期,失去了手术根治的时机。系统治疗是无法切除的局部晚期和复发转移性HCC的重要治疗手段。尽管以索拉非尼为代表的多靶点小分子酪氨酸激酶抑制剂为晚期HCC带来了希望,然而也只有中等程度的获益。近些年,免疫检查点抑制剂程序性死亡配体-1(programmed cell death protein 1,PD-1)/PD-L1(programmed cell death protein 1 ligand)单抗成为抗肿瘤药物中的明星产品,已在多种实体瘤和血液系统肿瘤中都显现了突出疗效。免疫检查点抑制剂在晚期HCC中临床疗效也备受关注,CheckMate 040 Ⅰ/Ⅱ期队列研究表明PD-1单抗(纳武单抗)对晚期HCC病人表现出良好的安全性及耐受性[4]。尽管PD-1单抗为部分晚期HCC病人带来了持久的客观缓解率,然而仍有部分人群无法从PD-1单抗治疗中获益,可能和肝癌存在其他免疫抑制机制有关。因此,深入研究HCC发生相关的免疫机制,探寻改善现有免疫靶向药物疗效的方法具有重要临床意义。人内源性逆转录病毒-H长端重复相关蛋白2(HHLA2)是新近发现的B7家族免疫检查点分子,在多种恶性肿瘤中高表达且与临床预后不良相关[5]。因此,本研究通过免疫组织化学染色方法分别检测免疫检查点分子HHLA2和PD-L1在肝癌中的表达情况,并分析两者表达相关性和与临床病理参数及临床预后的关系,进一步揭示肝癌发生的免疫机制,为探寻有效的免疫治疗靶点提供依据。现作报道。
1 材料与方法
1.1 一般资料 选择我院2012-2016年经手术切除的HCC病人石蜡组织样本,其中90例HCC病人具有完整的病历资料、生存随访资料和相对应的癌旁组织(距切缘>1 cm)。术前均未进行任何抗肿瘤治疗。90例HCC病人中男74例,女16例,年龄31~78岁;肿瘤直径≤5 cm 63例,肿瘤直径>5 cm 27例;有血管侵犯 21例,无血管侵犯69例;按第7版AJCC的TNM分期标准:Ⅰ期58例,Ⅱ期29例,Ⅲ期3例。病理分级参考Edmondson法:Ⅰ级14例,Ⅱ级52例,Ⅲ级23例,Ⅳ级1例;手术样本经10%甲醛溶液固定,常规石蜡包埋。
1.2 组织芯片的制定 每1例组织样本,通过在 HE 切片确定典型癌及癌旁组织,之后在相应的蜡块上作好标记,选择20 mm×20 mm 孔径的穿刺针,将组织按一定规则转移至48 mm× 28 mm×15 mm 的蜡模中。混合 97.5 g莱卡石蜡和2.5 g蜂蜡(2.5%)后反复加温溶解,冷却后制成上述蜡模大小的空白蜡块。在该蜡块中内设计18×10点组织阵列,用组织仪打孔(1.5 mm)制成组织芯片(TMA)模块。固定TMA 蜡块,55 ℃ 温箱放置 1~2 h,待蜡将要完全溶解前取出,室温冷却,使蜡与新插入的小圆柱状组织融为一体,取蜡块放置4 ℃冰箱保存备用。
1.3 免疫组织化学染色方法 TMA蜡块4 ℃预冷 4 h,后放置-20 ℃条件下20 min,快速取出切片机修正切片,连续切片10~20张切片备用,切片厚度为4 μm。切片42 ℃温水展开,贴至含多聚赖氨酸切片黏合剂的载玻片,晾干,62 ℃ 烤片仪烤片3 min,58 ℃继续烤片18 h,-20 ℃保存备用。采用免疫组织化学EliVision法检测HHLA2和PD-L1的表达,具体操作步骤依据试剂盒说明书进行。用已知的HHLA2和PD-L1阳性切片作为阳性对照,用磷酸盐缓冲液代替一抗作为阴性对照。HHLA2(ab214327)多克隆抗体和PD-L1单克隆抗体(ab205921)均购自美国Abcam公司。
1.4 结果判定 HHLA2和PD-L1染色均定位于细胞膜和细胞质,细胞膜和细胞质出现棕黄色颗粒为阳性细胞染色,染色结果采用IHC半定量法进行分析,在高倍镜下(×400)随机取5个视野,计算每个视野下细胞的染色强度(I)和阳性染色细胞百分比(P),取其平均值。免疫染色结果计算公式为H-score=I×P。HHLA2的I评分分别为:未见显色染色(0分);显色染色为浅黄色(1分);显色染色为棕黄色(2分);显色染色为棕褐色(3分)。HHAL2的P评分分别为:0分为0%;1分为>0%~25%,2分为>25%~50%,3分为>50%~75%,4分为>75%~100%。HHLA2的结果判定为H-score 0分为阴性(-),1 分弱阳性(1+),2 分中等阳性(2+),≥3 分的强阳性(3+),H-score≥1分设定为HHLA2阳性[6]。PD-L1的I评分等级同HHLA2的I评分。PD-L1的P评分分别为:0分为0%,1分为>0%~10%,2分为>10%~50%,3分为>50%~100%。PD-L1的结果判定为H-score ≤1分为阴性(-),2~3分弱阳性(1+),4分中等阳性(2+),≥6分强阳性(3+),H-score≥3分设定为PD-L1阳性[7]。
1.5 统计学方法 采用配对χ2检验、成组设计χ2检验、Spearman 等级相关分析、Kaplan-Meier生存曲线法和Log-rank检验分析。
2 结果
2.1 HHLA2和PD-L1在 HCC组织中的表达 免疫组织化学染色结果显示,HHLA2和PD-L1在HCC组织及癌旁组织中主要表达于细胞质与细胞膜中。HHLA2在HCC组织样本中阳性表达率(49/90,54.4%)与癌旁组织(33/90,36.7%)差异无统计学意义(P>0.05)(见图1)。HCC组织中PD-L1的阳性表达率(52/90,57.7%)与癌旁组织(44/90,48.9%)差异无统计学意义(P>0.05)(见图2)。

2.2 HHLA2和PD-L1在 HCC组织中的表达的相关性 Spearman 等级相关分析发现,HCC组织中HHLA2 和 PD-L1 的表达呈正相关关系(rs=0.566,P<0.05)(见表1)。
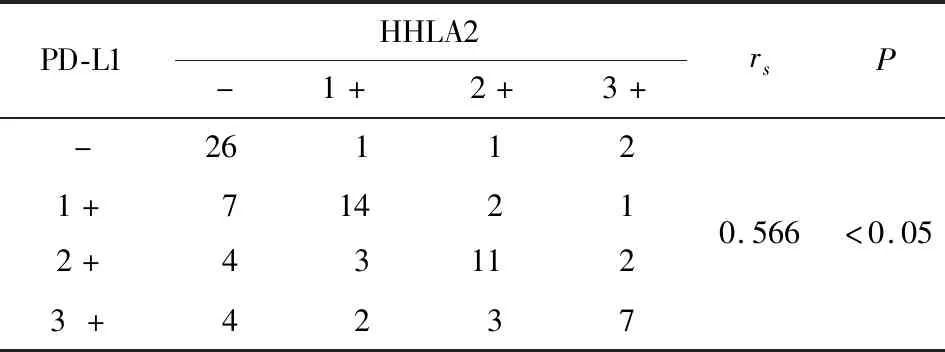
表1 肝癌组织中HHLA2与PD-L1表达的关系
2.3 HHLA2和PD-L1的表达与HCC病人临床病理参数之间的关系 结果显示:HHLA2的表达与病人的年龄、性别、有无血管侵犯、病理分级及血清AFP水平无关,和临床分期及慢性乙型肝炎感染有关(P<0.05)(见表2)。PD-L1的表达与HCC病人的年龄、性别、有无血管侵犯、慢性乙型肝炎感染及血清AFP水平无关,与临床分期及病理分级相关(P<0.05)(见表2)。
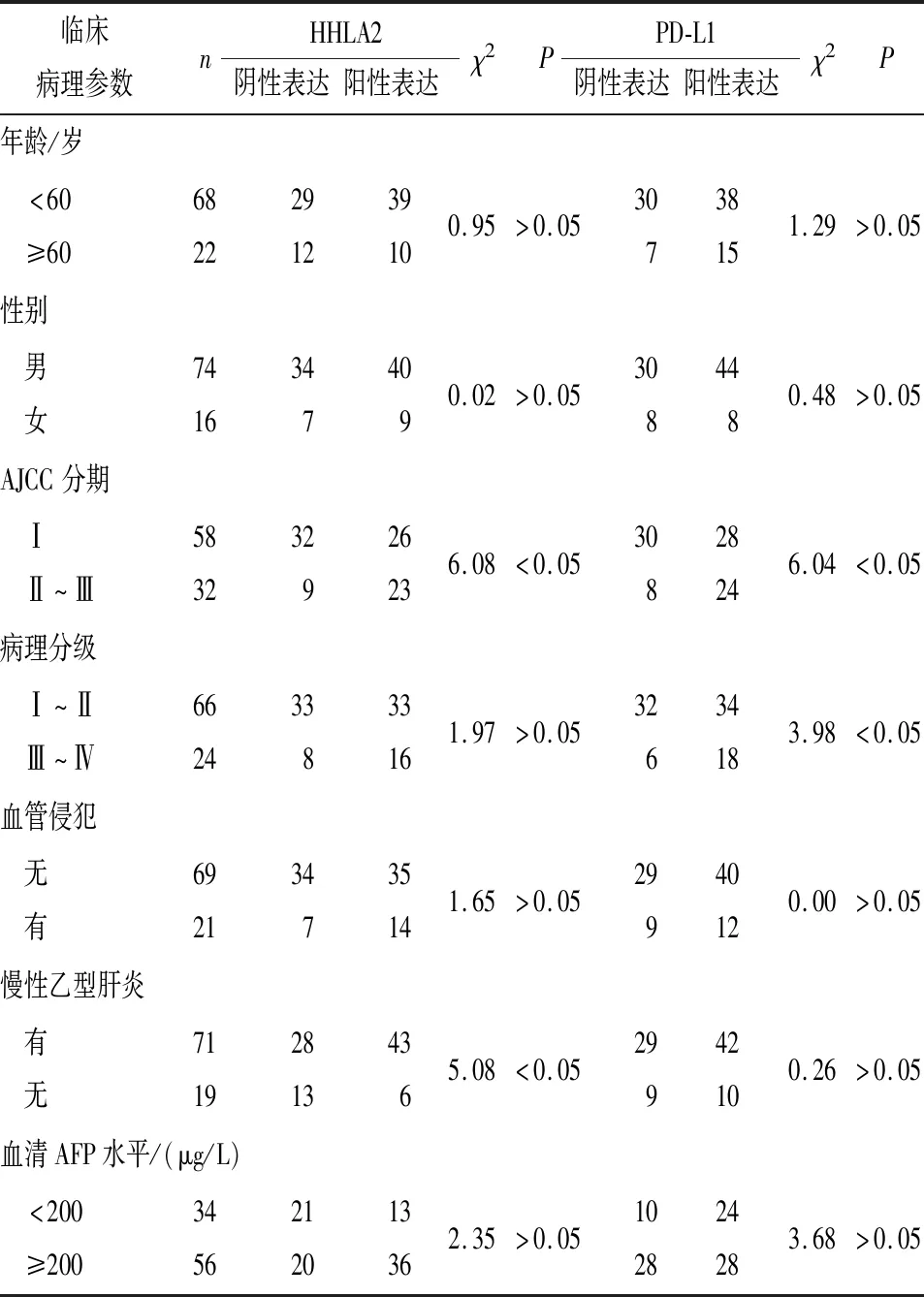
表2 HHLA2 和PD-L1的表达与HCC临床病理参数的关系(n)
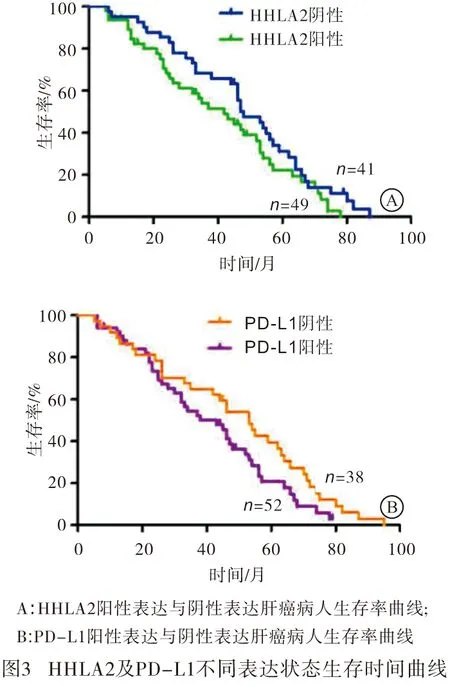
2.4 HHLA2和PD-L1的表达与HCC病人临床预后之间的关系 对90例肝癌病人不同HHLA2及PD-L1表达状态的总生存时间进行Kaplan-Meier生存曲线分析,结果显示:HHLA2阳性表达较阴性表达的肝癌病人中位总生存时间(mOS)差异无统计学意义[mOS:42个月vs 48个月,HR=1.481(0.928~2.362),P>0.05];PD-L1阳性表达的肝癌病人mOS同阴性表达的病人差异亦无统计学意义[mOS:43个月vs 53个月,HR=1.522(0.949~2.443),P>0.05](见图3)。
3 讨论
HHLA2是最近被鉴定出的一种新的免疫检查点分子,属于B7家族新成员,免疫活性与B7家族具有相似性,也被称为B7-H5和B7-H7[8]。人HHLA2基因位于第3染色体q13.13区,编码一种包含了414个氨基酸的Ⅰ型跨膜糖蛋白,同其他B7家族成员在氨基酸序列上有23%~33%的同源性。不同与其他B7家族成员,HHLA2胞外具有3个Ig结构域[9-11]。研究[10]发现,人外周血单核细胞表面表达HHLA2蛋白,IFN-γ和 LPS可诱导B细胞表面HHLA2的表达,T细胞表面不表达HHLA2蛋白。人大多数正常组织中不表达HHLA2,仅在胎盘滋养层细胞和肾脏、肠道组织、胆囊和乳腺上皮细胞少量表达。然而,多种恶性肿瘤细胞组织中存在HHLA2过表达的情况,且与病人的临床预后相关。
研究[12]报道HHLA2高表达于三阴性乳腺癌组织中,且和淋巴结转移与临床分期密切相关。肺癌作为一种免疫原性肿瘤,却只有约20%病人表达PD-L1或对PD-1/PD-L1检查点抑制剂有治疗反应。然而,HHLA2在66%非小细胞肺癌中表达,而在正常肺组织(包括肺泡型和Ⅱ型细胞、血管内皮细胞和平滑肌细胞)中未见表达。EGFR突变人群中HHLA2表达显著增高[13]。因此,HHLA2免疫检查点在不表达PD-L1的肿瘤中可能起到非常重要的免疫调控作用。高表达HHLA2的骨肉瘤病人表现出更差的生存预后[14]。此外,在肾透明细胞癌[15],口腔鳞状细胞癌[16]、肝内胆管癌[17]、膀胱尿路上皮癌[18]、胃癌[19]和结直肠癌[20]中均发现存在HHLA2过表达,且和临床不良预后显著相关。这些研究说明,HHLA2可能作为肿瘤新的免疫检查点分子,参与肿瘤免疫逃逸过程,为肿瘤细胞生存提供机遇。
为了探索HHLA2在肝癌组织中的表达及其与PD-L1表达的相关性,本研究通过免疫组织化学染色方法考察了HHLA2和PD-L1在肝癌中的表达及其相关性,发现HHLA2蛋白在肝癌组织中的表达较癌旁组织中升高,但差异无统计学意义(P>0.05),PD-L1在肝癌组织中的表达较癌旁组织也未观察到显著差异(P>0.05)。本研究发现HHLA2的表达与临床分期和慢性乙型肝炎感染有关。肝癌是炎症相关性癌症,肿瘤微环境(TEM)中,除了存在大量功能各异的基质细胞外,还存在其分泌的各种细胞因子,包括干扰素(IFN)-γ、肿瘤坏死因子(TNF)-α、转化生长因子(TGF)-β等,它们对肿瘤的发生发展起到了重要作用[21]。研究已证实IFN-γ可诱导人单核细胞表面表达HHLA2[10],因此,我们推测慢性乙型肝炎感染病人TEM中IFN-γ可能和肝癌细胞表面HHLA2高表达有关,其确证关系和分子机制需要进一步实验证明。目前,关于HHLA2在肝癌中表达及与临床预后的研究不多。国内学者李国等[22]研究报道,HHLA2在肝癌组织中高表达,且进展期和低分化肝癌组织中阳性表达率升高,提示HHLA2阳性表达与临床分期和和组织分化程度相关。本研究结果同上述研究结果不一致,HHLA2是否参与了肝癌的发生过程以及能否成为肝癌免疫治疗的潜在治疗靶点仍需进一步探索。PD-L1在肝癌中的表达及其临床意义研究较多,然而,PD-L1在肝癌中的阳性表达率差异较大,可能和抗体的选择及判读标准不一致有关。本研究考察了HHLA2及PD-L1在肝癌组织中表达的相关性,发现HHLA2与PD-L1的表达存在正相关关系,提示HHLA2可能协同PD-L1参与了肝癌的免疫逃逸过程。本研究未发现HHLA2和PD-L1的表达状态与肝癌病人中位总生存时间之间的关系,HHLA2及PD-L1的表达是否为肝癌病人的预后相关因子还需要扩大样本量继续研究。
综上所述,免疫检查点分子HHLA2和PD-L1在肝癌组织中阳性表达率较癌旁组织有升高趋势,两者之间表达呈正相关关系,然而其表达状态与肝癌病人生存时间无明显相关。HHLA2是否能够成为晚期肝癌未来潜在的免疫治疗靶点仍需要进一步研究探索。

