脊髓损伤的细胞治疗策略
许盼盼 李才 吴楠 叶雨辰 胡捷 姚文军 金世昌 张长春
脊髓损伤(spinal cord injury,SCI)主要由外部创伤、感染、肿瘤或发育畸形等原因引起,常导致感觉、运动和自主功能障碍,致残率和死亡率很高[1]。在严重的SCI病例中,只有不足1%的病人能够完全恢复神经功能,其中许多病人可能导致部分或完全瘫痪[2]。此外,SCI常导致一些人体系统功能障碍等严重的并发症[3],同时也可诱发慢性疼痛综合征、抑郁等心理障碍,给病人的生理、心理和社会行为等带来严重的不良影响,长期高额的医疗花费也给病人家庭造成困扰[4]。以往SCI在很大程度上仍是姑息性治疗:预防损伤恶化、处理并发症、指导残疾的病人如何自理[3]。近年来神经生物学有了重大突破,最初的姑息治疗已经转变为更有效的干预手段。目前治疗SCI主要有两大策略——神经再生和神经保护[5]。对于神经再生,通过组织工程中的细胞移植能够帮助促进轴突和神经元的再生,使受损的神经重新连接起来,并通过再生来代替丢失的细胞。对于神经保护,通过药物治疗可预防继发性损害的发生,继而限制脊髓进一步损伤。
成熟的神经元在受损后不会再生,不能完全归因于神经元的内在缺陷,外部的抑制环境同样起着决定性作用[6]。因此,寻求一种理想、简单、安全、有效、可行的轴突再生、再髓鞘化和功能恢复的修复策略至关重要。细胞移植已成为目前SCI最有前途的治疗措施。细胞治疗的机制被广义地定义为移植细胞和宿主细胞之间的直接或间接的相互作用,这种彼此作用会对脊髓受损部位的微环境有所反应,还能够影响脊髓受损部位的微环境,并改变移植细胞和宿主细胞在环境中的相互作用,从而影响SCI后的组织或功能结果[2]。到目前为止,不同研究小组制定的大多数实验性修复策略都侧重于改善不适宜的中枢神经系统(central nervous system,CNS)环境,通过多种细胞移植来促进轴突生长[2]。
本文从再生挑战、细胞类型及相关神经营养因子等方面综述SCI的细胞治疗方法,希望这一工作能有助于改善组合疗法的策略和SCI再生的临床应用。
一、文献检索策略
本文通过英文检索词“spinal cord injury”、“regeneration of challenge”、“anatomical structure”、“cell therapeutics”、“neu_rotrophic factors”在PubMed平台进行检索,筛选SCI细胞治疗的相关文献,共检索到文献872篇。文献纳入标准为:①已正式发表的期刊文献;②文献内容与SCI、再生挑战、解剖结构、细胞治疗和营养因子密切相关;③同类研究中质量、证据等级较高的文献;④语言为英文的文献。文献排除标准为:①文献质量、证据等级较低的文献;②非英文的文献;③无法获得全文的文献。根据纳入与排除标准最终纳入英文文献74篇(图1)。
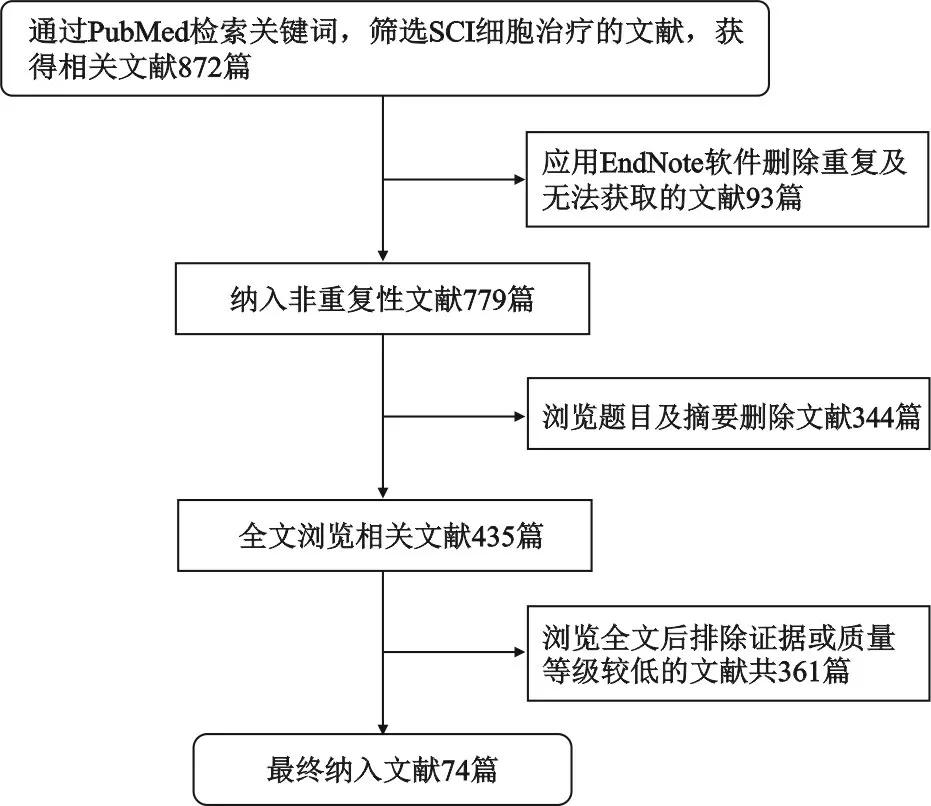
图1 文献筛选流程图
二、脊髓的结构解剖
脊髓起源于大脑底部的延髓,通过枕骨大孔到达第一腰椎下缘。脊髓内部有一片左右对称形似蝴蝶的灰色区域,称为灰质区,由大量的神经元胞体、树突、少数有髓鞘的和无髓鞘的轴突、胶质细胞和毛细血管聚集在一起形成[7]。白质包裹着中央灰质,主要由少突胶质细胞、星形胶质细胞和小胶质细胞组成[7]。
三、SCI再生面临的挑战
SCI发生后会导致囊腔和胶质瘢痕的形成。损伤初期创伤处细胞肿胀,受损的细胞通过释放有毒物质,使其他细胞继发性坏死,在病灶处形成囊腔,最后被胶质瘢痕包围[8]。损伤后产生的抑制分子和炎症同样可抑制脊髓的再生能力[9]。
(一)囊腔形成
在损伤和坏死初期,局部形成充满液体的囊腔,可限制轴突再生和细胞迁移[10]。囊腔可扩展至其它未受损的脊髓节段,导致未受损的脊髓节段也受牵连,造成细胞死亡和功能障碍。此外,形成的囊腔相当于一个屏障,阻止营养因子的进入和再生信号的传导。然而,通过细胞移植可以抑制囊腔形成,有助于脊髓内信号传导的恢复,推进轴突的再生[11]。
(二)胶质瘢痕和硫酸软骨素蛋白聚糖
损伤部位的反应性星形胶质细胞会产生大量的细胞外基质—硫酸软骨素蛋白聚糖(chondroitin sulfate proteoglycan,CSPG),为胶质瘢痕的主要组成物质[12]。在损伤的早期,胶质瘢痕可抑制损伤向周围组织扩散,从而达到保护周围脆弱组织的作用[13]。但是胶质瘢痕的形成无异于在病灶部位形成了一个物理和分子屏障,阻碍轴突再生[14]。目前降解CSPG最常见的实验方法之一是通过硫酸软骨素酶ABC(chondroitinase ABC,ChABC)来实现的。该酶通过裂解CSPG糖胺聚糖链来减弱CSPG的抑制活性,从而有利于功能的恢复[15]。
(三)髓磷脂类抑制剂
经研究发现SCI后功能的恢复会受到某些髓磷脂抑制剂的抑制,目前三种主要的髓磷脂类抑制剂已被确定:轴突生长抑制因子(neurite outgrowth inhibitor,Nogo),髓鞘相关糖蛋白(myelin_associated glycoprotein,MAG)和少突胶质细胞髓鞘糖蛋白(oligodendrocyte myelin glycoprotein,OMgp)[16]。Nogo是一种膜蛋白,主要在少突胶质细胞膜上表达,当其与神经元膜的受体结合时,会抑制轴突生长,造成生长锥塌陷[17]。MAG由少突胶质细胞产生,分布在包裹中枢神经轴突的髓磷脂中,是脊髓再生的抑制剂之一[16]。OMgp存在于CNS的少突胶质样细胞的轴突周围,神经元突起的生长被抑制[18]。来自不同实验室的证据表明,这三种经典的髓磷脂相关抑制因子有一个共同的受体—Nogo受体(Nogo Receptor,NgR),这三种蛋白通过与NgR结合,激活Rho信号,抑制脊髓再生[18]。
(四)炎症
SCI必然会发生炎症反应,小胶质细胞和巨噬细胞被认为与这一反应密切相关[19]。小胶质细胞是CNS中独特的免疫细胞,它们的急性活化具有保护作用,但慢性和不受控制的活化导致周围环境中促炎细胞因子和神经毒性分子的持续释放,导致神经毒性的后果[20]。此外,巨噬细胞的不同表型发挥着不同的作用,M1型巨噬细胞具有促炎作用,而M2型巨噬细胞具有抗炎作用[19]。但是M1巨噬细胞介导的促炎作用在SCI大鼠和小鼠模型中占主导地位[21]。
四、细胞治疗
细胞治疗是当前SCI治疗最具潜力的疗法之一,具有神经保护和再生的潜力。重要的是,细胞具有多种靶点和刺激反应功能,已被用于调节炎症反应、形成支架、轴突再髓鞘化、取代细胞和增强可塑性等[22]。利用这一潜在机制,学者们研究了几种不同组织来源的细胞治疗SCI。
(一)施万细胞
施万细胞(schwann cells,SCs)通过一串串地形式缠绕在周围神经纤维的轴突上。在有髓神经纤维中,SCs形成髓鞘[23]。在SCI治疗所涉及到的细胞类型中,SCs具有最长的移植历史,被SCI治疗领域广泛认为是最有希望的再生脊髓轴突的移植细胞[23],因为移植后SCs能在损伤部位产生多种有益因子,如增加神经营养因子、细胞粘附分子和细胞外基质(extracellular matrix,ECM)等[24]。
SCs在SCI治疗中可减少囊腔和胶质瘢痕形成,保护神经,促进轴突再生和髓鞘形成,能够有效改善后期功能[25]。然而,在单独使用SCs移植时,发现功能恢复并不显著,单纯将SCs移植到SCI位点,由于存活率低,治疗效果并不理想[26]。移植的SCs坏死和凋亡主要发生在早期,这可能和局部微环境的损害、低氧水平、M1型巨噬细胞介导的炎症反应和细胞介导的免疫反应有关[27]。为了克服这些缺陷,人们发明了一些组合策略。例如,Moradi等[28]证明了利用BD Pura_Matrix多肽水凝胶结合SCs可以促进SCs的扩散和减少星形胶质细胞的数量,促进功能的恢复。结合神经营养因子和ChABC,SCs移植对SCI的修复作用更显著[29]。
(二)嗅鞘细胞
嗅鞘细胞(olfactory ensheathing cells,OECs)移植被认为是促进SCI后轴突再生和功能改善的最有希望的措施之一。OECs可通过鼻黏膜和嗅球组织活检取得[30]。此外,OECs在为轴突再生创造积极的微环境、抑制胶质瘢痕形成和促进轴突再髓鞘化、重建神经组织以及消除神经元轴突释放的抑制因子扩散等方面具有巨大潜力[31]。
实验研究表明,SCI模型移植了OECs后,与对照组相比,接受OECs的大鼠术后功能恢复更为显著[32]。Radtke等[30]将OECs移植到大鼠脊髓横断模型中,证明OECs移植提供了营养支持和桥接损伤部位,使轴突再生和髓鞘化,改善功能预后。与SCs相比,OECs能够穿透胶质瘢痕这个屏障,功能预后更好[33]。虽然许多研究报告称OECs有助于改善神经功能,但治疗方法仍不一致,这种差异可能源于移植到受损部位之前不同的OECs群。
(三)激活巨噬细胞
免疫系统在保护身体组织以及修复受损组织中发挥重要作用。此外,研究表明炎症反应可以同时具有促炎和抗炎成分[34]。促炎表型参与对抗感染、清除死亡和垂死的细胞以及修复伤口。抗炎表型与早期炎症反应密切相关[20]。
Kigerl等[21]的研究表明充分活化的巨噬细胞对SCI治疗有积极作用。例如M2型巨噬细胞移植在不同的动物模型中可以支持神经保护和再生[19]。已有研究表明,激活巨噬细胞的移植可减少髓鞘相关糖蛋白,促进轴突再生和髓鞘形成[35]。另一项研究表明,神经干/前体细胞移植可降低经典M1型巨噬细胞的比例,改善受损脊髓功能[36]。为了研究巨噬细胞对球形细胞脑白质营养不良(globoid cell leukodystro_phy,GLD)的影响,Kondo等[35]通过杂交获得巨噬细胞缺陷的小鼠模型,实验结果表明巨噬细胞在GLD中的整体作用是促进髓鞘化、延长小鼠寿命以及减轻神经症状。
(四)成纤维细胞
成纤维细胞是组成结缔组织和分泌ECM的细胞。这些细胞并不难获得,而且在培养过程中很容易生长,这使得它们在细胞治疗中具有很大的吸引力[37]。然而,除了胶质瘢痕外,SCI后形成的瘢痕也可以是纤维化瘢痕。SCI后成纤维细胞ECM分子的表达增加,分泌过度并沉积形成纤维化瘢痕,限制了轴突再生,CSPG就是这类ECM分子中的一种。但与胶质瘢痕相比,纤维化瘢痕对轴突的抑制作用不强[38]。目前在实验室中使用到的成纤维细胞基因已被修饰改良或与其他治疗策略联合使用。
研究发现,改良后的自体成纤维细胞分泌的脑源性神经营养因子(brain_derived neurotrophic factor,BDNF)和神经营养素-3(neurotrophin_3,NT_3)可以促进猫SCI损伤部位少突胶质细胞增殖,轴突髓鞘形成以及行走功能的恢复[39]。此外,负载有成纤维细胞的Wnt海藻酸盐支架的移植被认为能促进SCI后轴突再生和功能恢复[40]。另一方面,通过体外基因治疗,将BDNF、神经营养因子(nerve growth factor,NGF)、NT_3经修饰的成纤维细胞导入早期脊髓受损部位,证实对成年大鼠模型轴突再生、病变腔减小、脊髓功能恢复有显著作用[41]。
(五)神经干细胞
神经干细胞(neural stem cells,NSCs)是一种具有自我更新能力的多能干细胞,可从脑海马室下区或脊髓中央管分离得到[42]。NSCs在脊髓损伤的细胞疗法中具有重要地位,NSCs能够分化为神经元、星形胶质细胞和少突胶质细胞,可替代损伤部位受损细胞[43],同时还可分泌多种神经营养分子,减少细胞死亡,促进脊髓的恢复。此外,NSCs还能减少病变体积,抑制瘢痕组织形成,具有抗炎作用以及可促进电生理和运动功能恢复[43]。
SCI后,损伤部位的微环境可促使NSCs向星形胶质细胞分化,提示植入前NSCs可能需要进行预分化[44]。与NSCs不同的是,神经前体细胞可以直接分化为实验所需要的神经元。实验结果表明,混合前体细胞填满空腔,修复受损部位[45]。此外,将经修饰改造表达绿色荧光蛋白的NSCs(green fluorescent protein_neural stem cells,GFP_NSCs)结合生长因子移植到大鼠脊髓横断模型中,实验结果显示,GFP_NSCs可分化成多种细胞,其中包括神经元,其轴突形成丰富的突触,利于受损脊髓恢复[46]。
(六)胚胎干细胞
胚胎干细胞(embryonic stem cells,ESCs)具有无限增殖和分化成多种细胞的能力,体内外实验都证明了ESCs能够分化成特定的神经谱系,包括神经元、星形胶质细胞和少突胶质细胞[47]。移植后,这些干细胞不仅能够补充丢失的细胞,还可为轴突再生提供营养支持,使存活的轴突再髓鞘化,并传递免疫调节、抗抑制因子,形成有助于功能恢复的中继回路[48]。
Xie等[47]在体外培养4 d的胚体中加入维甲酸,对神经前体细胞的鼠ESCs(mouse ESCs,mESCs)进行预分化。他们的研究结果表明,电纺纤维支架与预分化前神经祖细胞mESCs的结合不仅促进了神经元的分化,而且限制了胶质瘢痕的形成。Iwai等[49]将ESCs源性的神经干/前体细胞(ESC_derived neural stem/progenitor cells,ESC_NS/PCs)移植到损伤14 d后的C5脊髓挫伤模型中,与对照组相比,植入ESC_NS/PCs可保留损伤部位的组织,促进轴突再生和血管生成,这些细胞治疗使运动功能恢复且无致瘤性。
(七)骨髓间充质干细胞
实验中使用的大部分骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)来自于人类或啮齿类动物。由于它们易于提取、培养,可用于自体移植,因此被广泛应用[50]。最重要的是,BMSCs已被证明可以减少瘢痕组织和囊腔形成,保护轴突,增加对髓鞘的保留,最终使SCI动物模型的功能进一步恢复[50]。此外,BMSCs还可以诱导巨噬细胞向M2表型转化,发挥抗炎作用,减轻SCI急性炎症反应,改善功能预后[50]。
分泌神经营养因子的BMSCs结合支架可解决急性和继发性损伤的问题,包括神经元缺失、轴突断裂、胶质瘢痕屏障和炎症反应[51]。NT_3基因修饰的BMSCs可抑制瘢痕形成,促进神经再生和运动功能恢复[52]。Zhao等[53]研究报道了能够表达大脑多巴胺神经营养因子(cerebral dopamine neuro_trophic factor,CDNF)的转基因BMSCs和正常的BMSCs治疗SCI的对比研究,表达CDNF的BMSCs在病变部位具有很强的抗炎作用,通过抑制SCI后的炎症反应,减少促炎细胞因子PGE2和IL_1β的产生,从而促进了运动功能和受损脊髓的恢复。
(八)诱导多能干细胞
诱导多能干细胞(induced pluripotent stem cells,iPSCs)是通过将Oct3/4、Sox2、Klf4和c_Myc等基因转导到小鼠或人的成纤维细胞重新编程获得,由于不涉及伦理问题,可能成为人类SCI治疗的首选细胞来源[54]。此外,iPSCs具有分化为神经前体细胞、少突胶质细胞、星形胶质细胞、神经元和间充质干细胞(mesenchymal stem cells,MSCs)的能力[55]。这些细胞可以促进轴突再生、桥接病腔,并通过替换缺失的细胞或调节损伤部位的微环境而产生功能恢复[56]。
在大鼠脊髓中度挫伤模型中植入iPSCs源性少突胶质细胞祖细胞(iPS_derived oligodendrocyte progenitors,iPS_OPs)可减少空腔和瘢痕形成,减少小胶质细胞的数量[10]。此外,来自iPSCs的NSCs在小鼠脊髓椎板切除术模型中显示出再髓鞘化的能力,并显著改善运动功能[57]。后续研究发现人iPSCs分化的NSCs在损伤部位分泌神经营养因子,血管生成、髓鞘形成和重建神经通路,长期未见肿瘤形成。但是,iP_SCs也有其缺陷,如由人工诱导基因引起的遗传/表观遗传异常和肿瘤形成,这些都需要在临床使用前加以解决[58]。
五、用于细胞治疗的神经营养因子
神经营养因子被认为是许多移植细胞的补充,可进一步优化细胞疗法,在移植的细胞死亡后仍可发挥神经保护的作用[59]。通过移植相应细胞或基因过表达神经营养因子的细胞,这些机制都有助于增强细胞移植的功能。
目前神经生长因子(nerve growth factor,NGF)在SCI治疗中被广泛应用。然而,NGF也有其缺点,如理化性质不稳定等[60]。有研究表明NGF在周围神经系统(peripheral nervous system,PNS)神经元的存活和成熟中发挥重要作用,有报道称NGF可改变神经胶质表型,提高神经元的存活率,促进轴突再次生长[60]。此外,NGF也有局限性,NGF在脊髓中的表达诱导痛觉轴突,引起痛觉过敏,可导致严重的疼痛[60]。有研究[61]报道慢病毒介导的水通道蛋白-4抑制可以增加NGF的表达,最终改善了SCI大鼠的运动功能。
BDNF在SCI后的不同神经元群中具有轴突再生、神经发生保护、再髓鞘化、突触再次形成以及突触传递等功能[62]。研究表明,将BDNF和NT_3基因导入SCI部位可促进局部轴突生长,并可显著减少远端轴突断裂引起的大锥体神经元萎缩[63]。在啮齿类动物模型的进一步研究表明,分泌BDNF的MSCs将进一步促进SCI后的功能恢复[64]。然而,还有研究表明[65]BDNF增加皮质区域脊髓运动神经元的存活,但不促进皮质脊髓束(corticospinal tract,CST)轴突的生长。
NT_3在发育中的脊髓运动神经元中的表达显著增加。然而,由于NT_3的蛋白质含量较低,它的鉴定很具有挑战性[66]。此外,NT_3可以促进神经元的存活[67]。将表达NT_3的细胞移植到受损部位表明CST在短距离内生长[68]。使用NT_3的另一个优点是它绕过了与疼痛相关的靶区,因此不会引起疼痛或痉挛等副作用。
研究证明,在小鼠模型中植入睫状神经营养因子(cili_ary neurotrophic factor,CNTF),可对CNS和PNS起到神经保护和修复的作用[69]。此外,CNTF可以促进神经元的发育和断裂轴突的存活率[70]。多项研究表明,CNTF联合多种细胞治疗比单独使用CNTF更有效,因此,CNTF对受损神经元的治疗可能需要其他类型细胞的参与[71]。如移植少突胶质前体细胞联合CNTF可促进SCI后的髓鞘形成和功能恢复[72]。
成纤维母细胞生长因子(fibroblast growth factor,FGF)在星形胶质细胞和神经元中均有表达,参与刺激轴突生长,促进血管形成,发挥炎症细胞的抗炎作用和神经保护作用[34]。Le等[73]将bFGF植入胶原/明胶海绵支架中,然后将其植入失活的皮肤,实验结果表明加速了血管的生成。
经研究证明胶质细胞源性神经营养因子(glial cell_de_rived neurotrophic factor,GDNF)可促进SCI后CNS和PNS的轴突再生[74]。此外,研究小组通过将人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)移植到丝素/藻酸盐/GDNF(silk fibroin/alginates/GDNF,SF/AGs/GDNF)支架来模拟神经组织,结果显示,hUCMSCs_SF/AGs/GDNF能显著提高神经元的存活率,促进神经元的分化[74]。
六、结论与未来方向
(一)细胞疗法是一种很有前途的治疗神经再生的方法,已成为广泛研究的热点。细胞从分子到组织在不同的水平发挥重要的作用,如替换丢失的神经元和神经胶质细胞、分泌神经营养因子和抗炎细胞因子,刺激组织保留和血管再形成,重建神经通路,限制和填补损伤后的囊腔,促进轴突再生和再髓鞘化等。
(二)根据细胞的类型、时间和培养条件,即使是相似的细胞,最终结果也会有显著差异。另一方面,关于移植干预时间方面,几乎所有的研究都是在急性和亚急性情况下进行的,而对于慢性治疗研究甚少。
(三)每种细胞的移植都有特定的风险,移植后的肿瘤形成是一个主要的风险。可以通过将细胞移植到寿命较长的大型动物上,通过长时间的观察去评估其安全性。移植的另一个风险是增加了感染的概率。颈椎处的SCI发生后,全身免疫功能明显降低,病人可出现严重的免疫抑制。因此,需要全面了解细胞治疗的各种风险,以确保减少肿瘤和感染的可能性。
(四)SCI疗法在未来临床实践中的应用可能包括多种策略的结合。例如,两个或更多的细胞可以同时移植到SCI中去治疗。常见的有分泌营养因子的细胞与可以弥补结构功能损伤的细胞相结合。除了细胞外,药物递送、基因治疗和生物材料也可以帮助促进SCI后的轴突再生。结合不同的细胞治疗策略,未来的实验将在脊髓修复方面取得更大的成功。

