桢楠种子脱水过程中的生理响应
李佳琦,薛晓明,高捍东*
(1. 南京林业大学林学院,国家林业和草原局南方林木种子检验中心,南方现代林业协同创新中心,江苏 南京 210037;2. 南京森林警察学院刑事科学技术学院,野生动植物物证技术国家林业和草原局重点实验室, 江苏 南京 210023)
桢楠(Phoebezhennan)属樟科(Lauraceae)楠属,是中国特有的珍贵树种,在四川、重庆、贵州、湖北西部及湖南西北部均有生长[1],垂直分布于海拔1 500 m以下的阔叶林中。桢楠树干通直,四季常青,可作为很好的绿化树种;同时,由于其木材纹理直、结构细密、不易变形和开裂,可为建筑以及高级家具提供优良木材[2]。由于长期采伐造成桢楠资源的急剧减少,其野生资源的保护及人工扩繁迫在眉睫。
确定目标植物的种子脱水耐性是成功建立种子库和异地保存的关键[3],研究脱水敏感程度较高的桢楠种子就显得尤为重要。但目前对桢楠的研究多集中在生产应用技术,如桢楠的品种分类[4]、木材特性[5]、抗性生理[6-7]以及育苗栽培技术[8-10]。对于其种子萌发及脱水耐性等生物学方面的研究资料较少,主要有李铁华等[11-12]通过人工老化处理研究种子活力变化机制。
本研究以桢楠种子为试验材料,通过硅胶脱水,获得不同脱水梯度状态的种子,继而测定其生活力、电导率、丙二醛(malondialdehyde,MDA)含量、超氧化物歧化酶(superoxide dismutase,SOD)活性和过氧化氢酶(catalase,CAT)活性等指标,对桢楠种子进行生理生化分析。通过研究不同脱水程度桢楠种子内部各种指标的动态变化,分析最适用于桢楠种子贮藏的含水量指标,为桢楠在林业生产应用中的合理贮藏提供实验依据。
1 材料与方法
1.1 试验材料
桢楠种子于2018年11月采自重庆市酉阳土家族苗族自治县(108°15′25″~109°19′02″E,28°19′28″~29°24′18″N)。新鲜桢楠种子采回后于清水中浸泡洗去果皮后阴干,然后置于湿河沙中分层贮藏备用。
1.2 试验设计
试验于2019年3月中旬开始进行,用分析天平称取种子样品的初始质量(M1),随即装入网纱束口袋(大小适中,保证所取种子样品可以在其中平铺) ,束口后平铺放入装有活性硅胶的干燥器中,以一层种子一层硅胶的置放顺序在室温下(25 ℃)脱水。定期进行称质量得到脱水后种子样品质量(M2)(允许0.3%的误差)。从初始含水率起含水率每下降3%设置1个脱水梯度,共设置7个脱水梯度(包含初始含水率梯度),每个梯度设置3个重复,即失水率在0、3%、6%、9%、12%、15%、18%时取样1次并进行相关指标的测定。以新鲜种子为基础计算脱水至相应含水率时种子样品的质量(M2):
M2= [M1(1-G)] / (1-D)。
其中:G表示种子样品初始含水率,%;D表示失水率在3%、6%、9%、12%、15%、18%时种子样品的相对含水率,%。
将初始含水率和不同脱水梯度的种子用锡纸密封并贴好标签,暂时保存至-80 ℃冰箱中待全部种子脱水完毕后,立即进行后续试验。
1.3 指标测定与方法
1.3.1 桢楠种子基本生物学特性
1)种子形态。通过四分法选取50粒桢楠种子,用游标卡尺测量其横轴、纵轴长度,计算平均值,重复取4次。
2)种子千粒质量。参照《林木种子检验规程》[13],用四分法选取100粒种子称取质量(g),计算平均值,重复取8次。计算8次重复的平均值、标准差。
3)种子初始含水率。参照《林木种子检验规程》[13],采用低温烘干法,设置4次重复。先将洁净铝盒置于恒温烘箱中于105℃烘2 h,烘后置于活化硅胶中进行冷却,冷却至室温后于分析天平中称得烘干铝盒质量(W1)。
用四分法选取种子15颗,切碎后取种子样品4~5 g置于烘干铝盒中称质量,得到烘干铝盒和种子样品初始质量总和(W2),再将其置于恒温烘箱中,于103 ℃烘(17±1) h(若不能进行连续烘干,应等再次打开烘箱后回温至103℃后开始计时)。烘后置于活化硅胶中进行冷却,冷却至室温后于分析天平中称得铝盒和烘干种子样品质量总和(W3)。以干质量为基础进行种子含水率的计算:
种子含水率= [ (W2-W3) × 100% ] / (W3-W1)。
1.3.2 桢楠种子生活力的测定
参照《林木种子检验规程》[13],采用四唑染色法测定不同脱水梯度桢楠种子的生活力,每梯度设置3个重复,以初始含水率种子为对照(CK)。
用四分法取50粒种子样品进行预处理,先用冷水浸泡48 h,然后在染色前除去种皮、避开胚将子叶表面划破。用质量分数0.5%的四唑溶液(配制时需要避光)于35℃恒温箱中染色20 h,染色结束后用镊子将种子摆放在铺有蒸馏水润湿滤纸的培养皿上,进行生活力有无的判定:胚与子叶全部为红色或胚为红色、胚附近未划伤的子叶呈淡粉色时判定为有生活力。
根据试验数据绘制含水量-生活力曲线,再利用Excel拟合出符合该曲线的回归方程[14],计算出桢楠种子的半致死含水率。
1.3.3 膜系统完整性的判定
采用胡晋[15]的方法测定不同脱水梯度种子的电导率来判定膜系统的完整性,每个梯度设置3个重复,以初始含水率种子为对照(CK)。
用四分法取50粒种子,称质量得到种子样品质量(M)。准备3个洁净烧杯,将种子样品倒入其中1个烧杯中,每个烧杯倒入250 mL蒸馏水,无种子样品的两个空白烧杯作为对照,烧杯用保鲜膜封口,24 h后测定每个烧杯的电导率。根据公式计算种子电导率:
种子电导率[ μS/(cm·g) ] = (σ-σ0) /M。
其中:σ表示含种子样品烧杯的电导率,μS/cm;σ0表示两空白烧杯电导率的平均值,μS/cm。
1.3.4 MDA含量测定
参照宋松泉[16]的方法进行MDA含量的测定,设置3个重复,以初始含水率种子的为对照(CK)。
1.3.5 SOD活性测定
参考邹琦[17]、李铁华等[11]和宋松泉[16]的方法并加以综合改进,进行SOD活性测定,设置3个重复,以初始含水率种子为对照(CK)。
取种子样品2 g,用50 mmol/L、pH 7.8的磷酸缓冲液[含质量分数1%聚乙烯吡咯烷酮(PVP)和2 mmol/L抗坏血酸(下同)]冰浴研磨至匀浆后,定容至10 mL。1 000 g 4℃离心15 min,上清液即为粗酶液。取0.1 mL上清液(对照用0.1 mL、50 mmol/L、pH 7.8的磷酸缓冲液代替粗酶液),避光条件下依次加入1.5 mL的50 mmol/L pH 7.8磷酸缓冲液、0.3 mL的130 mmol/L甲硫氨酸溶液、0.3 mL的750 μmol/L氮蓝四唑溶液、0.3 mL的100 μmol/L EDTA-Na2溶液和0.3 mL的20 μmol/L核黄素溶液,混匀后于4 000 lx的恒温光照箱中反应30 min。反应结束后避光测定(用避光30 min的50 mmol/L pH 7.8磷酸缓冲液进行调零)其在560 nm下的吸光度(OD)值。根据公式计算SOD活性:
SOD活性 = [(A0-A560) ×VT] / (A0× 0.5 ×W×V)。
其中:A0表示对照管的OD值;A560表示样品管的OD值;VT表示粗酶提取液总体积,mL;W表示种子样品质量,g;V表示所用粗酶液体积,mL;蛋白质含量为每克鲜质量含蛋白质量,mg/g。
1.3.6 CAT活性测定
参考邹琦[17]、李铁华等[11]和宋松泉[16]的方法并加以综合改进,进行CAT活性测定,设置3个重复,以初始含水量种子为对照(CK)。
取种子样品0.7 g,用50 mmol/L pH 7.8磷酸缓冲液冰浴研磨至匀浆后,定容至10 mL。1 000 g 4℃离心15 min,上清液即为粗酶液。取0.2 mL上清液(对照用0.2 mL煮死酶液代替粗酶液,调零用0.2 mL 50 mmol/L pH 7.8磷酸缓冲液代替粗酶液),加入1.5 mL 50 mmol/l pH 7.0磷酸缓冲液。加入0.3 mL 10 mmol/L H2O2后立即计时,5 s后测定240nm初始OD值,40 s后再次测定OD值。以1 min内A240减少0.1的酶量为1个酶活单位(U),根据公式计算CAT活性:
CAT活性 = ΔA240×VT/ (0.1×V×t×W);
ΔA240=AS0-(AS1+AS2) / 2;
CAT比活力 = CAT活性 / 蛋白质含量。
其中:AS0表示加入煮死酶液的对照管OD值;AS1、AS2分别表示样品管初始OD值和40 s后的OD值;VT表示粗酶提取液总体积,mL;V表示所用粗酶液体积,mL;W表示种子样品质量,g;t表示测定AS1到AS2的时间间隔,min;蛋白质含量为每克鲜样品含蛋白质量,mg/g。
1.4 数据分析
利用Microsoft Excel 2019进行数据的分析、制表;利用SPSS 22.0对几次平行试验结果进行最小显著性差异方差分析等。
2 结果与分析
2.1 桢楠种子基本生物学特性
桢楠种子为长椭圆形,无胚乳,种皮脆且难以与子叶分离,胚与子叶质量比小。经测定,桢楠种子直径为(6.89±0.26) mm,长(13.08±0.14) mm,千粒质量(342.24±0.77) g,初始含水量为37.74%。
2.2 桢楠种子含水量与生活力关系
通过四唑染色法检测桢楠种子生活力染色结果见图1。

A. 有生活力种子seeds with viability; B. 无生活力种子seeds wthout viability. CU. 子叶未染色cotyledons unstained; CB. 子叶变黑cotyledons blackened; EU. 胚未染色embryos unstained。图1 桢楠种子生活力四唑染色法检测结果Fig.1 Seed viability assay with TTC staining
利用Excel拟合出该曲线的回归方程(图 2),绘制桢楠种子生活力与含水率的关系曲线,其方程为Y=0.087 7X2-0.417 5X-17.372,由此算出桢楠种子生活力下降一半(半致死含水量,44.71%)时所对应的含水率为29.09%。说明桢楠种子脱水耐性极差,在储藏过程中的最低含水率应高于29.09%。
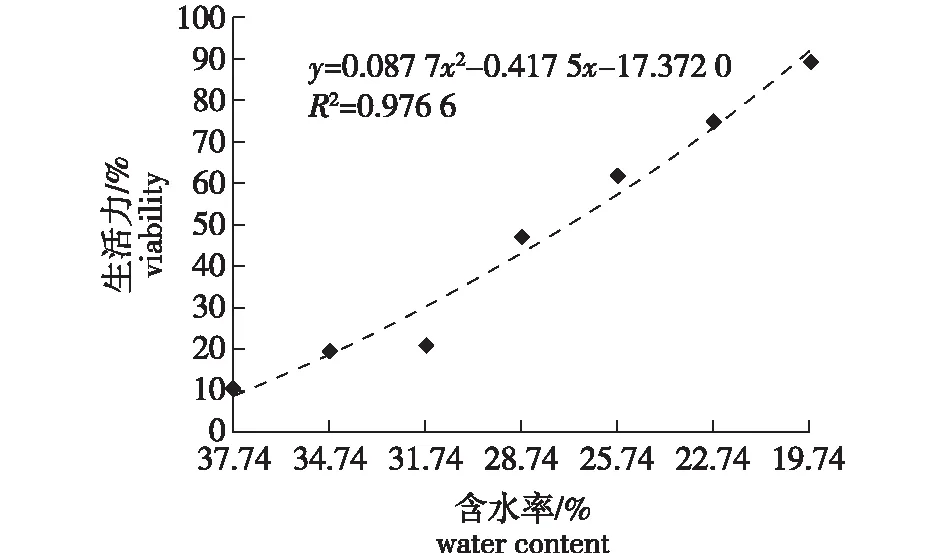
图2 桢楠种子生活力与含水率的关系Fig.2 The relationship between viability and water content of P. zhennan seeds
随着桢楠种子含水率下降,生活力呈下降趋势,而且下降速度较快(图3A)。其中,种子的初始生活力为89.41%。当含水率为37.74%、34.74%、31.74%、28.74%和19.74%时,差异性显著(P<0.05);当含水率为25.74%和22.74%时,差异不显著;且含水率降至19.74%时,生活力仅有10.61%。说明当含水率降至25.74%时,绝大多数种子已经没有发芽潜力或死亡,同时,在解剖种子的过程中发现,大多数种子的子叶和胚已经变硬变黑。由此可见,桢楠种子对脱水极其敏感,表现出较高的顽拗性。

不同字母表示含水率水平间差异显著(P<0.05)。Different letters in the same figure indicated significant differences at the level of water content, P < 0.05.图3 脱水对桢楠种子生理指标的影响Fig.3 Effects of dehydration on physiological indexes of P. zhennan seeds
2.3 桢楠种子含水量与电导率关系
当细胞受到脱水伤害,膜系统会受到破坏,继而导致细胞内电解质外泄,造成电导率的升高,所以电导率的大小可以用来判断种子细胞膜结构受到破坏的程度。桢楠种子电导率随含水率的降低而升高(图3B),表明膜结构受到的伤害不断加剧。其中,初始电导率为0.84 μS/(cm·g)。当含水率为37.74%、22.74%和19.74%时,差异性显著(P< 0.05);当含水率为34.74%、31.74%、28.74%和25.74%时,差异不显著,即脱水至34.74%时,电导率升高较快,而继续脱水至25.74%时,电导率升高速度变缓;在脱水后期(含水率小于25.74%时),电导率升高速度又变快。在脱水初期,桢楠种子电解质浓度的升高激发了其细胞内部的保护机制,在一定程度上缓解了膜系统的伤害进程;而在脱水后期,电导率升高幅度较大,说明保护机制不再起作用,原因可能是过高的电解质浓度抑制了保护机制(或保护酶系统活性)或者保护酶系统在较低含水量时失活。
2.4 桢楠种子含水率与MDA含量关系
丙二醛(MDA)为膜脂过氧化作用的过氧化产物,可以加剧膜脂过氧化作用而造成膜系统的进一步破坏,因此,MDA含量可以用来判断膜脂过氧化以及膜系统被破坏的程度。
桢楠种子MDA含量随含水率的降低而升高(图3C),表明膜脂过氧化作用和膜系统受到破坏的程度不断加剧。其中,初始MDA含量为5.12 μmol/g;当含水率为37.74%、25.74%和22.74%时,差异性显著(P< 0.05);当含水率为34.74%、31.74%和28.74%时,差异不显著,即从初始含水量脱水至34.74%时,MDA含量升高速度较快;而继续脱水至28.74%,MDA含量升高速度变缓;再脱水至19.74%,MDA含量升高再次变快,这与桢楠种子电导率随含水率的变化趋势接近,但MDA含量第2次上升速度的提高比电导率来得要早。在脱水初期,桢楠种子MDA含量的增加激发了其细胞内部的保护酶系统,在一定程度上消除了MDA,缓解了膜脂过氧化进程;而在脱水后期,MDA含量增加速度再次加快,说明低含水率使保护酶系统不再起作用,引起了细胞膜脂过氧化作用的加剧,进而引起MDA积累。而第2次MDA含量增加速率比电导率来得要早,可能是由于与MDA代谢相关酶对脱水更敏感,在含水率较高时已经不起作用。
2.5 桢楠种子含水率与SOD活性关系

2.6 桢楠种子含水率与CAT活性关系
过氧化氢酶(CAT)作为保护酶系统的重要抗氧化酶之一[19],具有非常重要的生理功能,其主要作用是促使H2O2分解为分子氧和水,减少H2O2对膜系统的伤害。随着含水率不断降低,CAT活性呈先增加后减小的趋势(图3E),其中,CAT活性初始值较大,与SOD活性相同,为20.88 U/mg。脱水至34.74%时,CAT活性有所上升,而含水率在37.74%、34.74%和31.74%时,差异不显著,说明在脱水前期已经激发了CAT作用,并一直维持较高的活性;当含水率为31.74%、28.74%和25.74%时,差异显著(P< 0.05)。桢楠种子含水率从31.74%到25.74%时,CAT活性急剧下降,说明随着脱水进程,产生的H2O2开始积累,而CAT已经达到饱和状态,H2O2浓度过高也同时抑制了CAT活性;含水率在25.74%、22.74%和19.74%时,差异不显著,即CAT活性已经保持在较低水平,说明CAT在较低含水率时已基本失活。
2.7 各指标相关性分析
在硅胶脱水的过程中,桢楠种子含水率不断下降,其各生理指标也发生变化。由相关性分析(表1)可知,桢楠种子的生活力与电导率、MDA含量和CAT活性随着脱水的进行存在极显著相关性(相关系数分别为-0.905、-0.957和0.945),说明随着脱水的进行,保护酶系统受到抑制,膜脂过氧化作用加强,引起桢楠种子膜透性加剧,有害过氧化物(MDA)积累,进一步引起种子生活力降低乃至完全丧失。

表1 桢楠种子在脱水过程中各生理指标相关性分析
同时,SOD活性和CAT活性均与电导率和MDA含量之间存在显著负相关关系(相关系数分别为-0.833、-0.743、-0.819和-0.871),说明抗氧化系统中的关键酶SOD和CAT确实能在一定程度上消除活性氧,减少有害过氧化产物的积累,从而降低脱水进程中膜系统的伤害。
3 讨 论
种子脱水耐性是种子的基本特征之一,与种子的贮藏密切相关。种子脱水耐性的获得通常在自然干燥成熟脱水之前,有些种类的种子在发育中期前就获得脱水耐性。Roberts[20]在1973年根据种子对低温和脱水的行为以及其贮藏特性,将种子分为3类,即正常性种子、中间性种子和顽拗性种子。大多数植物种子为正常型种子,这类种子在发育成熟时散失掉90%的水分,并且散落后继续脱水到2%~6%仍具有较高活力,同时可在低含水率和低温下长期保存。顽拗性种子一般不经历脱水过程,脱离母体时含水率高达40%~60%,对脱水和低温(一般低于10 ℃)敏感,一般情况下脱水至15%~20%含水率时大多数或者全部死亡[21]。然而很多顽拗性种子或者脱水耐性差的种子都具有较高的经济价值,但其贮藏条件不易掌握,实现长期保存很困难,所以这类种子脱水耐性的研究就具有重要生产意义和科学价值。Ellis等[22]通过对阿拉伯咖啡种子的研究认为在正常性种子和顽拗性种子之间存在第3类贮藏行为的可能,即中间性种子,这类种子有一定的脱水耐性,但含水率降到7%~12%时就会受到伤害。不同脱水耐性的种子如何实现合理的种质资源保存就显得尤为关键。通过对桢楠种子脱水耐性的研究,探讨如何对其进行适当的脱水处理,进而获得其脱水耐性的更多了解,为桢楠种子的长期保存提供必要的理论和技术支持。
在进行发芽预试验过程中发现桢楠种子有轻微的休眠现象。林木种子休眠的定义为具有生活力的种子在适宜的萌发环境条件(光、温、水、气)下,在30 d内不发芽或者没有达到高萌发率(80%)[23]。Tweddle等[24]的研究认为顽拗性种子由于含水量高而大多迅速萌发,不存在休眠现象,而近年来也有研究表明有些顽拗性种子确实具有休眠特性[25-26]。关于桢楠种子的休眠特性还有待进一步研究讨论。
顽拗性种子成熟时的含水率一般在36%~90%[27],并且对脱水极度敏感。同时,由于顽拗性种子对低温敏感的特性[28-29],在后续研究中,也可通过研究低温逆境(或其他逆境指标)对桢楠种子生活力和过氧化代谢物含量及抗氧化酶系统的影响,为桢楠种子的储存提供更加合理而有力的依据。
4 结 论
桢楠种子表现出较高的顽拗性,在储藏过程中应尤其注重其对水分的要求,轻微脱水可激发其保护酶(抗氧化)系统的活性,提高其脱水耐性,有利于种子储藏。
桢楠种子在硅胶脱水过程中的生理响应如下:生活力逐渐下降;电导率和丙二醛含量不断上升,但均在脱水前期上升较慢、在脱水后期上升较快;超氧化物歧化酶活性和过氧化氢酶活性均先上升,之后急剧下降,34.74%时出现最大值;同时,SOD活性和CAT活性种子生活力与电导率、MDA含量、SOD活性和CAT活性存在显著的相关性,其中,生活力与电导率和MDA含量呈负相关,与SOD活性和CAT活性呈正相关。
因此,本试验结果所示桢楠种子储藏最佳的含水率为34.74%,在生产实际中含水率可控制在34.74%±3%。

