唐古特白刺NtCBL1、NtCBL2基因克隆及表达分析
黎梦娟,朱礼明,霍俊男,张景波,施季森,成铁龙*
(1.南京林业大学生物与环境学院,南方现代林业协同创新中心,江苏 南京 210037;2.中国林业科学研究院沙漠林业实验中心,内蒙古 磴口 015200;3.南京林业大学,林木遗传与生物技术省部共建教育部重点实验室,江苏 南京 210037)
植物在整个生命周期中会遇到各种不利的非生物逆境胁迫,如土壤盐分、干旱、高温、低温、低钾等。植物感受到非生物胁迫后会产生一些生物反应来避免伤害发生,而其中的关键在于对非生物胁迫的检测[1]。钙离子作为重要的第二信使,普遍存在于真核生物的细胞中,在植物生长发育及响应外界环境胁迫中起关键作用[2-4]。外界环境刺激,如土壤盐分、干旱、低温、激素、低钾等都能引起细胞中游离的Ca2+浓度在时空上出现特异性的变化[5]。这种Ca2+信号变化会被钙结合蛋白感知并传递给下游的靶蛋白,靶蛋白通过调控下游目的基因从而激活相应的应答途径[6]。到目前为止,在高等植物中主要有钙调蛋白(calmodulins, CaM)、类钙调蛋白(calmodulin-like proteins, CML)、钙依赖蛋白激酶(calcium-dependent protein kinases, CDPK)、类钙调磷酸酶B蛋白(calcineurin B-like proteins, CBL)这4种Ca2+感受器蛋白家族[7]。而盐胁迫作为最常见的环境胁迫因子之一,引起植物的氧化胁迫[8]、离子胁迫[9]、渗透胁迫[10],抑制植物的生长发育,甚至可以导致植物的死亡。土壤盐碱化问题已经成为全球性的生态环境与资源问题,日益受到人们的重视[11]。
1998年CBL基因首次在拟南芥中被克隆出来[12],由于与动物的钙调神经磷酸酶B(CNB)和神经元钙传感器(NCS)同源,由此被命名为钙调神经磷酸酶B亚基蛋白[12-13]。类钙调磷酸酶B亚基蛋白CBL是一个多基因家族钙离子感受器,可以检测到钙离子的时空变化。研究表明,CBL基因家族在不同植物中的数目是不等的,拟南芥、水稻均有10个[14],茶树有7个[15]。CBL通过其特异性靶蛋白丝氨酸/苏氨酸蛋白激酶CIPK互作构成CBL-CIPK信号系统在植物应答外界环境刺激中起重要作用[16]。
唐古特白刺(Nitrariatangutorum)是蒺藜科(Zygophyllaceae) 白刺属(Nitraria)一种盐生植物,为我国所特有,主要分布在河西走廊干旱盐渍化地区,具有耐干旱、耐盐碱、防风固沙等特点[17],在治理土壤荒漠化和盐碱化中发挥着重要作用[18]。唐古特白刺含有大量的营养成分和药用成分,具有较高药用价值和经济价值。但是对唐古特白刺的研究主要集中在生理生化分析[19-20]、化学成分的提取[21]、优良家系的选择[22]上,而从分子水平上阐述其耐盐机制的研究鲜见。本研究以唐古特白刺为实验材料,对CBL1、CBL2基因进行克隆分析并研究其在盐、干旱、冷胁迫条件下的表达情况,为探讨唐古特白刺的耐盐机制提供理论参考。
1 材料与方法
1.1 材料与处理
将唐古特白刺种子用沙土于4 ℃下沙藏2~6个月,取出后用发芽盒萌发,待种子长出两片子叶时将其种到土壤中。种植土壤以V营养土∶V珍珠岩∶V蛭石=5∶1∶1进行配制,每隔4 d浇1次水。
种植白刺6周后,选择长势一致、生长良好的唐古特白刺并随机分成对照组和处理组,对照组正常用水进行浇灌,盐胁迫处理组以500 mmol/L NaCl溶液进行浇灌,干旱胁迫处理组以300 mmol/L甘露醇液浇灌,每盆浇灌750 mL;冷胁迫处理组置于4 ℃的光照培养箱中进行处理,每处理3次重复。分别在胁迫时间为0、1、3、6 h取唐古特白刺根、茎、叶片,用液氮速冻,于-80 ℃超低温冰箱内储存备用。
1.2 唐古特白刺总RNA的提取和反转录
以唐古特白刺新鲜嫩叶为试验材料,用Bioteke RNA多糖多酚型植物试剂盒提取唐古特白刺总RNA,得到的总RNA用质量分数1%的凝胶电泳进行检测。再参照HiScript© Ⅲ 1st Strand cDNA 反转试剂盒(Vazyme)进行RNA反转录为cDNA。cDNA的合成体系为:总RNA 10 μL,10 × RT mix、HiScript III Enzyme mix各2 μL,Random hexamers 1 μL,RNase-free ddH2O 20 μL。反应程序设置为:25 ℃ 5 min,37 ℃ 45 min,85 ℃ 5 s。为了尽量减少RNA酶的污染,进行试验所需的研钵、枪头、离心管等均用质量分数1%的DEPC水浸泡且高压灭菌后使用,总RNA的提取和反转录均在超净台内操作。
1.3 唐古特白刺NtCBL1、NtCBL2基因的克隆
根据南京林业大学林木遗传与生物技术省部共建教育部重点实验室已有的部分唐古特白刺转录组数据,进行同源基因比对后找出目的基因,使用Oligo 7.0设计特异性引物,将引物命名为NtCBL1-F、NtCBL1-R和NtCBL2-F、NtCBL2-R,如表1所示。以反转得到的cDNA为模板,目的CBL1、CBL2片段进行PCR反应扩增。用质量分数1%琼脂糖凝胶电泳检测目的片段,切胶回收后的纯化产物与pMD19-T Vector连接,再转化到DH5α感受态细胞中,筛选得到的阳性克隆菌液送到公司测序。
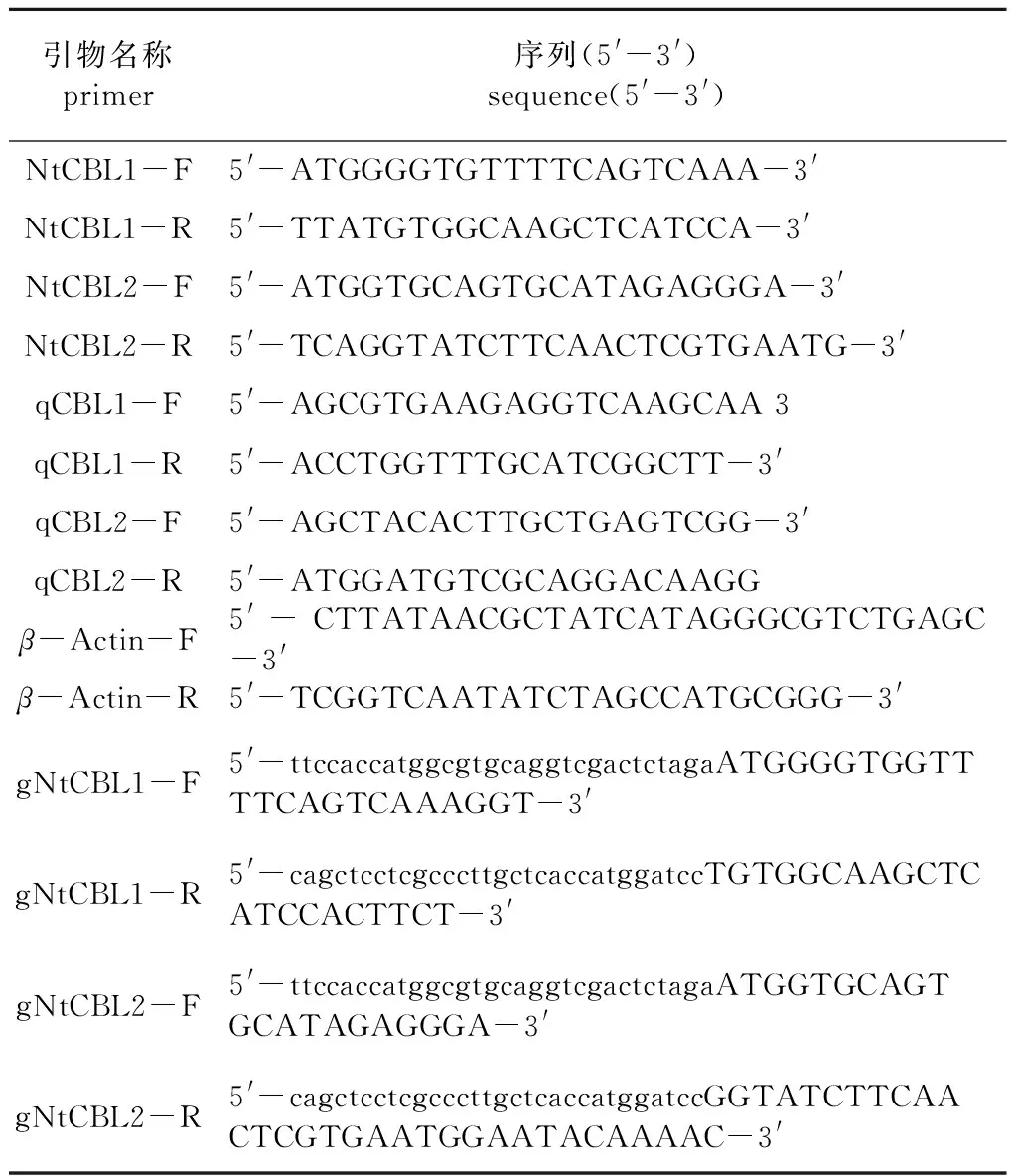
表1 实验所用引物序列
1.4 CBL基因的生物信息学分析
在NCBI中用BLAST(http://www.NCBI.nlm.nih.gov)搜索NtCBL1、NtCBL2基因所编码的氨基酸同源的氨基酸序列;通过DNAMAN软件对克隆得到的NtCBL1、NtCBL2基因所编码的氨基酸序列和这些同源序列进行相似性比对分析;用SMART(http://smart.embl-heidelberg.de/)在线软件预测保守结构域;通过网站 http://web.expasy.org/protparam/分析该蛋白的理化性质;利用Oligo7和NCBI在线软件设计相关引物;利用MEGAX中的邻接法(neighbor-joining,NJ)进行系统进化树的构建。
1.5 唐古特白刺NtCBL1、NtCBL2基因的亚细胞定位
利用XbaI与BamhI酶切位点对pJIT166质粒对进行双酶切,酶切反应体系为PJIT166质粒 3 μL,10×CutSmart Buffer 5 μL,XbaI、BamHⅠ各 1 μL,ddH2O 40 μL。反应条件为37 ℃酶切1 h,双Z酶切产物用切胶回收试剂盒进行回收。设计带XbaⅠ与BamhI酶切位点的引物gNtCBL1-F、gNtCBL1-R和gNtCBL2-F、gNtCBL2-R(表1),其中引物上的小写字母为载体上的序列。利用同源重组的方法构建pJIT166-NtCBL1-GFP、pJIT166-NtCBL2-GFP融合表达载体,以哥伦比亚Col拟南芥叶片制备原生质体,参照PEG介导法[23]进行目的基因的亚细胞定位。
1.6 唐古特白刺NtCBL1、NtCBL2基因的表达分析
以不同盐胁迫、干旱胁迫、冷胁迫条件下不同时间处理的唐古特白刺叶为材料,提取RNA并用HiScript© Ⅲ 1st Strand cDNA for qPCR(+gDNA wiper)反转试剂盒(Vazyme)进行RNA反转录为cDNA。在NBCI在线设计荧光定量PCR引物,NtCBL1引物为qCBL1-F、qCBL1-R,NtCBL2引物为qCBL2-F、qCBL2-R,内参引物为β-Actin-F、β-Actin-R(表1),参照AceQ qPCR SYBR Green mix(Vazyme)进行荧光定量分析。采用2-ΔΔCT[24]计算基因的相对表达量,数据结果利用SPSS进行分析。
2 结果与分析
2.1 唐古特白刺NtCBL1、NtCBL2基因的克隆
以唐古特白刺叶片cDNA为模板,设计特异性引物NtCBL1-F、NtCBL1-R和NtCBL2-F、NtCBL2-R进行PCR扩增,获得与预期条带大小一致的扩增条带(图1)。NtCBL1基因cDNA编码区为642 bp,而NtCBL2基因cDNA编码区为681 bp。

M. DL2000 DNA marker; 1、2. 对照 control。图1 唐古特白刺NtCBL1、NtCBL2基因的PCR 扩增电泳结果Fig.1 PCR amplification of NtCBL1 and NtCBL2 gene
2.2 唐古特白刺NtCBL1、NtCBL2序列的参数分析
利用 http://web.expasy.org/网址中的ProtParam 工具对编码蛋白质的理化性质进行预测,得出NtCBL1蛋白质分子质量为52.77 ku;理论等电点(pI) 5.21,分子式为C1 971H3 302N642O836S106。脂肪系数为 30.37,平均亲水系数为0.657,预测其为疏水蛋白。蛋白质不稳定指数为32.78,被认定为稳定性蛋白。
鉴于Hadoop平台下作业调度算法在Reduce任务调度方面的不足,本文提出了一种新的任务调度算法,其基本思想在于选择系统中的最优节点,将特定的Reduce任务调度到最优节点上,从而减少任务的中间数据传输时间,省去对数据中心带宽资源的占用。其中最优节点是指集群中通过网络链路传输Map阶段中间数据时经过的跳数最少的节点。
NtCBL2蛋白质分子质量26.10 ku;理论理论等电点(pI) 4.82,分子式为C1 179H1 832N298O356S7。脂肪系数为45.58,平均亲水系数为-0.243,预测其为亲水蛋白。蛋白质不稳定指数为92.30,被认定为不稳定性蛋白。
将NtCBL1、NtCBL2的CDS序列提交到NCBI的ORF finder在线翻译工具,可知NtCBL1翻译213个氨基酸,NtCBL2翻译226个氨基酸。利用SMART(http://smart.embl-heidelberg.de/)在线软件分析,结果显示,NtCBL1、NtCBL2蛋白均具有3个EF手型结构域,含有Ca2+binding位点,是钙离子结合蛋白,可进行钙信号传导(图2A、2B)。NtCBL1和NtCBL2蛋白的第1个和第2个EF手型结构域距离9个氨基酸,而第2个和第3个的距离均为16个氨基酸。
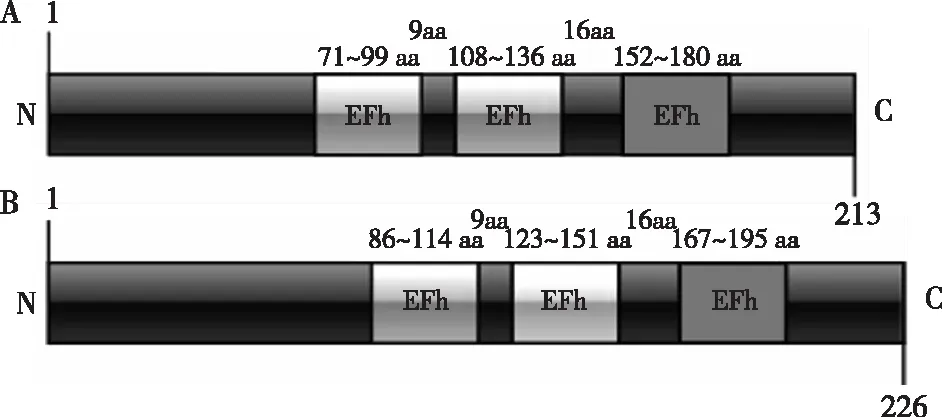
灰色区域代表EF手型结构域,aa为氨基酸单位。The gray region represents EF hand domain, aa is amino acid unit.图2 NtCBL1蛋白(A)和NtCBL2蛋白(B)蛋白 保守结构域预测Fig.2 The prediction for conserved domains of NtCBL1 protein(A) and NtCBL2 protein(B)
2.3 NtCBL1、NtCBL2氨基酸序列的同源性比对和系统进化分析
在NCBI上下载其他CBL1蛋白序列,再用DNAMAN软件对NtCBL1、NtCBL2蛋白与其他植物的CBL1、NtCBL2蛋白的氨基酸序列进行比对,结果(图3A)显示,NtCBL1蛋白与其他蛋白的同源相似性为80.0%~90.0%。其中,NtCBL1蛋白与毛果杨(Populustrichocarpa)PtCBL1蛋白的同源相似性最高,达到88.3%,与拟南芥(Arabidopsisthaliana)的则为83.1%。这些结果表明,NtCBL1所编码的蛋白序列与其他植物的同源性较高且它们均含有豆蔻酰化结构域(MGXXXS/T)。比对NtCBL2蛋白与其他植物蛋白序列,结果显示,NtCBL2蛋白与其他植物蛋白的同源相似性均高于90%且与陆地锦(Gossypiumhirsutum)、杜梨(Pyrusbetulifolia)高达93.81%(图3B)。

A.NtCBL1与其他植物CBL1蛋白的多序列比对分析multiple sequence alignment of NtCBL1 and CBL1 proteins of other plants;AAC26008.1.拟南芥Arabidopsis thaliana;ABO43660.1.毛果杨Populus trichocarpa;AXM42381.1.木薯Manihot esculenta;KAF4362542.1.大麻Cannabis sativa;NP_001239047.1.番茄Solanum lycopersicum;ABC67906.1.胡杨Populus euphratica。B.NtCBL1与其他植物CBL1蛋白的多序列比对分析multiple sequence alignment of NtCBL2 and CBL2 proteins of other plants;ABW06389.1.陆地棉Gossypium hirsutum;AGM15885.1.杜梨Pyrus betulifolia;ABJ09704.1.胡杨Populus euphratica;AFK64728.1.百合Lilium longiflorum;ABO43661.1.毛果杨Populus trichocarpa。图3 NtCBL与其他植物CBL蛋白的多序列比对分析Fig.3 The multiple sequence alignment of NtCBL and CBL proteins from other plants
用MEGA-X软件,采用邻接法(neighbor joining, NJ)对氨基酸序列构建系统发生树,Bootstrap设置为1 000,结果如图4所示。可见进化树主要聚类成两大支,唐古特白刺NtCBL1和拟南芥AtCBL1、AtCBL9的同源性最高,它们的亲缘关系最近,而唐古特白刺NtCBL2和拟南芥AtCBL2、AtCBL3聚类于同一发育分支上,表明它们的同源一致性较高。
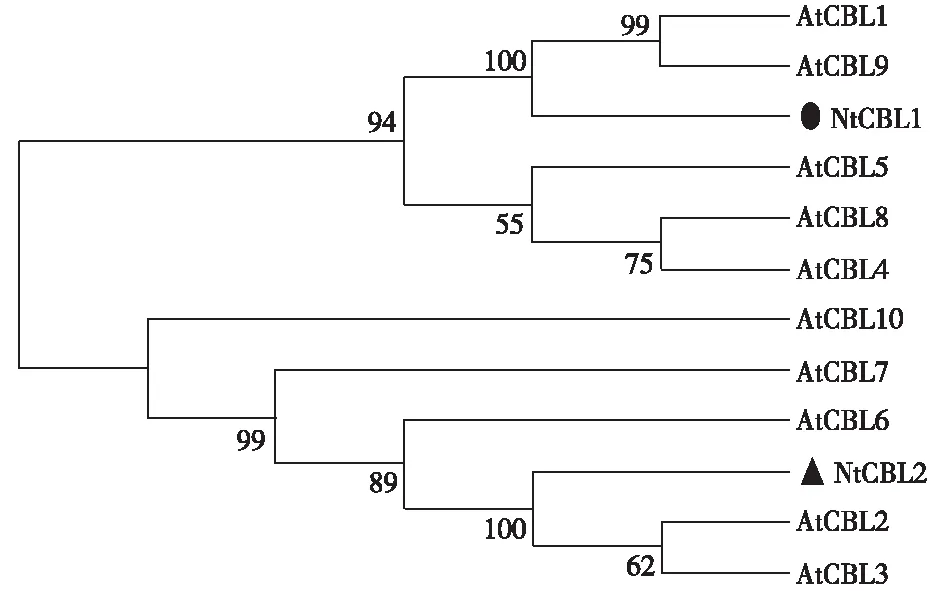
图4 CBL进化树分析Fig.4 The phylogenetic tree analysis of CBL
综上表明,所克隆得到的两个基因属CBL基因家族,编码唐古特白刺类钙调磷酸酶B亚基蛋白。
2.4 唐古特白刺基因的亚细胞定位

图5 转化拟南芥原生质的亚细胞定位结果Fig.5 Subcellular location results of transformation of Arabidopsis protoplasts
由图5可知,对照组PJIT166的GFP分布于整个原生质体中,经过明场和荧光场叠加一起表明,空载PJIT166在细胞核、细胞质、质膜上都有表达。而NtCBL1、NtCBL2主要在质膜上发出荧光,说明这两个基因翻译的蛋白可能在质膜上发挥作用。
2.5 唐古特白刺基因的表达分析
为了研究NtCBL1、NtCBL2在不同胁迫条件下的表达情况,分别用500 mmol/L NaCl进行盐胁迫处理、300 mmol/L的甘露醇进行干旱胁迫处理以及4 ℃的冷胁迫处理。以β-Actin为内参基因,根据NtCBL1、NtCBL2基因序列设计qCBL1-F/R、qCBL2-F/R荧光引物,利用实时荧光定量PCR技术进行检测。结果见图6。

图6 在不同胁迫条件下NtCBL基因表达分析Fig.6 Expression profiles of NtCBL gene under different stress
图6显示,在未处理前NtCBL1基因在茎中的表达量最高,几乎为叶片中的2倍,在根中的表达量最低。同样地,NtCBL2基因在茎中的表达量最高,其次是在根中,而在叶片中的表达量最低。500 mmol/L盐胁迫处理下,NtCBL1基因的表达发生了变化,根、茎、叶内基因表达量在3 h均达到最高值,相比未处理前根中上调了1.56倍,在茎中上调了1.78倍,而在叶片中的上调倍数最为明显,为2.94倍。NtCBL2在盐胁迫下虽然存在波动,但是没有显著性差异,相比处理前,在1 h时上调得最为显著,在叶片内表达量也仅达到其对照的1.29倍。干旱胁迫下,NtCBL1基因在茎、叶内都上调表达,但是上升的倍数不是很明显,最高上调情况发生在处理1 h的叶片内,上调倍数为1.44。但是NtCBL2基因在干旱处理下上升和降低都没有显著性差异。在4 ℃冷处理下,NtCBL2基因在根、叶中显示出先升高后下降的趋势,而在茎中也显示相同的趋势,但是变化不是很明显;而NtCBL2基因在叶片中整体上调表达,在1 h是达到最高,为对照的1.59倍。
3 讨 论
CBL-CIPK响应多种逆境胁迫,在植物生长发育过程中具有重要作用。CBL-CIPK途径最开始是在盐敏感的拟南芥突变体缺失基因sos3(cbl4)的分离鉴定中被发现的[11],大多数CBL蛋白定位于细胞膜,因此,大多CBL-CIPK途径在很大程度上与细胞膜相关[25]。对盐生植物唐古特白刺进行CBL基因克隆,获得NtCBL1基因cDNA编码区为642 bp,共编码213个氨基酸残基。NtCBL2基因cDNA编码区为681 bp,共编码226个氨基酸残基。结构分析表明,NtCBL1、NtCBL2基因有EH手型保守结构域,这是与Ca2+结合的结构基础。NtCBL1蛋白与其他植物的CBL1蛋白的氨基酸序列进行比对,结果NtCBL1蛋白与毛白杨、大麻、拟南芥、木薯的同源相似性较高。其中,NtCBL1蛋白与毛果杨PtCBL1蛋白的同源相似性最高,说明NtCBL1基因可能与PtCBL1基因在功能上有相似之处。且它们均含有豆蔻酰化结构域(MGXXXS/T)[26],在拟南芥植物细胞中该基序介导的膜结合和蛋白质-蛋白质相互作用[27],为CBL蛋白第1亚族成员[13]。NtCBL2蛋白与其他植物的CBL2蛋白的氨基酸序列也具有较高的同源相似性,同源相似性均在90%以上。亚细胞定位预测和实验结果都表明了NtCBL1、NtCBL2蛋白在质膜上表达,它们可做膜结合蛋白在细胞中发挥作用。
到目前为止,CBL1基因是拟南芥CBL基因家族亦是CBL基因家族中研究得最广泛的基因。CBL1基因在盐、干旱、低温、低钾中的作用已在模式植物和其他作物中被探究[1, 28]。比较野生型拟南芥和cbl1突变体中CIPK7的表达模式,发现CIPK7通过与CBL1的相互作用在冷反应中发挥功能[29]。此外,过表达CBL1的植株表现出对盐和干旱的耐性增强,但对低温的耐性降低[30]。而在盐胁迫下杜梨CBL1在根、茎、叶中高表达[31]。本研究结果表明NtCBL1基因受盐胁迫处理的诱导,在根茎叶中上调表达,在胁迫3 h时叶片上调达到最高值,NtCBL1基因的表达相对于对照组提高了2.94倍,推测NtCBL1基因能够提高唐古特白刺高盐条件下的耐受能力。而干旱胁迫下,NtCBL1基因有一定的上调现象,最高上调表达了1.44倍,可能NtCBL1基因在唐古特白刺干旱耐受上起到一定的作用。在4 ℃冷处理下,NtCBL1基因仅在叶片中较为明显的上调表达。相对于CBL1基因来说,对CBL2基因的研究较少。Nurazzaman[32]将烟草NsylCBL2转入拟南芥的研究中,发现NsylCBL2可能不受盐与镁的信号诱导。对胡杨进行盐胁迫处理时,发现叶片中PeCBL1、PeCBL2均上调表达[33]。在对马尾松PmCBL3基因的研究中发现,PmCBL3响应干旱胁迫[34]。这些均表明了同一基因在不同的物种中可能有相似的功能,也可能有差异。而笔者在研究唐古特白刺NtCBL2基因在盐胁迫、干旱胁迫下的表达特征时,发现NtCBL2基因的变化不明显,可能其在盐胁迫、干旱胁迫下的作用不明显。而在4 ℃冷胁迫下,NtCBL2基因在叶片中有一定的上调表达,推测其在冷胁迫响应中发挥一定的作用。
目前,对CBL家族的分析研究主要集中于拟南芥、水稻和玉米等模式植物中[16],对具有强抗盐性的唐古特白刺等木本植物研究较少。唐古特白刺对高盐、干旱、低温等非生物胁迫具有极强的耐受性,是研究环境胁迫的理想材料。本研究从唐古特白刺中克隆出NtCBL1、NtCBL2基因,研究了盐胁迫条件下的基因表达模式,为唐古特白刺的耐盐分子机制研究奠定了理论基础。

