导航下神经内镜与显微手术治疗基底节脑出血的对比研究
李甲,葛韬,沈罡,朱光耀,王波定
(宁波市医疗中心李惠利医院神经外科,浙江宁波315040)
我国脑出血的年发病率高达50.6~80.7/10万,30 d死亡率高达32%~50%,6个月神经功能恢复良好者仅12%[1],其治疗仍有争议。理论上,手术可以迅速解除血肿对脑组织的压迫、降低颅内压,减轻因血肿引起的脑水肿和脑肿胀等继发性脑损伤,提高救治率,降低致残率和死亡率。但有前瞻性临床研究用开放手术和保守方式治疗幕上深部脑出血患者,并将预后进行比较,差异并无统计学意义[2],手术所致的副损伤是主要原因[3]。为了寻求更好的基底节脑出血微创治疗方法,有效改善患者预后,本研究比较了基底节脑出血导航下神经内镜和显微手术的临床疗效。现报道如下:
1 资料与方法
1.1 一般资料
1.1.1 临床资料回顾性分析2018年3月-2019年9月本院符合病例入选标准的患者60例,根据手术方法不同分为导航内镜组(n=32)和显微手术组(n=28)。两组患者性别、年龄和血肿体积等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.1.2 纳入标准①年龄15~80岁;②经头颅CT诊断为基底节区脑出血、伴或不伴破入脑室;③出血量>30 mL,或已出现单侧瞳孔散大但快速静滴甘露醇后瞳孔回缩至正常者;④生命体征稳定,无严重心、肺和肾等重要脏器病变,可耐受全麻手术者。
1.1.3 排除标准①深昏迷、双瞳孔散大、生命体征不稳定者;②单侧瞳孔散大用甘露醇快速静滴,手术前瞳孔无回缩或未至正常者;③CT血管造影(computed tomography angiography,CTA)显示颅内动脉瘤、血管畸形和(或)肿瘤出血者。
1.2 手术方法
1.2.1 导航内镜组采用德国STORZ公司0°和30°硬质神经内镜、专用高清液晶监视器和配套手术器械。患者头架固定稳妥,导入CTA原始数据,神经导航下根据额面部骨性标志激光扫描完毕。取额部冠状缝前缘1.0 cm、中线旁开3.0 cm为中心,发际内5.0 cm头皮做一直切口,再用铣刀形成直径约3.0 cm骨瓣,暴露额中回皮质。轨迹导航引导下,先用脑穿针以血肿中心为靶点进行穿刺,注射器抽吸出暗红色血性液体,明确穿刺角度和深度后,用小儿导尿管作为球囊导管,沿针道置入并逐步扩张穿刺通道周围脑组织,再把透明鞘管沿扩张的穿刺通道缓慢旋入血肿腔内,拔出鞘芯,将神经内镜导入鞘管,发现暗红色血凝块后用吸引器直接吸除。原则上尽可能完全清除血肿,如有较坚韧的血凝块则不可强行去除,尽量避免牵拉,必要时可残留,以防大出血。若有新鲜出血,先用小棉片压迫止血,吸引器吸住出血的豆纹动脉,再用双极或单极电凝点状止血。止血妥善后,于血肿腔覆盖止血纱布及明胶海绵。术毕,留置血肿腔外引流管引流渗血,逐步退出透明鞘管,边退出边止血,造瘘口自行回弹闭合。恢复自主呼吸后返回普通病房,呼吸困难或衰竭者转ICU病房,必要时行气管切开。术后如无再出血,血肿腔引流管留置1.0~2.0 d后拔除。
1.2.2 显微手术组根据头颅CT,于血肿最大处结合外侧裂的位置做一直弧形切口,形成直径3.0~4.0 cm的骨窗,切开硬膜,可见外侧裂及额颞叶部分皮层,于显微镜下分离外侧裂,用脑压板分别牵开额叶和颞叶,再切开岛叶约1.0 cm,以清除血肿;如脑组织张力高、外侧裂分离困难,可在外侧裂后下方颞中回前部行穿刺定位,发现血肿后深入皮层下约3.0 cm,用窄脑压板牵开,于显微镜下清除血肿。
1.3 观察指标
记录两组患者手术时间、手术前后血肿量、失血量、术后血肿清除率、术前及术后24 h格拉斯哥昏迷评分(Glasgow coma score,GCS)、ICU入住时间及入住率、住院时间、气管切开率、肺部感染率、再出血率、血肿周围水肿最大体积、死亡率和术后6个月格拉斯哥预后评分(Glasgow outcome score,GOS)(门诊或电话随访)。血肿清除率=(术前血肿量-术后残留量)/术前血肿量×100%。
1.4 统计学方法
采用SPSS 19.0统计软件进行分析,正态分布的计量资料采用均数±标准差(±s)表示;非正态分布的计量资料用中位数(第25百分位数,第75百分位数)[M(P25,P75)]表示,正态分布计量资料两组间比较采用独立样本t检验,非正态分布计量资料两组间比较采用Wilcoxon秩和检验,计数资料两组间比较采用χ2检验,若理论频数<1,则采用Fisher确切概率法。组内治疗前后对比,正态分布计量资料采用配对t检验分析,非正态分布的计量资料采用配对样本Wilcoxon符号秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者围手术期相关指标比较
导航内镜组手术时间(112.1±14.5)min,术中中位失血量100.0(92.5,140.0)mL,血肿清除率(93.6±3.7)%,血肿周围水肿体积(14.9±5.2)mL,无术后再出血患者,ICU中位入住时间0.0(0.0,0.0)d,ICU入住率15.6%,住院时间(12.4±2.5)d,气管切开率6.3%,肺部感染率9.4%,与显微手术组比较,差异均有统计学意义(P<0.05)。见表2。
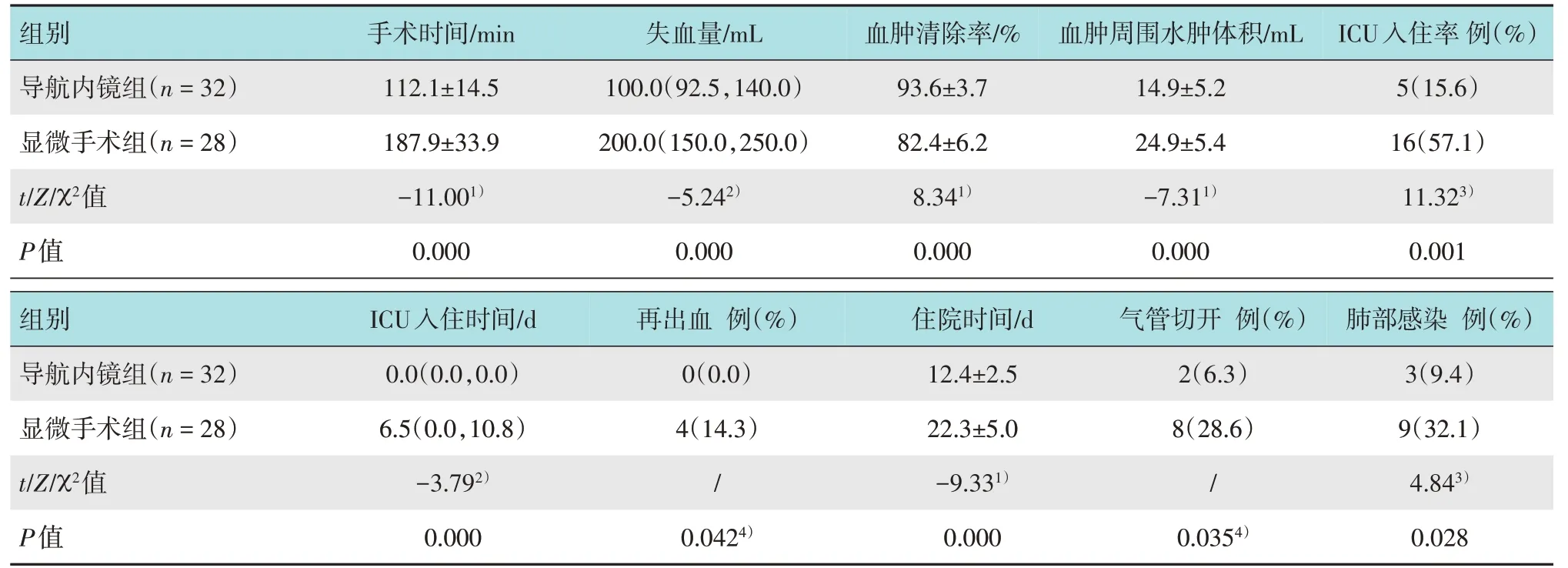
表2 两组患者围手术期相关指标比较Table 2 Comparison of perioperative related indexes between the two groups
2.2 导航内镜组术中情况
患者实施导航下内镜基底节区血肿清除术,手术过程顺利。见图1。
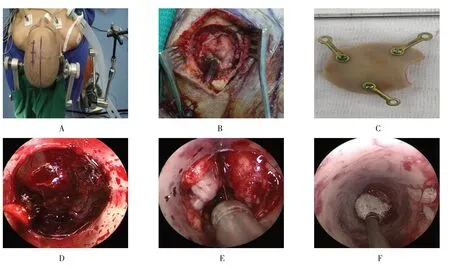
图1 导航下神经内镜基底节区血肿清除术Fig.1 Neuroendoscopic evacuation of basal ganglia hematoma under navigation
2.3 两组患者术后指标比较
导航内镜组术后24 h中位GCS为9.0(8.0,12.0)分,较术前的9.0(8.0,11.8)分明显升高,术前术后比较,差异有统计学意义(Z=-3.50,P=0.000);显微手术组术后24 h中位GCS评分为8.0(7.0,9.8)分,较术前的8.5(7.3,10.0)分明显下降,术前术后比较,差异有统计学意义(Z=-2.69,P=0.007);两组患者术后24 h GCS评分和术后6个月GOS评分比较,差异均有统计学意义(P<0.05)。见表3。

表3 两组患者术后相关指标比较Table 3 Comparison of postoperative indexes between the two groups
2.4 两组患者头颅CT对比
导航内镜组和显微手术组患者均成功手术,头颅CT直观显示血肿清除情况和术后水肿情况。见图2。

图2 两组患者血肿清除术前和术后头颅CT比较Fig.2 Comparison of cranial CT scan before and after hematoma clearance between the two groups
3 讨论
脑出血对脑组织的损伤主要为原发性脑损伤与继发性脑损伤。前者指在出血当时对该处脑组织的机械性破坏,是即时产生的不可逆性损伤;后者指血肿持续存在或增大引起的颅内压升高,诱发脑疝导致患者出现生命危险,患者血肿周围“半暗带”存在循环障碍,脑血流减少,脑灌注压下降,脑水肿加重,血肿代谢毒性产物、炎症因子和氧自由基等对周围脑组织造成的损伤,可通过早期的微创手术来阻断,以降低死亡率和致残率[4-6]。
显微镜下小骨窗血肿清除术中术野过于狭窄易出现视野盲区,从而导致术中止血困难、血肿残留和术后再出血等问题[7]。由于直径约3.0 cm小骨窗的限制,显微手术经常会偏离血肿中心甚至在血肿边缘进行操作,且自血肿短轴入路,存在视野盲区,会导致血肿残留,而充分释放脑脊液、牵拉额颞叶和血肿逐步清除导致的脑组织坍塌漂移,使血肿腔内无法应用导航,故显微手术组血肿清除率为82.4%,再出血率为14.3%。采用经侧裂入路,对术者技术要求较高,否则很难达到真正的微创。脑压板牵开的间隙要达到2.0~3.0 cm才能够到达基底节血肿,对侧裂静脉长时间和过重的牵拉会导致术后水肿加重,且持续时间较长;而牵拉不足和血肿腔暴露不充分,会存在视野盲区而致血肿残留,从而使手术时间延长、术中失血量增加和术后GOS评分下降。
神经导航下定位精准,内镜透明鞘管循血肿穿刺靶点经额部进入,几乎平行于神经纤维走行方向,不同于以往研究中的工作通道,那些工作通道自颞叶皮层或血管丰富的侧裂、岛叶进入,会损伤优势半球语言中枢。额中回为大脑非功能区,皮层造瘘口小,或沿脑沟进入,经球囊扩张后置入透明鞘管至血肿长轴的前1/3,在内镜直视下进行血肿清除及操作[3,7],可在更好的视野和操作角度下安全高效地清除血肿,避免了摆动角度过大的经颞叶工作通道寻找血肿,可提高血肿清除率至93.6%,且手术时间短,术中失血量少,进而降低了术后并发症发生率。内镜手术对患者造成的副损伤较轻微[3],清除血肿后GCS评分上升。由于脑内血肿患者术后需入住ICU行机械通气,导致呼吸机相关性肺炎致死亡率上升至60.0%~80.0%。由此可见,术后肺部感染、气管切开、ICU入住率及入住时间的减少,对脑出血患者的预后有重要意义。
基于脑组织和血肿质地的不同,在清除血肿中心部分之后,受周围局部高颅压和脑组织搏动的影响,血肿由高压力区挤向低压力区,周边和深部的血肿不断因脑组织-血肿压力差自行挤入术野中央,再轻轻吸出。此时不必通过大幅度调整透明鞘管角度来使血肿显露,避免了损伤脑组织,由于各个方向脑组织-血肿压力差的不均衡性,仍需微调透明鞘管角度或更换30°内镜(配有角度的吸引器)来清除残余血肿[7-8]。因此,本研究血肿清除率高达93.6%。
基底节脑出血的责任血管多为长期高血压致玻璃样变和(或)粟粒样微小动脉瘤的豆纹动脉,内镜下对该动脉出血点的处理是手术成功的关键。脑出血后该动脉断端受血肿压迫或生化因素影响,大多于发病6 h后形成血栓或痉挛闭塞而停止出血。因此,本研究导航内镜组在发病7 h后才进行手术。内镜手术局限在血肿腔内且操作轻柔,减少手术操作所致的活动性出血,同时对血肿腔壁的内囊和丘脑等正常脑组织妥善保护,在血肿清除过程中无需过多的电凝。对于轻微渗血,可用生理盐水沿工作通道轻柔地冲洗2~5 min,或使用明胶海绵、速即纱压迫,即可止血,也可在血肿腔留置引流管以引流术后早期渗血。有时清除血肿后,责任血管断端重新开放会导致活动性出血,可在吸引器辅助下双极电凝点状止血。透明鞘管为直径10.0~15.0 mm的锥形圆筒状,对周围脑组织的挤压较普通脑压板小,且受力均匀,在缓慢退出内镜时,能发现和处理穿刺隧道的出血点[9],从而降低术中术后再出血发生率[10]。
综上所述,导航下神经内镜基底节血肿清除术可缩短手术时间、提高血肿清除率、减少术中术后出血、防止正常脑组织损伤、降低并发症发生率、缩短ICU入住时间和住院时间、改善患者预后,是治疗高血压脑出血安全有效的方法。但本研究为一回顾性、小样本和非随机对照的临床研究,仍需今后开展大样本的前瞻性随机对照研究来证实。

