单眼形觉剥夺性弱视大鼠视皮层突触密度及功能的研究
李 谦,毕爱玲,张秀艳,张莉唯,路致远,王兴荣,毕宏生
•KEYWORDS:monocular deprivation; visual cortex; synaptic density; synaptophysin; visual function
0引言
弱视是与视皮层突触发育可塑性相关的一种儿童常见临床眼病,可以造成多种视功能损害,据统计我国弱视的发病率可高达2%~4%[1],主要原因是视觉发育关键期内由于单眼斜视、屈光参差、高度屈光不正以及形觉剥夺等异常视觉经验引起的单眼或双眼最佳矫正视力低于相应年龄正常儿童,且眼部检查无器质性病变[2]。若治疗错过视觉发育敏感期,则疗效较差,严重者将造成不可逆的视功能损害,甚至可能造成患儿视力丧失[3]。因此深入研究弱视的发病机制对于疾病的治疗有着重要意义。已有研究证明,学习记忆过程中大脑皮层存在突触可塑性的改变[4-5],而视皮层发育过程与学习记忆过程具有相似的分子生物学机制,需要突触可塑性。近年来研究发现,在视觉发育过程中存在着大量的神经元突触联系,弱视的发生发展与视皮层突触结构的功能性密切相关,其中结构的可塑性主要表现在视皮层突触密度超微形态变化上,要了解神经元回路如何调控大脑视皮层突触功能可塑性,需要对神经元突触进行超微结构分析。突触素(synaptophysin,SYN)是最丰富的突触囊泡膜蛋白,在突触形成修饰、信息传递、生长发育、学习记忆等方面发挥着重要调控作用,常用于突触前终末端的标记[6]。目前,借助免疫荧光组织化学技术,SYN突触蛋白已在动物及人类中被广泛用于评估突触数量及神经终末密度,可以客观地呈现突触数或突触前终末密度的变化。已有研究发现在视皮层早期发育和成熟中SYN突触蛋白发挥着重要作用,并可能参与视觉发育敏感期视皮层突触可塑性的调控[7]。但突触素影响视皮层突触可塑性的机制尚不明确。本研究在建立单眼剥夺性弱视模型Long Evans大鼠的基础上,重点探讨视觉发育关键期形觉剥夺对大鼠视皮层突触密度和超微形态结构变化规律的影响,以及SYN在视皮层的表达及意义,研究弱视大鼠视皮层突触密度及功能与突触可塑性的关系,为弱视治疗的分子机制探索提供新的思路。
1材料和方法
1.1材料将成年的SPF级Long Evans大鼠进行合笼,约30d娩出幼鼠,常规检查双眼,排除眼部器质性疾病。随机选取刚出生的幼鼠50只。成年动物均购自北京维通利华动物技术有限公司,饲养温度保持25℃左右,控制12h/12h的昼夜光照规律,食物水源充足,自由饮食。实验动物的饲养过程得到山东中医药大学实验室动物管理和使用委员会的批准,且实验过程中对动物的处置符合中华人民共和国科技部颁布的《关于善待实验动物的指导性意见》和山东中医药大学伦理委员会的标准。主要仪器及试剂:手术器械,冰冻切片机(德国SLEE),荧光显微镜(日本Olympus),激光共聚焦显微镜(Zeiss),透射电子显微镜(JEM-1200,日本);英国OPTOPROBE电生理仪;数码相机(OSIS,德国);脑切片模具(深圳市瑞沃德生命科技有限公司)等。一抗SYN抗体[YE269] (ab32127,Abcam,英国),二抗Alexa Fluor488(Invitrogen,美国),红霉素眼膏(北京双吉制药有限公司);氧氟沙星滴眼液[辰欣伟都药业(汶上)有限公司]等。
1.2方法
1.2.1大鼠单眼剥夺性弱视模型的建立参照文献[8-9]建立单眼形觉剥夺(MD)经典弱视模型,在大鼠出生后13d,眼睛未睁开时,将大鼠进行麻醉固定,并对右眼进行表面麻醉,用显微剪剪去眼睑处的毛发,并用生理盐水和乙醇清洗消毒眼睑周围皮肤,剪去距离上下眼睑缘约0.8~1.2mm处的皮肤和组织后,用眼科缝合线对右侧眼睑进行2~4针的间断缝合。术后7d内,每日早中晚各一次使用氧氟沙星滴眼液及红霉素眼膏,并及时对创口愈合情况进行检查。若出现脱线、漏光、眼内感染的动物,将予以剔除,不再纳入后续实验。最终纳入实验大鼠共32只,每组16只。两组大鼠均在标准条件下饲养至21d,然后剪开缝合的眼睑,1mo后行闪光视觉诱发电位(F-VEP)检测。
1.2.2 F-VEP检查检查参照ISCEV标准,将大鼠提前置于暗室内,使其暗适应12h后给予1%戊巴比妥钠溶液腹腔麻醉。电极位置: 正极为大脑枕叶对应皮下,负极为脸颊,接地为尾部皮下, 随后按照电生理仪操作系统进行操作。用闪烁光作为刺激光,刺激频率1Hz,通频带宽0.5~85.0Hz,分析时间250ms,叠加60次,连续测量至少3次,记录P2波振幅和潜伏期。
1.2.3电镜检测大鼠视皮层神经元突触超微结构F-VEP检测结束后取材,将两组Long Evans大鼠快速断头,取脑并放在脑切片模具中,采用前囟标记法(以确保每只动物取材位置相同),根据大鼠脑立体定位图谱[10]切取双侧视皮层脑组织,垂直该冠状面切取V1M区(单眼投射区)内长3mm,横截面约1.5mm2长条(含初级视皮层的全层),放于盛有戊二醛溶液的EP管中。经前固定、洗净、后固定、乙醇梯度脱水、氧化丙烯浸透、60%环氧树脂氧化丙烯浸透、100%环氧树脂包埋、组织切片、超薄切片,铅铀染色制成样本。利用透射电镜对两组大鼠的初级视皮层V1M区第Ⅳ~Ⅵ层大锥体细胞周围神经纤维网络随机拍摄(1万倍下每个样本拍摄10张视野,每张视野都大于2500μm2,且每张视野都不重复)。利用Image J软件进行突触的标记测量。并通过经典突触密度统计方法(NA/d法)计算突触密度[11-12]。即突触密度=NA/d。NA表示单位面积上的突触数目;d为突触横断面的长度。
1.2.4免疫荧光检测大鼠视皮层中SYN的表达F-VEP检测结束后取材,常规使用戊巴比妥钠溶液麻醉动物,将两组大鼠灌流取脑,4%多聚甲醛后固定,30%蔗糖脱水沉底。将沉底后的大鼠脑组织从蔗糖溶液中取出,-20℃的环境中进行冰冻包埋,做连续的冠状位切片,厚度为40μm。在冠状位切片时注意边切片边观察,依据视皮层出现的解剖学位置(可以在胼胝体分开后)开始收片。将切好的脑片放至装有防冻液的EP管中,放入冰箱-20℃保存。利用漂染法对视皮层冰冻切片进行免疫荧光组织化学染色,将脑片从EP管中取出放到TBS溶液中静置10min恢复室温,再用TBS溶液清洗3~5次,每次10min,主要洗去黏着在脑片的防冻液。用0.3% triton-X100,10%山羊血清作为封闭液,室温封闭1h,封闭非特异性抗原。按浓度为1∶1000加入一抗SYN抗体室温孵育1h后,再放入4℃过夜再孵育。用相同浓度的PBS溶液代替一抗作为阴性对照,可以排除非特异染色的影响。第2d取出用TBS溶液清洗3~5次,每次15min。再加入与一抗相对应的二抗Alexa Fluor488室温下避光孵育2h。清洗,晾干,贴片,滴加防荧光淬灭剂,盖上盖玻片,指甲油封片,晾干,在激光共聚焦显微镜及荧光显微镜下进行定位观察和定量统计分析。此外,根据《大鼠脑立体定位图谱》[10]选取左侧视皮层组织区域在荧光显微镜下进行拍照,免疫荧光染色的每张切片在高倍镜下随机选取3个不重复视野,通过尼康NIS-Elements AR图像处理软件系统计算每张切片SYN阳性区域面积的强度值。
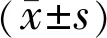
2结果
2.1两组大鼠F-VEP检查结果两组大鼠F-VEP检查结果示,与正常对照组相比,弱视模型组剥夺眼的P2潜伏期较正常眼明显延长,P2波振幅较正常眼明显降低,差异均具有统计学意义(P<0.05,图1,表1),说明弱视造模成功。
图1 两组大鼠F-VEP检查结果 A:正常对照组;B:弱视模型组。

表1 两组大鼠F-VEP检查结果
2.2两组大鼠视皮层V1M区突触密度的变化利用Image J软件观察并统计两组大鼠双侧视皮层的突触密度,结果发现与正常对照组双侧视皮层相比,弱视模型组双侧视皮层的突触密度显著降低,差异均有统计学意义(P<0.05),其中弱视眼对侧视皮层下降更加明显(表2,图2)。

表2 两组大鼠视皮层V1M区突触密度的变化 个/μm3)

图2 两组大鼠双侧视皮层突触电镜图 A:正常对照组右侧视皮层;B:正常对照组左侧视皮层;C:弱视模型组右侧视皮层;D:弱视模型组左侧视皮层。红色箭头所指即为突触。
2.3两组大鼠视皮层中SYN的表达情况本实验根据《大鼠脑立体定位图谱》[10]选取左侧视皮层(剥夺眼对侧)组织区域,利用荧光显微镜和激光共聚焦显微镜对视皮层切片进行拍照处理。共聚焦显微镜下两组大鼠视皮层区域组织结构清晰、无皱褶,染色清晰,未见非特异性染色,均可见SYN阳性表达,与正常对照组相比,弱视模型组视皮层SYN阳性神经元表达更弱。在荧光显微镜下进行拍照,统计每张切片SYN阳性区域面积的强度值。结果发现,与正常对照组左侧视皮层(0.281±0.008)相比,弱视模型组剥夺眼对侧视皮层(0.137±0.011)的SYN阳性神经元表达强度值明显降低,差异具有统计学意义(t=10.494,P<0.01,图3)。
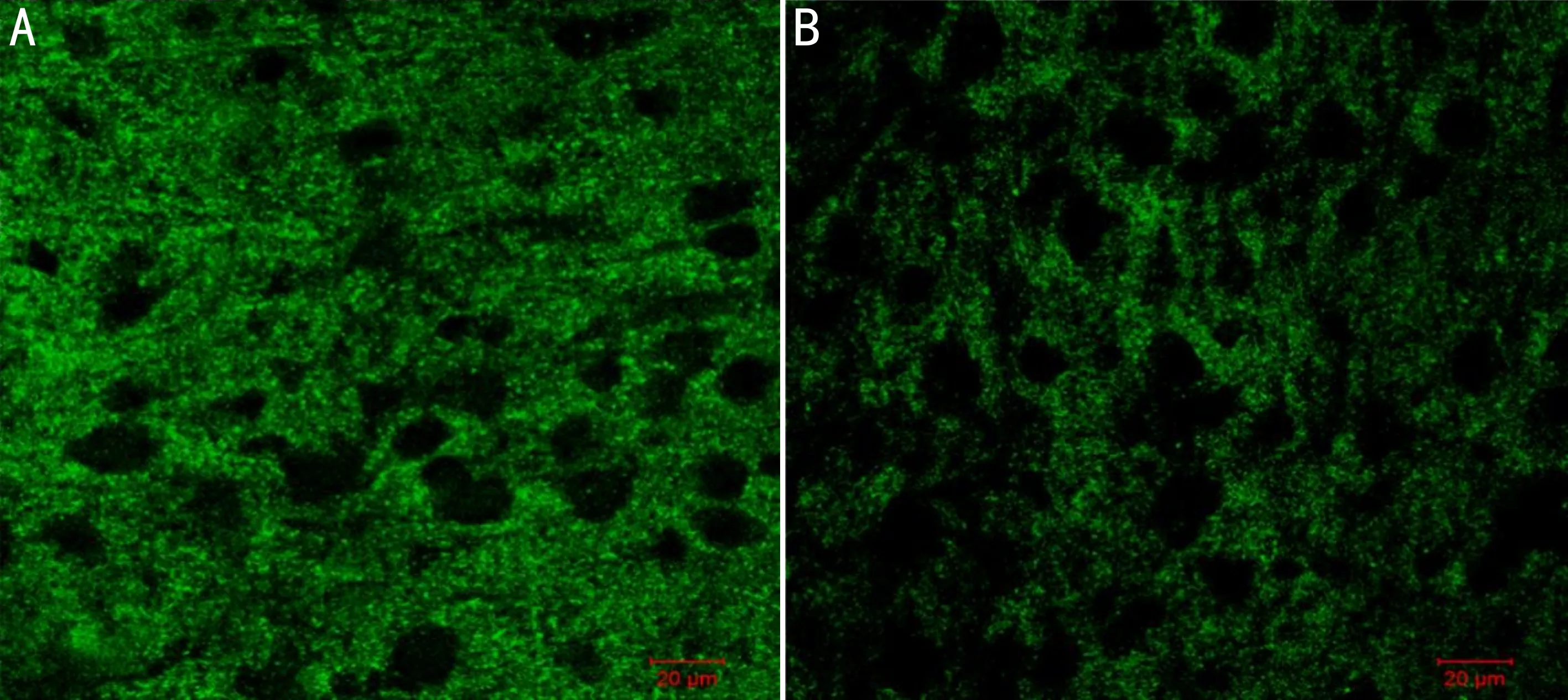
图3 共聚焦显微镜下两组大鼠视皮层区域组织结构 A:正常对照组左侧视皮层;B:弱视模型组剥夺眼对侧视皮层。
3讨论
F-VEP是一种检测视网膜到视皮层传导通路的客观测量方法,它可以检测视觉通路病变,评估视觉传导功能,在弱视模型基础研究中应用广泛[13-14]。李兰等[15]在单眼形觉剥夺小鼠的基础上同时研究小鼠F-VEP和初级视皮层V1区长时程增强(long-term potentiation,LTP)的变化,发现弱视小鼠的视皮层V1区LTP受损,正常组对应的视皮层V1区可成功诱导LTP,说明形觉剥夺眼对应的视皮层V1区LTP受损,突触可塑性降低,从电生理角度促进了弱视发生的视皮层突触可塑性机制研究。哺乳动物皮层的兴奋性突触传递主要发生在树突棘的头部,而在视觉皮层中,约有95%的树突棘形成突触。本实验以单眼形觉剥夺大鼠为弱视模型,采用电生理方法探讨形觉剥夺后F-VEP的变化规律,对反映视皮层突触强度的客观视功能进行评估。结果发现,与正常对照组相比,弱视模型组剥夺眼的P2波潜伏期较正常眼明显延长,P2波振幅较正常眼明显降低。根据之前相关研究推测,单眼剥夺可能导致了树突棘形态和密度的改变[16-17]。在单眼剥夺后,剥夺眼接受的视觉刺激减弱,导致视觉通路突触神经元树突棘形态和密度的变化,进而引起突触传递速度缓慢,最终在F-VEP上表现为P波潜伏期延长,振幅下降,从而可以作为验证弱视造模成功的有效手段。
哺乳动物在出生后的一段时期内,其视觉系统的视皮层神经元联系及突触结构会随着视觉经验的变化而发生改变,表现出与改变相对应的可塑性,称为视皮层突触可塑性,这段时期是视觉发育的关键期[18]。Hubel等[19]研究单眼形觉剥夺对猫视觉皮层功能的影响,发现了视皮层具有经验依赖可塑性。在视皮层发育关键期,视觉经验的改变可以造成视皮层突触可塑性的变化,在微观水平上则表现为视皮层神经元突触结构和功能的改变。突触是神经元之间信息传递的基本单位,是视皮层神经元结构与功能发育的重要基础,也是视觉发育可塑性的关键结构。视觉发育关键期视皮层突触结构存在功能可塑性。弱视的发生、发展与视皮层发育及突触可塑性密切相关。因此对视皮层神经元超微结构变化的研究可以更好地揭示单眼形觉剥夺性弱视的发病机制。本实验采取突触结构经典的特征性参数突触密度来观察和研究视皮层突触的超微结构。结果发现弱视模型组双侧视皮层的突触密度比正常对照组显著降低,且弱视剥夺眼对侧视皮层下降更加明显。表明单眼剥夺可以阻断视觉发育关键期内视皮层神经元之间的突触传递及功能联系,这可能是导致突触结构改变的病理基础。在视觉发育的关键期,视皮层存在着突触修剪的过程[20-21],有序的修剪使双眼的投射纤维在视皮层的投射更加精准。我们推测单眼剥夺可能导致突触修剪紊乱,从而造成突触密度的下降。
SYN突触蛋白位于突触前末梢,是一种重要的突触标志物,在促进突触发育和调节可塑性中具有重要作用[22-23],参与了视觉发育过程中视皮层神经元突触可塑性的形成和成熟。本实验以Long Evans大鼠为研究对象,建立MD弱视经典模型。Long Evans大鼠视觉系统神经元的双眼视觉较好,视网膜色素上皮层更接近人的视网膜生理结构,在视觉神经科学方面的研究具有较好的优点,被广泛应用于眼科学研究。在视觉传导过程中,由于视觉神经元在视交叉处存在交叉投射,大鼠视皮层接受的信号大多来源于对侧眼,这就造成剥夺眼对侧视中枢所产生的剥夺效应远大于剥夺同侧[24]。因此比较两组大鼠左侧视皮层SYN突触蛋白表达变化意义更大。结果发现:与正常对照组左侧视皮层相比,弱视模型组左侧视皮层的SYN阳性神经元表达强度值明显降低。本研究中突触蛋白水平的下降可能与单眼形觉剥夺后突触结构和功能损伤有关,异常的视觉刺激诱发了视皮层可塑性的显著变化。根据之前相关研究[25]及本实验结果推测可能是单眼形觉剥夺导致神经突触前末梢轴突减少而导致SYN表达量减少。另一方面可能是异常的视觉经验影响了视网膜-外侧膝状体-初级视皮层视觉传导通路,导致突触神经元之间的联系减少,从而引起视觉中枢视皮层SYN的表达量减少。
总之,采用F-VEP检测成功验证了弱视模型的建立,对反映视皮层突触强度的客观视功能进行评估,从电生理学角度进一步研究单眼剥夺对视皮层突触功能的影响;利用透射电子显微镜,展示了视觉发育关键期突触结构的变化规律,即MD弱视可造成视皮层突触密度的改变,从视皮层突触密度超微形态结构角度来解释弱视的发病机制。此外,我们发现SYN突触蛋白在视皮层突触可塑性调控中的作用是必要的,推测SYN影响视觉发育关键期视皮层突触结构与功能,这可能是弱视发病的重要分子机制之一。对于单眼形觉剥夺是如何通过调控视皮层神经元宏观突触功能与微观突触结构变化来影响弱视的发生、发展,未来值得探索。

