黄连碱促进肝细胞自噬及胆固醇外流改善脂肪肝的脂质蓄积
沈敏燕,胡 曦,朱 静,张光亚,毛子明,陈凤玲
肝脏是人体重要器官,它参与物质的代谢和能量的吸收、存储,同时可保护人体免受药物和各类毒物损害,脂肪肝是一种由于肝细胞内过量脂质蓄积而引起的肝脏病变。其中非酒精性脂肪肝病(nonalcoholic fatty liver,NAFLD)最为常见,随着NAFLD的患病率不断升高和患病人口年轻化,NAFLD已成为危害我国国民健康的主要疾病之一[1]。而NAFLD是一种可逆性疾病,通过早期发现与干预治疗可恢复正常,如通过运动、控制饮食、降脂药物等都可以缓解NAFLD的发生发展。自噬是一种真核细胞中特有的保护细胞内环境稳态的机制,它可以通过溶酶体对细胞内物质降解再利用。而自噬可依赖溶酶体释放的酸性脂肪酶将胞内脂质进行降解排出胞外,这一过程被称为“脂噬”[2-3],当细胞中的自噬功能出现异常,细胞正常的新陈代谢受到影响,进而影响细胞存活。研究[4-5]结果表明,自噬对于肥胖、NAFLD、冠心病、动脉粥样硬化等代谢综合征有着积极的调控作用。黄连碱(coptisine,COP)是中药黄连提取物的一种,与小檗碱同属于异喹啉类生物碱的中药活性成分,文献[6]报道,小檗碱在肥胖小鼠具有调节血脂以及降胆固醇的作用,小檗碱也可通过细胞中线粒体活动上调AMP和ADP的含量激活AMPK,进而调节脂质的氧化应激反应起到降脂的作用。而COP相较于小檗碱更具有细胞亲和性,COP是否与小檗碱同样具有降脂作用及其机制尚未有明确报道[6-8]。本课题将在细胞实验水平上探索COP是否调控肝细胞的脂肪变性。现作报道。
1 材料与方法
1.1 实验材料 HepG2 细胞(中科院上海细胞库),COP(Sigama),牛血清(Sigma Aldrich),RIPA 裂解液(上海元象生物公司),loading buffer缓冲液(上海碧云天公司),MEM低糖培养基(Sigma Aldrich),β-actin 抗体(Abcam 公司),细胞微管相关蛋白1 轻链3(LC3Ⅰ/Ⅱ)抗体、ATG5 抗体(Cell Signaling 公司),油红O(基科生物),
1.2 细胞培养与分组 通过含10%FBS的MEM低葡萄糖培养基中培养HepG2并在对数期收获细胞进行后续实验分组。将HepG2 细胞根据是否用棕榈酸、油酸和COP处理进行分组,分为 4 组,分别为对照组、FFA组(棕榈酸、油酸诱导HepG2细胞24 h形成脂肪肝细胞模型组),COP+HepG2组(COP处理HepG2细胞24 h)以及COP+FFA组(COP+FFA,用COP将HepG2预处理2 h后再用油酸和棕榈酸诱导)。
1.3 构建脂肪肝细胞模型 用无血清的MEM液体培养基稀释至细胞浓度为5×105个/毫升备用,接种入6孔板中,加入50 μmol/L的棕榈酸与100 μmol/L的油酸共同诱导24 h后,使HepG2细胞脂肪变性形成脂肪肝细胞模型。
1.4 CCK8检测COP对细胞增殖活性的影响 用不同浓度的COP(0、5、15、25、35 μmol/L)对HepG2细胞处理24 h,再进行CCK8细胞活性检测。
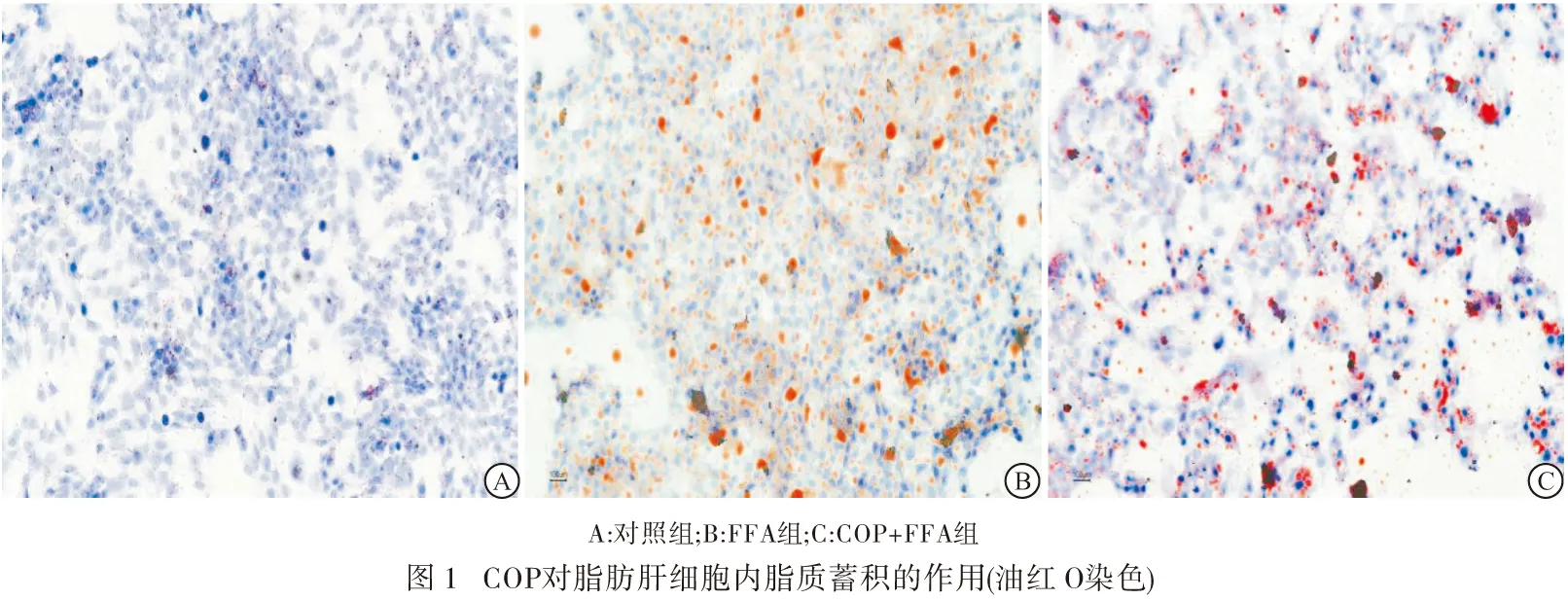
1.5 油红O染色检测各组细胞间脂质蓄积的变化 用12孔板培养细胞,培养前,置入爬片(已消毒)。按照分组,分别对细胞进行相应的处理,按照实验要求对细胞进行培育,PBS清洗细胞2~3次,接着用4%多聚甲醛固定细胞30 min,PBS 清洗残余的多聚甲醛;使用60%的异丙醇分化细胞1 min,PBS继续清洗残余异丙醇,加入油红O工作液(避光摇床染色30min),PBS冲洗爬片3次(每次2 min);苏木素染色40 s,最后ddH2O冲洗,用甘油封片,于荧光显微镜下观察细胞状态并采集图像。
1.6 RT-PCR检测各组细胞中自噬基因和胆固醇流出介导基因mRNA水平的表达变化 细胞均培养在 6 孔细胞培养板中,当细胞密度达 80%~90%时收细胞,用Trizol法抽提总RNA,DEPC水溶解RNA沉淀,4 ℃过夜后在Nanodrop 测定其纯度及浓度,在冰上完成RNA逆转录为cDNA的操作,采用荧光定量PCR,设3个复孔,配置总的孔数所需溶液,每孔包含5 μL Mix、2 μL DEPC水、1 μL cDNA、1 μL 引物正义链、1 μL cDNA 引物反义链(见表1)。

表1 引物序列
1.7 Western blotting检测各组细胞自噬相关基因和胆固醇流出介导基因在蛋白水平的表达变化 细胞培养于6孔板中,待细胞密度达到80%~90%时收细胞,用PBS清洗细胞,按照RIPA∶PMSF∶蛋白酶抑制剂∶磷酸抑制剂=100∶1∶1∶1的比例配置蛋白裂解液,裂解细胞,得到的蛋白上清液加1×loading buffer混合后95 ℃水浴10 min,加样,跑电泳(80 V 30 min,120 V 1 h),转膜(300 mA 2 h或1 h),室温摇床封闭PVDF膜1 h,加入LC3Ⅰ/Ⅱ、ATG5、ABCA1抗体 4 ℃冷库孵育过夜,TBST洗膜3次,室温下摇床加二抗孵育1 h,TBST再洗膜3次,加化学发光液(A液∶B液=1∶1配制)于PVDF膜显影,采用化学发光显影仪显像,之后用Image J进行灰度定量分析。
1.8 统计学方法 采用单因素方差分析和q检验。
2 结果
2.1 不同浓度的COP对HepG2细胞增殖活性的影响 相较于对照组,5~25 μmol/L的COP处理细胞时,HepG2细胞活性无明显变化,而35 μmol/L的COP处理HepG2细胞,细胞活性明显降低(P<0.05)(见表2),说明COP对HepG2有药物剂量效应,0~25 μmol/L的COP对HepG2细胞活性无明显影响,因此选25 μmol/L的COP为药物干预实验浓度。
2.2 油红O染色结果显示 显微镜下可观察到相较于对照组,FFA组细胞内脂滴(油红O染色阳性)明显增多,COP+FFA组中油红O染色阳性细胞数明显减少,说明COP可减少脂肪肝细胞内脂质的蓄积(见图1)。
2.3 RT-PCR结果显示 在mRNA水平,相较于对照组,FFA组自噬相关蛋白与胆固醇外流介导蛋白的表达量显著下调;而相较于FFA组,COP+FFA组中的自噬与胆固醇外流的基因表达又明显升高,差异均有统计学意义(P<0.05~P<0.01)(见表3),说明棕榈酸与油酸可抑制HepG2细胞的自噬和胆固醇外流,而COP能够改善脂肪肝细胞的自噬障碍与胆固醇外流障碍。

表3 各组细胞中自噬相关蛋白 LC3Ⅰ/Ⅱ和 ATG5及胆固醇流出蛋白ABCA1在mRNA水平表达的变化
2.4 Western blotting结果显示 在蛋白表达水平,与对照组比较,COP+HepG2组的自噬相关蛋白LC3Ⅰ/Ⅱ、ATG5和胆固醇外流介导蛋白ABCA1表达量明显增多,而FFA组的自噬相关蛋白LC3Ⅰ/Ⅱ、ATG5和胆固醇外流介导蛋白ABCA1明显降低;而在COP+FFA组细胞中,与FFA组比较,自噬和胆固醇外流相关蛋白的表达水平明显升高,差异均有统计学意义(P<0.05~P<0.01)(见表4)。

表4 各组细胞中自噬相关蛋白 LC3Ⅰ/Ⅱ和 ATG5及胆固醇流出蛋白ABCA1在蛋白水平表达的变化
3 讨论
NAFLD是一种多种病因引起的以肝细胞弥漫性脂肪病变为特征的代谢疾病。NAFLD如未得到控制,可能向脂肪性肝炎、肝纤维化、肝硬化发展,甚至恶化为肝细胞癌[9]。NAFLD的发病机制较为复杂,较为认可的学说是“二次打击”学说,即NAFLD的发生与发展需要经过两个阶段:“第一次打击”是由于机体发生胰岛素抵抗导致肝细胞功能异常,肝脏中脂质过度蓄积;细胞脂噬和胆固醇外流可抑制“第一次打击”中的肝脏脂质沉积;“第二次打击”是在脂质蓄积的基础上,活性氧刺激肝细胞会诱发氧化应激反应导致肝脏炎症和纤维化,促使NAFLD向脂肪性肝炎发展[10]。
在生理状态下,自噬水平较低,在饥饿、低氧等应激条件下,自噬能自发启动,为维持细胞稳态提供所需的底物;同时自噬可降解细胞内脂质、糖类、非折叠蛋白等。目前绝大多数的对于自噬与NAFLD的探究结果表明,自噬可以促进肝细胞中脂质降解,减少肝脏的脂质沉积,研究[11]发现在肥胖小鼠中存在胰岛素抵抗现象,肝脏脂肪变性明显,而小鼠肝脏细胞中自噬相关基因ATG7 的表达降低,自噬过程受到抑制,通过上调肝细胞自噬基因ATG7的表达,细胞自噬功能恢复,观察到小鼠的胰岛素抵抗现象也会得到改善,进而减少小鼠的肝脏脂肪蓄积。由此可说明激活肝细胞中的自噬过程可改善肝脏脂肪病变。而自噬受许多蛋白调控,其中ATG5出现在囊泡延伸并参与了自噬全程;在自噬泡形成过程中存在的一种关键蛋白LC3,以2种形式存在于细胞中,即LC3-Ⅰ和其蛋白水解衍生物LC3Ⅱ,LC3Ⅱ的表达增加意味着细胞自噬活跃[12]。在肝细胞中ABCA1和高尔基复合体的通路是胆固醇流出最主要的途径,由载脂蛋白A-Ⅰ运载胆固醇至高密度脂蛋白胆固醇随血液循环进入机体再循环[13-14]。近年来,对于中药活性物质的深入研究,发现多种中药活性成分可调控细胞自噬和细胞内其他代谢途径间接影响脂质代谢的过程[15-16];COP是药材黄连的主要活性成分之一,其具有多种药理作用,可改善细胞自噬、线粒体活动、氧化应激等,COP的同源生物小檗碱已被证实对脂肪肝有抑制作用[8]。
在本研究中,HepG2细胞在经过50 μmol/L棕榈酸和100 μmol/L油酸处理24 h后诱导形成脂肪肝细胞模型,采用油红O染色检测,FFA组细胞内有大量脂滴形成,说明脂肪肝细胞模型构建成功,经过25 μmol/L的COP预处理的COP+FFA组细胞中脂滴明显减少,说明COP可改善脂肪肝细胞中的脂质蓄积。通过RT-PCR和Western blotting结果显示,在COP+HepG2组细胞中,其自噬基因的表达明显升高;在FFA组细胞中,自噬基因ATG5、LC3Ⅰ/Ⅱ和胆固醇外流蛋白ABCA1的表达水平明显下降,说明肝细胞脂肪蓄积的情况下,可造成细胞自噬障碍和抑制细胞胆固醇外流;在COP+FFA组细胞中,其自噬和胆固醇外流水平明显升高,这说明了COP可改善肝细胞中脂质蓄积造成的自噬障碍,同时还可通过上调ABCA1的表达促进细胞中胆固醇外流。由此我们可推测COP可能通过调控细胞自噬和胆固醇外流来改善肝脏细胞的脂质蓄积。
研究结果表明,HepG2细胞经棕榈酸和油酸处理后会抑制细胞自噬和胆固醇外流,而COP能修复细胞自噬障碍和胆固醇外流抑制,同时减少了肝细胞内脂质蓄积,进而可能减少脂肪肝细胞的形成。本文可以为日后临床上使用COP治疗NAFLD提供相关理论基础。

