山茱萸多糖对难治性癫痫幼鼠行为学和海马组织中多药耐药基因1b及主穹隆蛋白表达的影响
冶秀兰,李 明,王兆建,赵海燕,马建宁,刘 婧,郑 怡,李顺清,张 玉
(青海大学附属医院儿科,青海 西宁810001)
癫痫是一种常见神经系统性疾病,患病率为4%~10%,其中难治性癫痫(refractory epilepsy,RE)占20%[1]。根据2010年国际抗癫痫联盟[2]的定义,RE指经合理选择2种耐受性好的药物治疗后,症状未得到有效控制的癫痫。目前RE治疗以药物为主,但是易产生不良反应,使治疗效果不理想,因此,寻找有效治疗RE的方法尤为重要[3]。山茱萸多糖是中药山茱萸的有效成分,具有抗休克、抗肿瘤、抗衰老和抗氧化等多方面作用。研究[4]显示:山茱萸多糖对脑损伤大鼠的行为能力具有改善作用。研究[5]显示:RE患者往往出现对抗癫痫药物耐受现象,多药耐药基因1b(multidrug resistance gene 1b,MDR1b)表达变化与RE耐药机制密切相关。主穹窿蛋白(major vault protein,MVP)是穹隆主要蛋白成分,其过量表达参与肿瘤耐药,可作为多药耐药的预测因子,有研究[6]显示:MVP与RE存在一定关联。目前山茱萸多糖在RE中作用的报道较少。本研究建立RE幼鼠模型,研究山茱萸多糖对RE幼鼠行为学的改善作用,并深入探讨其对MDR1b和MVP的影响,阐明其对RE作用的分子机制,为RE的临床治疗提供参考。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器SPF级健康雄性SD幼鼠50只,5周龄,体质量100~150 g,购自广东省实验动物检测所,动物生产许可证号:SCXK(粤)2018-0044。实验用幼鼠均自由进食,保持室内温度为(24±1)℃,相对湿度为(55±10)%,光照条件为12 h/12 h明暗交替进行。山茱萸多糖(粉末状,纯度≥98%,陕西扶风斯诺特生物科技有限公司),拉莫三嗪(三金集团湖南三金制药有限责任公司,国药准字H 20050596),海人酸(kainic acid,KA)(纯度≥98%,上海远慕生物科技有限公司)。逆转录试剂盒(美国Invitrogen公司),肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β) 酶 联 免 疫 吸 附 试 验 (enzyme-linked immunosorbent assay,ELISA)试剂盒、TRIzol试剂盒(上海酶联生物科技有限公司),SYBR PremixExTaqⅡ试剂盒(北京智杰方远科技有限公司),BCA蛋白试剂盒(上海睿时生物科技有限公司),兔 抗 大 鼠 核 因 子κB(nuclear factor-κB,NF-κB)、MDR1b、MVP一抗、山羊抗兔二抗(美国Abcam公司)。51800型脑立体定位仪(上海玉研科学仪器有限公司),SAF-680T酶标仪(上海巴玖实业有限公司),Verti7500型实时荧光定量PCR (Real-time fluorescence quantitative PCR,RT-qPCR)仪(美国ABI公司),WD-9413C凝胶成像系统(北京六一光学仪器厂)。
1.2 建模、分组和干预方法取40只幼鼠,参照文献[7],采用侧脑室注射KA建立RE幼鼠模型:术前12 h禁食,腹腔注射3%戊巴比妥纳进行麻醉,将幼鼠头颅固定于脑立体定位仪上,沿头部正中线切开头皮,取前囟为原点,以向右1.4 mm、向后0.8 mm、深度3.7 mm为注射点(右侧侧脑室)。骨钻钻开颅骨,缓慢进针后注射KA溶液3μL,浓度0.5 g·L-1,留针5 min,之后缓慢退针,缝合皮肤。术后腹腔注射青霉素800 000 U·kg-1,每日1次,连续1周,预防感染。注射KA溶液后,于上午8:00~10:00,采用Racine法[8]观察幼鼠惊厥的发作等级(无惊厥为0级,口和面部出现肌肉阵挛为Ⅰ级,Ⅰ级基础上出现节律点头为Ⅱ级,Ⅱ级基础上出现前肢阵挛为Ⅲ级,Ⅲ级基础上出现后肢伸直为Ⅳ级,Ⅳ级基础上出现跌倒为Ⅴ级),持续观察1周,1周内若观察到幼鼠超过5次达到Ⅱ级以上惊厥,表示造模成功。造模成功的37只幼鼠随机分为模型组8只、低剂量山茱萸多糖组9只、高剂量山茱萸多糖组10只和阳性对照组10只。另取10只幼鼠作为假手术组。低剂量山茱萸多糖组和高剂量山茱萸多糖组幼鼠分别给予0.14和0.56 g·kg-1山茱萸多糖(溶于2 mL生理盐水)灌胃,阳性对照组幼鼠给予154 mg·kg-1拉莫三嗪(溶于2 mL生理盐水)灌胃,假手术组和模型组幼鼠给予等量生理盐水灌胃,每日1次,连续14 d。
1.3 视频录像观察各组幼鼠癫痫发作行为采用苦味酸对幼鼠进行标记,给药后每天8:00~20:00进行连续监测至给药结束,记录各组幼鼠癫痫发作总次数和总持续时间。
1.4 ELISA法测定各组幼鼠血清中TNF-α和IL-1β水平行为学能力检测完毕后,采集幼鼠尾部静脉血2 mL,离心取上清,根据ELISA试剂盒说明书进行操作,终止反应后,使用酶标仪读取每个样品吸光度(A)值,绘制标准曲线,根据标准曲线计算相应样品TNF-α和IL-1β水平。
1.5 HE染色观察各组幼鼠海马组织病理形态表现采血完毕,断头处死,取大脑,分离海马组织,一部分置于40%中性甲醛中固定,另一部分置于-80℃冰箱中保存。取40%中性甲醛中固定的海马组织,进行常规脱水,浸蜡包埋,冠状切片,切片厚度约为4μm,脱蜡,进行HE染色,光学显微镜下观察各组幼鼠海马组织病理形态表现。
1.6 RT-qPCR法检测海马组织中NF-κB、MDR1b和MVP mRNA表达水平取-80℃保存的海马组织,TRIzol试剂盒提取组织中总RNA,逆转录反应获取cDNA。之后参照SYBR PremixExTaqⅡ试剂盒说明书设定反应体系,并采用PCR仪进行扩增反应,设定扩增条件:94℃预变性5 min;94℃变性35 s,57℃退火30 s,72℃延伸30 s,设置循环35次;72℃终末延伸10 min。采用GAPDH作为内参基因,采用2-△△CT法计算各组幼鼠海马组织中NF-κB、MDR1b和MVP mRNA表达水平。引物序列见表1。
1.7 Western blotting法检测各组幼鼠海马组织中NF-κB、MDR1b和MVP蛋白相对表达水平取-80℃保存的海马组织,提取总蛋白,BCA法检测蛋白浓度,加热变性,采用SDS-聚丙烯酰胺凝胶电泳分离蛋白,每孔上样20μL,100 V电泳2 h,300 mA电流转膜3 h。转膜完成后,将膜置5%脱脂奶粉室温封闭2 h,PBS洗涤3次,加入1∶1 000稀释的NF-κB、MDR1b和MVP一抗稀释液,4℃摇床过夜,PBS洗涤3次,后加入1∶10 000稀释的辣根过氧化物酶标记的山羊抗兔IgG二抗稀释液,室温孵育2 h,PBS洗涤3次,显色后,置于凝胶成像系统中采集图像,以GAPDH作为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。

表1 NF-κB、MDR1b和MVP引物序列Tab.1 Primer sequences of NF-κB,MDR1b,and MVP
1.8 统计学分析采用SPSS 24.0统计软件进行统计学分析。采用Shapiro-Wilk检验分析数据是否符合正态分布,各组幼鼠癫痫发作总次数、总持续时间,血清中TNF-α和IL-1β水平及海马组织中NF-κB、MDR1b、MVP mRNA和蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组幼鼠癫痫发作行为与假手术组比较,模型组幼鼠癫痫发作总次数和总持续时间增加(P<0.05);与模型组比较,低和高剂量山茱萸多糖组及阳性对照组幼鼠癫痫发作总次数和总持续时间降低(P<0.05);与低剂量山茱萸多糖组比较,高剂量山茱萸多糖组和阳性对照组幼鼠癫痫发作总次数和总持续时间降低(P<0.05);高剂量山茱萸多糖组和阳性对照组幼鼠癫痫发作总次数和总持续时间比较差异无统计学意义(P>0.05)。见表2。
表2 各组幼鼠癫痫发作总次数和总持续时间Tab.2 Total number of attacks and duration of pups of young rats in various groups (±s)
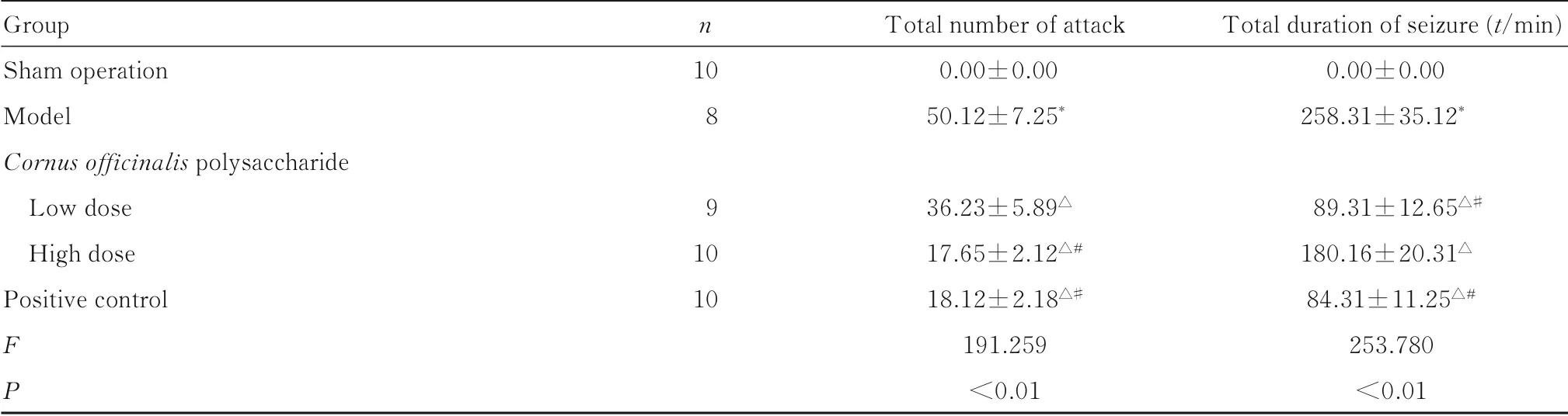
表2 各组幼鼠癫痫发作总次数和总持续时间Tab.2 Total number of attacks and duration of pups of young rats in various groups (±s)
*P<0.05 compared with sham operation group;△P<0.05 compared with model group;#P<0.05 compared with low dose of Cornus officinalis polysaccharide group.
Group Sham operation Model Cornusofficinalis polysaccharide Low dose High dose Positive control FP n 10 8 9 10 10 Total number of attack 0.00±0.00 50.12±7.25*36.23±5.89△17.65±2.12△#18.12±2.18△#191.259<0.01 T otal duration of seizure(t/min)0.00±0.00 258.31±35.12*89.31±12.65△#180.16±20.31△84.31±11.25△#253.780<0.01
2.2 各组幼鼠血清中TNF-α和IL-1β水平与假手术组比较,模型组幼鼠血清中TNF-α和IL-1β水平升高(P<0.05);与模型组比较,低和高剂量山茱萸多糖组及阳性对照组幼鼠血清中TNF-α和IL-1β水平降低(P<0.05);与低剂量山茱萸多糖组比较,高剂量山茱萸多糖组和阳性对照组幼鼠血清中TNF-α和IL-1β水平降低(P<0.05);高剂量山茱萸多糖组和阳性对照组幼鼠血清中TNF-α和IL-1β水平比较差异无统计学意义(P>0.05)。见表3。
2.3 各组幼鼠海马组织CA 1区病理形态表现假手术组幼鼠海马组织CA 1区细胞排列整齐,细胞形态完整,边界清晰,未见细胞核固缩,胞质呈淡红色;模型组幼鼠海马组织CA 1区细胞排列紊乱,大量细胞呈空泡样变,可见大量核破裂,核固缩;低和高剂量山茱萸多糖组及阳性对照组幼鼠海马组织CA 1区细胞排列较为整齐,细胞轮廓较清晰,可见少量空泡变性、核破裂和核固缩。见图1。
2.4 各组幼鼠海马组织中NF-κB、MDR1b和MVP m RNA表达水平与假手术组比较,模型组幼鼠海马组织中NF-κB、MDR1b和MVP mRNA表达水平升高(P<0.05);与模型组比较,低和高剂量山茱萸多糖组及阳性对照组幼鼠海马组织中NF-κB、MDR1b和MVP mRNA表达水平降低(P<0.05);与低剂量山茱萸多糖组比较,高剂量山茱萸多糖组和阳性对照组幼鼠海马组织中NF-κB、MDR1b和MVP mRNA表达水平降低(P<0.05);高剂量山茱萸多糖组和阳性对照组幼鼠海马组织中NF-κB、MDR1b和MVP mRNA表达水平组间比较差异无统计学意义(P>0.05)。见表4。
表3 各组幼鼠血清中TNF-α、IL-1β水平Tab.3 Levels of TNF-αand IL-1βin serum of young rats in various groups [±s,ρβ/(g·L−1)]
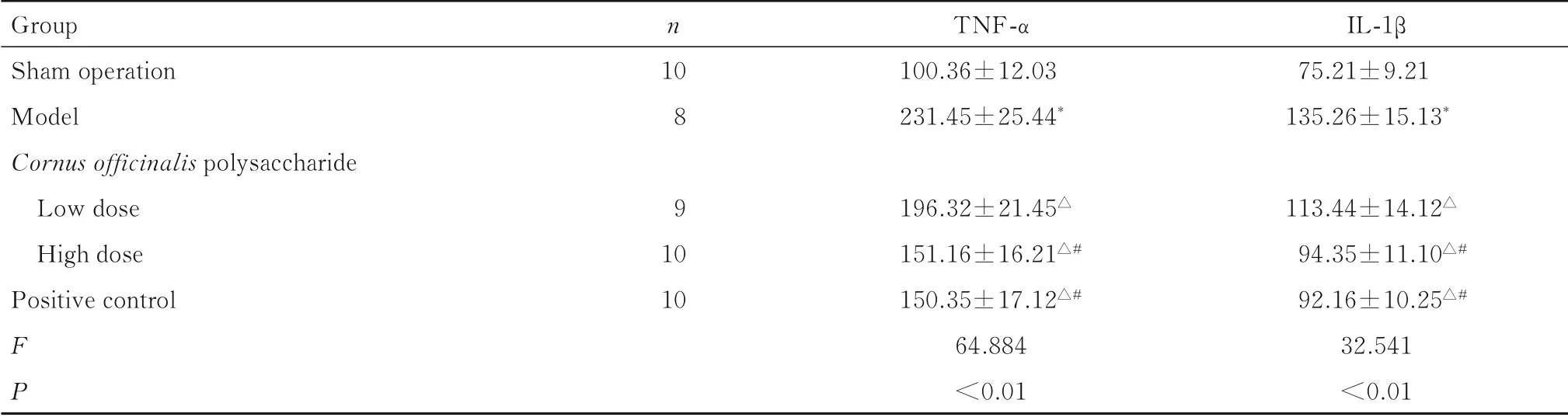
表3 各组幼鼠血清中TNF-α、IL-1β水平Tab.3 Levels of TNF-αand IL-1βin serum of young rats in various groups [±s,ρβ/(g·L−1)]
*P<0.05 compared with sham operation group;△P<0.05 compared with model group;#P<0.05 compared with low dose of Cornus officinalis polysaccharide group.
Group Sham operation Model Cornusofficinalis polysaccharide Low dose High dose Positive control FP n 10 8 9 10 10 TNF-α 100.36±12.03 231.45±25.44*196.32±21.45△151.16±16.21△#150.35±17.12△#64.884<0.01 IL-1β 75.21±9.21 135.26±15.13*113.44±14.12△94.35±11.10△#92.16±10.25△#32.541<0.01

图1 各组幼鼠海马组织CA 1区病理形态表现(HE,×200)Fig.1 Pathomorphology of CA 1 area of hippocampus tissue of young rats in various groups(HE,×200)
2.5 各组幼鼠海马组织中NF-κB、MDR1b和MVP蛋白表达水平与假手术组比较,模型组幼鼠海马组织中NF-κB、MDR1b和MVP蛋白表达水平升高(P<0.05);与模型组比较,低剂量山茱萸多糖组、高剂量山茱萸多糖组和阳性对照组幼鼠海马组织中NF-κB、MDR1b和MVP蛋白表达水平降低(P<0.05);与低剂量山茱萸多糖组比较,高剂量山茱萸多糖组和阳性对照组幼鼠海马组织中NFκB、MDR1b和MVP蛋白表达水平降低(P<0.05);高剂量山茱萸多糖组和阳性对照组幼鼠海马组织中NF-κB、MDR1b和MVP蛋白表达水平组间比较差异无统计学意义(P>0.05)。见图2和表5。
表4 各组幼鼠海马组织中NF-κB、MDR1b和MVP mRNA表达水平Tab.4 Expression levels of NF-κB,MDR1b,and MVP mRNA in hippocampus tissue of young rats in various groups (±s)
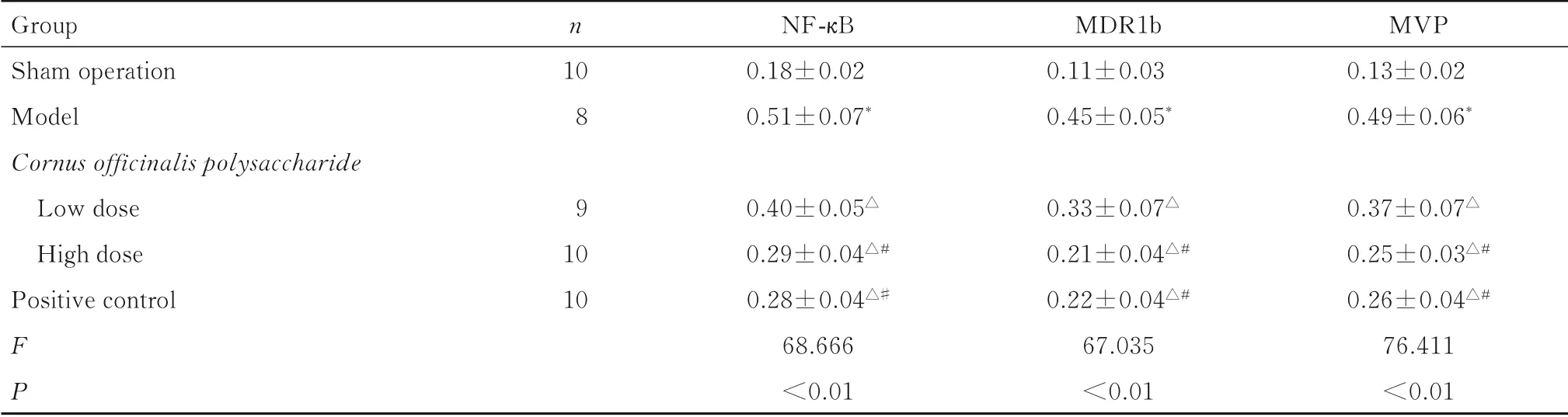
表4 各组幼鼠海马组织中NF-κB、MDR1b和MVP mRNA表达水平Tab.4 Expression levels of NF-κB,MDR1b,and MVP mRNA in hippocampus tissue of young rats in various groups (±s)
*P<0.05 compared with sham operation group;△P<0.05 compared with model group;#P<0.05 compared with low dose of Cornus officinalis polysaccharide group.
Group Sham operation Model Cornusofficinalispolysaccharide Low dose High dose Positive control FP n 10 8 9 10 10 NF-κB 0.18±0.02 0.51±0.07*0.40±0.05△0.29±0.04△#0.28±0.04△#68.666<0.01 MDR1b 0.11±0.03 0.45±0.05*0.33±0.07△0.21±0.04△#0.22±0.04△#67.035<0.01 MVP 0.13±0.02 0.49±0.06*0.37±0.07△0.25±0.03△#0.26±0.04△#76.411<0.01
3 讨论
癫痫是慢性脑部疾病,其特征是大脑神经元过度放电导致的短暂性中枢神经系统功能障碍,常反复发作[9]。近年来,随着抗癫痫手术和药物的普及,大部分患者能通过手术和药物治疗控制症状,但是仍有约30%的患者症状并无改善,而发展为RE[10]。由于RE的发病机制尚不清楚,且目前尚无有效治疗手段,故亟需寻找该病有效治疗方式以减轻患者症状。近年来,山茱萸多糖成为临床研究热点之一,其具有抗肿瘤、降压及改善认知功能等作用,对于阿尔茨海默病和癫痫等神经系统疾病有明显治疗作用[11-12]。因此,研究山茱萸多糖在RE治疗中的作用有重要意义。

图2 Western blottting法检测各组幼鼠海马组织中NF-κB、MDR1b和MVP蛋白表达电泳图Fig.2 Electrophoregram of expressions of NF-κB,MDR1b and MVP proteins in hippocampus tissue of young rats in various groups
TNF-α和IL-1β是机体炎症反应主要因子,其水平异常升高可增加机体神经损伤程度,从而影响行为学能力[13]。研究[14]显示:山茱萸提取物能通过降低机体炎症反应,进而改善癫痫大鼠的学习记忆能力。王福兴[15]研究表明:山茱萸提取物能通过减轻机体炎症反应,减缓糖尿病大鼠发病进程。本研究结果显示:与模型组比较,各剂量山茱萸多糖组幼鼠癫痫发作总次数和持续总时间减少,血清中TNF-α和IL-1β水平降低;HE染色结果显示:各剂量山茱萸多糖组幼鼠海马组织CA 1区细胞排列较为整齐,细胞轮廓较清晰,可见少量空泡变性、核破裂和核固缩,提示山茱萸多糖可减轻炎症反应,减少海马组织损伤,改善幼鼠癫痫发作情况。
表5 各组幼鼠海马组织中NF-κB、MDR1b和MVP蛋白表达水平Tab.5 Expression levels of NF-κB,MDR1b,and MVP proteins in hippocampus tissue of young rats in various groups (±s)
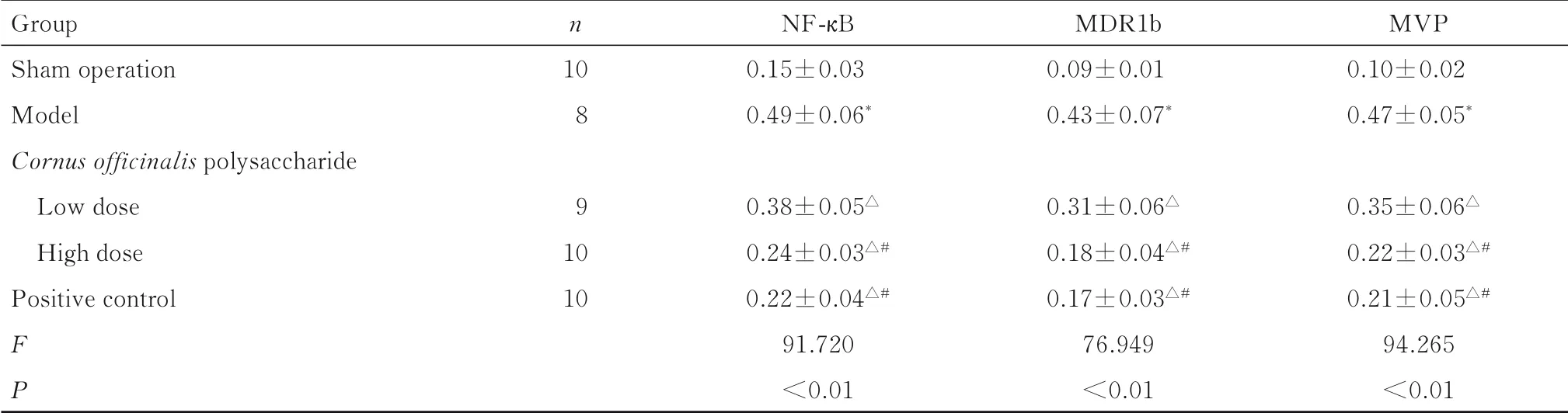
表5 各组幼鼠海马组织中NF-κB、MDR1b和MVP蛋白表达水平Tab.5 Expression levels of NF-κB,MDR1b,and MVP proteins in hippocampus tissue of young rats in various groups (±s)
*P<0.05 compared with sham operation group;△P<0.05 compared with model group;#P<0.05 compared with low dose of Cornus officinalis polysaccharide group.
Group Sham operation Model Cornusofficinalis polysaccharide Low dose High dose Positive control FP n 10 8 9 10 10 NF-κB 0.15±0.03 0.49±0.06*0.38±0.05△0.24±0.03△#0.22±0.04△#91.720<0.01 MDR1b 0.09±0.01 0.43±0.07*0.31±0.06△0.18±0.04△#0.17±0.03△#76.949<0.01 MVP 0.10±0.02 0.47±0.05*0.35±0.06△0.22±0.03△#0.21±0.05△#94.265<0.01
本研究结果显示:模型组幼鼠海马组织中MDR1b和MVP呈高表达,同时癫痫发作总次数较多和持续总时间较长,提示MDR1b和MVP高表达可能是引起RE的重要原因之一。NF-κB是一种有多向性转录调控作用的蛋白质因子,在脑部疾病发展进程中起调控作用[16]。MDR1b表达受NF-κB信号通路调控,且在MDR1b基因启动区存在NF-κB作用位点[17]。NF-κB活化能促进MVP表达,且参与TNF-α和IL-1β等多种炎症因子的表达,而炎症反应也会促进NF-κB活化,进而促进多药耐药基因表达,形成恶性循环[18-19]。抑制NF-κB信号通路可降低耐药基因的表达,减轻炎症反应,进而改善耐药癫痫大鼠的发作情况[20]。另有研究[21]显示:阻断NF-κB信号通路可抑制MDR1b表达,逆转RE的耐药作用。本研究结果显示:与模型组比较,各剂量山茱萸多糖组幼鼠海马组织中MDR1b和MVP mRNA和蛋白表达水平降低,提示山茱萸多糖治疗RE可能与下调MDR1b、MVP mRNA和蛋白表达有关。
综上所述,山茱萸多糖可减轻炎症反应和海马组织损伤程度,改善RE幼鼠癫痫发作情况,其作用机制可能与抑制MDR1b及MVP表达有关。未来应研究山茱萸多糖是否存在其他调控机制,为临床治疗RE提供参考。

