白莲莲房多糖分离纯化、结构表征及抗氧化与免疫活性
马广强 李国群 吴 静 熊 伟 吴 磊
(1.江西中医药大学生命科学学院,江西 南昌 330004;2.江西省科学院应用化学研究所,江西 南昌 330096)
植物多糖是一类重要的天然生物大分子。天然植物源多糖具有抗氧化、抗病毒、抗肿瘤、抗菌、调节免疫等多种生物活性[1-2],近年来,许多多糖已被广泛地研究和应用于生物化学以及医疗行业,植物源多糖被公认为安全、高度稳定和毒副作用小等优点应用在医药和食品领域。
莲(NelumbonuaferaGaertn)属睡莲科莲属,为多年生宿根水生草本植物[3]。目前,中国拥有的莲品种多达800个以上,主要分布于福建、浙江、湖北、湖南、江苏、安徽以及江西等地[4]。莲富含生物碱、黄酮、糖苷、萜类、类固醇、脂肪酸、蛋白质、矿物质和维生素等化学成分,具有抗氧化、消炎、抗菌、抗心律失常、降血糖、止泻、免疫调控等生理活性[5-9]。广昌白莲,中国国家地理标志产品。广昌县自古以来就被称为“莲乡”,历来被称为“贡莲”,为“莲中珍品”,一直畅销海内外。目前市面上出现了许多以荷叶、莲子以及莲子心为原料的产品,但是,在加工这些产品的过程中,会产生大量的下脚料——莲蓬壳,目前只是作为废弃物被丢弃,造成了极大的浪费。国内外目前对莲蓬壳中化学成分及其药用作用的相关研究鲜有报道,一直未得到重视。
课题组[10-11]前期曾对莲房乙醇提取物化学成分及活性进行了研究。但是对莲房多糖的研究仍处于空白。试验拟通过水提醇沉法从白莲莲房中提取多糖,并对纯化后的多糖理化性质进行分析,研究纯化多糖的抗氧化与免疫调节活性,以期为莲蓬壳废弃物的高附加值开发与利用提供理论支撑。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
莲房:广昌县白莲科学研究所提供,由江西省科学院应用化学研究所徐刚研究员鉴定为白莲的莲房,样本编号为LP-201708,已存放在江西省科学院应用化学研究所天然产物研究室的植物标本室;
RAW 264.7细胞:美国典型培养物保藏中心(ATCC);
单糖标准品[D-葡萄糖(Glc,110833-201707)、D-半乳糖(Gal,100226-201506)、L-鼠李糖(Rha,111683-201502)、D-木糖(Xyl,111508-201605)和D-甘露糖(Man,140651-201504)]:中国食品药品检定研究院;
L(+)-阿拉伯糖(Ara,1506-200202):中国药品生物制品检定所;
1640培养基、胰蛋白酶和胎牛血清:美国Gibco公司;
二甲基亚砜(DMSO)、脂多糖(LPS)、维生素C(VC)、1,1-二苯基-2-三硝基苯肼(DPPH) 以及2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):美国Sigma公司;
肿瘤坏死因子(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)ELISA试剂盒:南京建成生物工程研究所;
乙醇、氯仿、正丁醇:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
台式高速冷冻离心机:H1850型,厦门森态仪器仪表有限公司;
冷冻干燥机:FDU-1200型,东京理化器械株式会社;
电子天平:ML203型,梅特勒—托利多(上海)仪器有限公司;
酶标仪:Tecan Infinite 200 PRO M Nano型,瑞士帝肯公司;
超声波清洗器:KQ-500B型,昆山市超声仪器有限公司;
二氧化碳培养箱:CLM-170B-8-NF型,新加坡ESCO公司;
奥林巴斯倒置显微镜:CKX53型,日本奥林巴斯公司;
傅立叶红外光谱仪:FTIR-7600型,美国Lambad公司;
高效液相色谱仪(S-3250示差检测器):SYKAM S501 Series型,德国赛卡姆公司;
气相色谱仪:GC-2010型,日本岛津公司;
气相色谱检测器:FID型,日本岛津公司;
色谱柱:WondaCap5型毛细管柱(0.25 mm×30.0 m×0.25 μm),日本岛津公司;
自动进样器:AOC-20S型,日本岛津公司;
自动注射器:AOC-20i型,日本岛津公司;
压片机:DF-4型,天津港东科技发展股份有限公司。
1.2 方法
1.2.1 莲房粗多糖的提取 将阴干的莲房粉碎(500.00 g),用95%乙醇在80 ℃下热回流提取6 h以去除脂类、色素、单糖和小分子化合物。残渣在50 ℃的烘箱中干燥以获得脱脂的莲房粉。称取100.00 g脱脂粉末,以蒸馏水为提取溶剂,料液比(m脱脂粉末∶V蒸馏水)为1∶30 (g/mL),在90 ℃下的热回流提取3次,每次提取3.5 h。提取液在转速为4 000 r/min离心10 min、过滤,使用真空旋转蒸发器浓缩至体积约为300 mL,加入4倍体积的无水乙醇混合,置于4 ℃冰箱过夜,12 000 r/min离心10 min,通过冷冻干燥(-50 ℃,20 Pa,24 h)获得白莲莲房粗多糖。
1.2.2 莲房多糖的纯化 根据文献[12]并修改,称取白莲莲房粗多糖(1.00 g)加热水10 mL溶解,然后加入Sevage试剂(V正丁醇∶V氯仿=1∶4)充分震荡,在分液漏斗中静置,此步骤重复3次去除蛋白质,合并上层液体,用旋转蒸发仪浓缩去除有机溶剂残留。并加入粗多糖质量10%的活性炭,60 ℃、150 r/min 搅拌3 h,抽滤,浓缩(60 ℃,-0.1 MPa)。浓缩液装入截留分子量为3 000 U的透析袋中用自来水透析48 h,蒸馏水透析48 h以去除小分子化合物,将透析后的多糖溶液经冷冻干燥得到纯化莲房多糖。
1.2.3 莲房多糖质量分数测定 根据文献[13]并修改,使用葡萄糖为标准品,配置成质量浓度为1 mg/mL母液,用蒸馏水稀释成不同的标准浓度,加入苯酚硫酸反应后,吸取反应液200 μL至96孔板中,用酶标仪检测吸光度,以葡萄糖浓度为横坐标(X),吸光值为纵坐标(Y)绘制标准取线,回归方程:Y=0.003 1X+0.018 2,R2=0.999 3。粗多糖与纯化多糖含量经苯酚—硫酸法测得梯度葡萄糖的吸光值,代入标准曲线计算多糖含量,按式(1) 计算多糖的质量分数。
(1)
式中:
Y1——多糖的质量分数,%;
C——多糖配制液中多糖质量浓度,mg/mL;
V——配制液体积,mL。
m——莲房质量,g。
1.2.4 多糖结构表征
(1) 红外光谱分析:纯化的多糖与KBr粉末混合后研磨,然后压制成透明薄片,采用傅里叶变换红外光谱仪(FT-IR)在400~4 000 cm-1的范围内进行扫描。
(2) 分子量测定:采用SYKAM S501 Series 高效液相色谱仪测定纯化的莲房多糖分子量大小。使用5种葡聚糖标准分子量(Mw)(分别为10 000,40 000,70 000,200 000,375 500 Da)进行液相色谱分析。将标准品配制成2 mg/mL的标准溶液,通过0.22 μm微孔膜,在以下条件下进行高效液相色谱分析,以色谱峰保留时间(TR)为横坐标,葡萄糖标准品的平均分子量(lgMw)为纵坐标,绘制线性回归方程。液相色谱条件:TSKG5000色谱柱;流动相0.1 mol/L的磷酸盐缓冲液(pH 7.2);流速0.5 mL/min,柱温30 ℃,进样量20 μL,运行时间20 min。将白莲莲房多糖样品配成10 mg/mL的白莲莲房多糖溶液,用0.22 μm的微孔滤膜过滤后进行高效液相色谱分析。
(3) 单糖组分测定:对白莲莲房多糖的单糖组成进行分析,主要包括多糖的水解和乙酰化两个步骤,根据文献[14]并修改,精密称取白莲莲房多糖(10.0 mg)放入密封管中,然后加入2 mol/L三氟乙酸2 mL,在100 ℃下水解6 h以完全水解糖苷键。水解后,用甲醇共蒸馏去除多余的酸。水解物中加入0.5 mL吡啶使其溶解,加入10 mg盐酸羟胺,在水浴90 ℃下孵育30 min后,添加0.5 mL醋酸酐并通过涡流震荡彻底混合,继续在水浴90 ℃下孵育30 min,反应完成后,取下密封管,放置在氮吹仪下将反应液吹至干,加入2 mL氯仿溶解乙酰化衍生物,过0.22 μm有机膜至进样瓶中。单糖标准品(单标与混标)与内标按照多糖的乙酰化步骤进行操作。色谱条件:载气(氮气)体积流量 30 mL/min;进样温度235 ℃;检测器温度260 ℃;分流比10∶1;柱色谱升温程序:140 ℃保持3 min,以10 ℃/min 温度至240 ℃,并保持15 min;运行时间28 min,进样体积1 μL。
1.2.5 抗氧化活性
(1) DPPH自由基清除活性测定:根据文献[15]并修改。将3 mL的新鲜配置浓度为200 μmol/L的DPPH溶液作为自由基的母液分别加到不同浓度的样品溶液中,样品溶液质量浓度分别为0.025,0.050,0.100,0.200,0.400 mg/mL,所需样品体积为1 mL。溶液快速摇动混合,并在25 ℃下反应25 min。吸取反应液200 μL至96孔板中,在517 nm处用酶标仪测定吸光度。将维生素C用作阳性对照。按式(2)计算DPPH自由基清除率。
(2)
式中:
S1——DPPH自由基清除率,%;
A1——对照品溶液(无样品)的吸光度;
A2——样品溶液的吸光度。
(2) 羟基自由基(OH自由基)清除活性测定:根据文献[15]并修改。将1 mL不同质量浓度的多糖溶液(0.025,0.050,0.100,0.200,0.400 mg/mL)、1 mL硫酸亚铁溶液(6 mmol/L)和1 mL水杨酸—乙醇溶液(6 mmol/L)混合。用1 mL的0.1%过氧化氢摇匀,在37 ℃下黑暗反应30 min。取反应液200 μL转移至96孔板中,用酶标仪在510 nm下测定吸光度。以维生素C为阳性对照。根据式(3) 计算白莲莲房多糖及维生素C的OH自由基清除率。
(3)
式中:
S2——OH自由基清除率,%;
A0——蒸馏水代替样品溶液作为空白对照的吸光度;
A——样品吸光度。
(3) Fe3+还原能力测定:根据文献[16]并修改,将0.8 mL 样品(0.025,0.050,0.100,0.200,0.400 mg/mL)与0.4 mL磷酸盐缓冲液(pH 6.6,0.2 mol/L)和0.4 mL 1%铁氰化钾溶液混合,并在50 ℃下反应20 min,然后再将0.4 mL 10%三氯乙酸溶液加入混合体系中。静置10 min,加入1.6 mL蒸馏水和0.4 mL 0.1%氯化铁溶液,室温下静置10 min后,于700 nm处测定样品的吸光度。以维生素C为阳性对照。
1.2.6 免疫活性
(1) 细胞培养与模型建立:RAW 264.7细胞用RPMI 1640培养基(培养基中含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)于37 ℃、5% CO2培养箱中进行培养,培养基每2~3 d更换一次。当融合率达80%时,进行传代培养,传代好的细胞分为以下3组,① 空白对照组:正常细胞,不加任何药物;② 阳性对照组:培养基中加入1 μg/mL的LPS进行干预;③ 试验组:加入不同质量浓度的WLRP进行预孵。
(2) 对RAW 264.7细胞活力的影响:细胞活性检测采用MTT法[17],取对数生长期细胞以1×106个细胞/孔接种于96孔板中。置于CO2培养箱中培养18 h后,向细胞悬浮液中加入不同质量浓度(12.5,25.0,50.0,100.0,200.0 μg/mL)的白莲莲房多糖,继续孵育24 h,吸取上清液,加入100 μL MTT溶液(0.5 mg/mL),继续培养4 h,每孔加入100 μL MTT停止液。继续培养16~20 h后,在550 nm处用酶标仪测量吸光度,试验重复3次。按式(4) 计算细胞存活率。
(4)
式中:
S3——相对细胞存活率,%;
A1——试验组孔吸光值;
A2——空白组孔吸光值;
A3——对照组孔吸光值。
(3) 对细胞因子分泌量的影响:将RAW 264.7巨噬细胞(1×105个/mL)接种于48孔板中,置于CO2培养箱中培养24 h,吸去旧培养基,向48孔板中加入不同质量浓度(0.0,12.5,25.0,50.0,100.0 μg/mL)的白莲莲房多糖和1 μg/mL LPS(阳性对照),在37 ℃下继续培养24 h,NO的分泌量采用Griess法[17]进行检测,以亚硝酸钠为标品,配置不同浓度的亚硝酸钠溶液,加入Griess试剂反应测其吸光度,绘制标准曲线。TNF-α、IL-1β和IL-6的分泌量采用ELISA试剂盒测定。
1.2.7 数据分析 试验数据处理和作图软件采用Excel 2013及Sigmaplot 10.0软件,数据以平均值±标准差(SD)表示。单因素方差分析用于确定平均值之间的显著性差异。95%的置信水平(P<0.05)被认为具有统计学意义。
2 结果与分析
2.1 白莲莲房多糖的提取与纯化
按照方法步骤1.2.1与1.2.2所得白莲莲房粗多糖和纯化多糖的质量分别为9.45 g和0.56 g,经计算粗多糖与纯化多糖的得率分别为9.45%和5.29%,粗多糖与纯化多糖质量分数分别为32.34%和84.58%。
2.2 红外光谱分析


图1 白莲莲房多糖 的红外光谱图Figure 1 IR spectra of polysaccharide of white lotus receptacle
2.3 单糖组成及其分子量分析
对6种标准单糖和莲房多糖样品先后进行气相色谱分析。由图2(a)可知,6种单糖标准品在此色谱下分离完全。莲房多糖单糖组成如图2(b)所示,13.35 min处的单糖由于缺少相应单糖标品,暂未分析出来。莲房多糖主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖6种单糖组成,其摩尔比为1.28∶2.10∶1.00∶2.20∶2.42∶4.76,其中半乳糖占比最大,为34.59%,葡萄糖和甘露糖次之。刘恩超等[22-23]研究发现莲藕渣多糖主要由半乳糖和阿拉伯糖组成,其中半乳糖占比最高,为25.98%,邓添华等[24]研究表明莲子多糖中半乳糖的占比最高,与试验结果一致,推测半乳糖是莲多糖中占比最高的单糖。

1.鼠李糖 2.阿拉伯糖 3.木糖 4.甘露糖 5.葡萄糖 6.半乳糖 7.肌醇图2 标准单糖与白莲莲房多糖的气相色谱图Figure 2 GC chromatogram of complex monosaccharide derivative
多糖的分子量具有相对性,代表相似链长的平均分布,通常用统计平均值来表示所测定的多糖分子量大小[25]。采用高效液相色谱法测定不同标准品分子重量。以标准品的保留时间(TR)为横坐标,标准品的分子量平均值取对数(lgMw)为纵坐标,根据标准曲线lgMw=9.616 7-0.289 7TR(R2=0.996 7)测得白莲莲房多糖相对分子量为3.22×105kDa。此外,多糖(三螺旋)的有序结构对免疫调节活性至关重要。有研究[26]表明,只有多糖分子量>9×104Da,才能形成三重螺旋结构。
2.4 白莲莲房多糖的体外抗氧化活性
2.4.1 DPPH自由基清除能力 如图3所示,莲房多糖对DPPH自由基的清除率与其质量浓度呈剂量依赖性增加。在质量浓度为0.025~0.200 mg/mL时对DPPH自由基的清除作用增强较快,后趋于平缓,在0.200,0.400 mg/mL 时,其清除率分别为(43.76±3.26)%和(43.57±3.75)%,但均低于同浓度维生素C的。

图3 白莲莲房多糖对DPPH的清除能力的影响Figure 3 The effect of WLRP on DPPH radical scavenging ability (n=3)
2.4.2 OH自由基清除能力 如图4所示,莲房多糖对OH自由基的清除率随其质量浓度的增加而增加,但是整体清除率比维生素C低。在给药浓度范围内,莲房多糖对OH自由基的清除率在其质量浓度为0.400 mg/mL时达到最大,为(58.79±3.75)%。
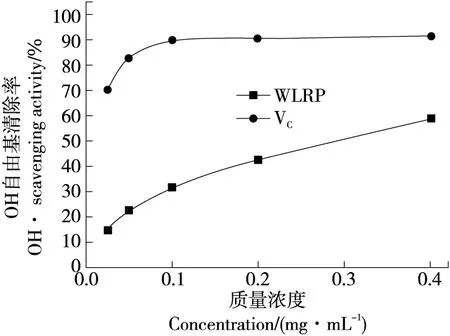
图4 白莲莲房多糖 对 OH 自由基清除能力Figure 4 The scavenging ability of WLRP to hydroxyl radicals (n=3)
2.4.3 Fe3+还原力 如图5所示,莲房多糖的Fe3+还原能力虽然随着给药浓度的增加而有所增强,但增加幅度偏小且整体弱于维生素C。在给药浓度范围内,莲房多糖在质量浓度为0.4 mg/mL时Fe3+还原能力达到最大,为0.44。

图5 莲房多糖的还原能力Figure 5 Reducing power ability of polysaccharide (n=3)
白莲莲房多糖在还原力、清除DPPH自由基和OH自由基等方面均表现出一定的作用,但是整体作用要弱于维生素C,可能由于抗氧化作用机制不同所引起的,维生素C能通过逐级供给电子而实现清除活性氧自由基的作用,而白莲莲房多糖的抗氧化作用与分子上含有的醇羟基等活性基团有关[27]。
2.5 白莲莲房多糖的免疫活性
2.5.1 对细胞存活率的影响 如图6所示,白莲莲房多糖质量浓度为200.0 μg/mL时,细胞存活率为(85.36±4.77)%(P<0.05),与正常组相比,显示对细胞有毒性,而多糖质量浓度为100.0,50.0,25.0,12.5 μg/mL时,细胞存活率分别为(96.77±4.52)%,(98.53±3.78)%,(106.46±5.23)%,(102.45±4.65)%,说明100 μg/mL以下的白莲莲房多糖对细胞是安全的,因此以0~100 μg/mL 白莲莲房多糖进行后续试验。

*表示与正常组相比(P<0.05)图6 白莲莲房多糖对RAW 264.7细胞存活率的影响Figure 6 Effect of WLRP on the viability of RAW 264.7 cells (n=3)
2.5.2 对RAW 264.7细胞NO、TNF-α、IL-6和IL-1β分泌的影响 研究观察了白莲莲房多糖对NO、细胞因子(TNF-α、IL-6和IL-1β)的影响。正常组中RAW 264.7细胞只释放少量的NO [(3.12±0.12) μmol/L]、TNF-α[(5.52±0.11) ng/mL]、IL-6[(8.43±1.02) ng/mL]和IL-1β[(27.56±1.22) ng/mL],如图7所示,与正常组相比,白莲莲房多糖(25,50,100 μg/mL)处理能显著促进NO、TNF-α、IL-6和IL-1β的分泌,呈剂量依赖性。在白莲莲房多糖质量浓度为100 μg/mL时,NO、TNF-α、IL-6和IL-1β的分泌量达到了最大值,与空白组相比,NO、TNF-α、IL-6和IL-1β的分泌量分别增加了29.89 μmol/L、84.24 ng/mL、33.89 ng/mL和45.96 ng/mL。然而,用白莲莲房多糖(50,100 μg/mL)处理后NO、TNF-α、IL-6和IL-1β的分泌缓慢增加。说明白莲莲房多糖对巨噬细胞的激活是有限的,过度激活巨噬细胞将会导致炎症。基于试验中莲房多糖与LPS对炎症因子的释放情况,白莲莲房多糖对巨噬细胞的作用远小于LPS。

*表示与空白组相比(P<0.05) **表示与空白组相比(P<0.01)图7 白莲莲房多糖对NO、细胞因子(TNF-α、IL-6和IL-1β)的影响Figure 7 Effects of WLRP treatment on the secretion of NO,cytokine (TNF-α,IL-1β and IL-6) in RAW 264.7 cells (n=3)
3 结论
白莲莲房多糖是一种杂多糖,主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖组成,其中半乳糖质量分数最大,为34.59%;白莲莲房多糖相对分子量为3.22×105kDa;另外,红外光谱分析表明白莲莲房多糖呈现出多糖类物质的典型特征吸收峰。莲房多糖作为新发现的天然多糖之一,试验表明,莲房多糖具有较强的DPPH、羟基自由基清除活性和还原能力,可以作为一种潜在的天然抗氧化剂资源,此外,白莲莲房多糖可通过刺激巨噬细胞释放NO和细胞因子(TNF-α、IL-6、IL-1β)来增强免疫调节活性而且对RAW 264.7细胞无毒性,可作为一种新型的功能性食品免疫调节剂。后续可对白莲莲房多糖的免疫调节活性的分子作用机制以及蛋白信号通路进行研究。

