肺炎支原体感染儿童血清淀粉样蛋白A含量检测价值
刘 贺
(安新县医院检验科,河北 安新 071600)
肺炎支原体(mycoplasma pneumoniae,MP)属原核微生物,大小介于细菌与病毒之间,是感染人类呼吸系统的一种常见病原体,其易感细胞为呼吸道上皮细胞,侵入后可引起气管/支气管炎、细支气管炎等多种上呼吸道感染疾病[1]。学龄儿童为MP感染导致肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)的高发群体[2]。儿童MPP起病急,早期肺部体征并不明显,缺乏明显特异性[3],随着病情加重,可出现肺外表现或并发多种全身性疾病[4,5],严重威胁患儿生命健康。研究发现血清淀粉样蛋白A(serum amyloid Aprotein,SAA)是较新颖的一种急性时相蛋白,与多种炎症性疾病的发生、发展有关,但在MP感染中的价值尚不清楚。本研究通过检测MPP患儿血清SAA水平,明确其对MPP的临床意义。
1 资料与方法
1.1 一般资料 选取2018年1月~2019年12月安新县医院诊治的65例MPP患儿为MPP组。纳入标准:符合儿童肺炎支原体肺炎诊断标准[6];近1个月内未出现其他感染。排除标准:合并其他病原体感染;呼吸系统疾病;免疫功能低下。另选取同期我院健康体检儿童65例为健康对照组。MPP组男38例,女27例,年龄1~15岁,平均年龄(8.27±2.63)岁;健康对照组男35例,女30例,年龄1~16岁,平均年龄(7.94±2.15)岁,两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。根据病情严重程度,将MPP组儿童分为轻症组(n=37)和重症组(n=28),轻症组男22例,女15例,年龄1~15岁,平均年龄(8.45±2.69)岁,重症组男16例,女12例,年龄1~15岁,平均年龄(8.45±2.69)岁,两亚组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究通过我院伦理委员会审核,所有研究对象均尤其监护人签定知情同意书。
1.2 方法
1.2.1 观察指标与检测 收集所有研究对象性别、年龄资料,同时收集第1秒用力呼气量(forced expiratory volume in 1 second,FEV1)、用力肺活量(forced vital capacity,FVC)和FEV1/FVC等主要肺功能指标数据,所有研究对象入院2 h内采集抗凝血2 ml,于3000 r/min离心10 min,收集血浆并置于-20 ℃保存,待统一行SAA检测。
1.2.2 出院后随访 在出院6个月后对所有患儿进行随访,行CT检测,观察基本体征和相关临床症状,发热、咳嗽等相关临床表现消失或明显改善,机体机能基本恢复正常或完全恢复正常视为预后良好,否则认定为预后不佳。
1.3 统计学分析 采用SPSS 22.0统计学软件进行数据分析,计量资料采用()表示,比较采用t检验,计数资料采用[n(%)]表示,比较采用χ2检验;变量间的相关性采用Pearson相关系数分析,采用ROC曲线分析SAA水平对MPP的诊断效能和预后预测价值,采用Logistic回归模型分析预后影响因素。P<0.05表示差异有统计学意义。
2 结果
2.1 三组主要肺功能指标比较 MPP组主要肺功能指标低于健康对照组,重症组主要肺功能指标低于轻症组,差异均有统计学意义(P<0.05),见表1。
表1 三组主要肺功能指标比较()

表1 三组主要肺功能指标比较()
2.2 三组SAA水平比较 MPP组SAA水平为(11.92±2.03)μg/ml,高于健康对照组的(3.32±0.92)μg/ml,差异有统计学意义(t=7.314,P<0.05);重症组SAA水平为(15.47±2.66)μg/ml,高于轻症组的(8.02±1.34)μg/ml,差异有统计学意义(t=9.262,P<0.05)。
2.3 不同预后MPP患儿SAA水平比较 预后良好48例,预后不佳17例,预后不佳组SAA水平为(18.52±2.97)μg/ml,高于预后良好组的(9.43±2.37)μg/ml,差异有统计学意义(t=5.825,P<0.05)。
2.4 MPP组SAA水平的相关性分析 MPP组SAA水平与疾病程度呈正相关,与疾病预后及肺功能指标(FEV1、FVC和FEV1/FVC)呈负相关,见表2。
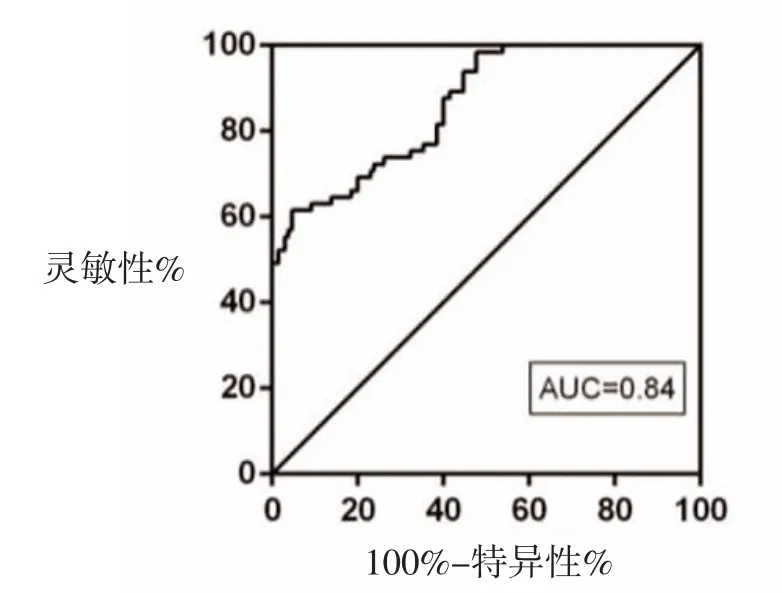
图1 SAA为变量诊断MPP的ROC曲线结果
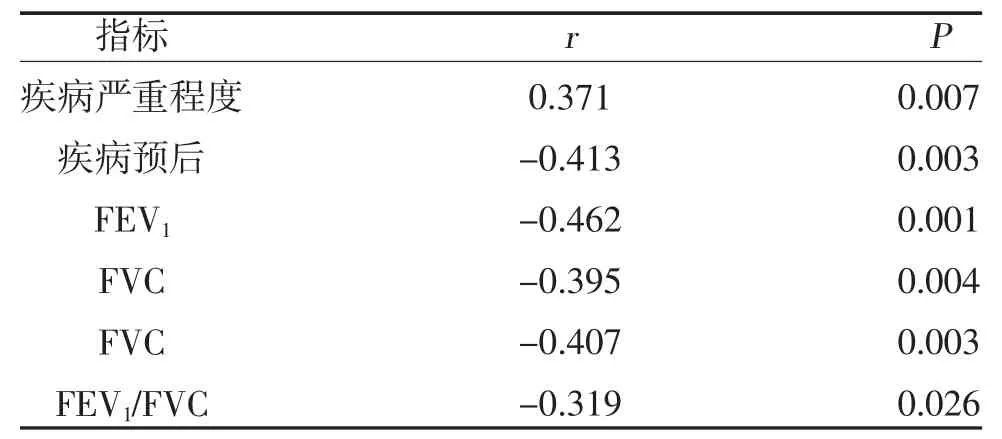
表2 MPP组SAA水平的相关性分析
2.5 SAA对MPP诊断和预后评估的价值分析 以SAA为变量绘制MPP诊断的ROC曲线,AUC为0.837(95%CI:0.815~0.943)。以SAA=5.27 μg/ml为cut off值,MPP诊断的敏感性为85.91%,特异性为78.19%;以SAA为变量绘制MPP预后的ROC曲线,AUC为0.884(95%CI:0.837~0.968);以SAA=16.31 μg/ml为cut off值,评估MPP预后的敏感性为90.82%,特异性为81.33%,见图1、图2。
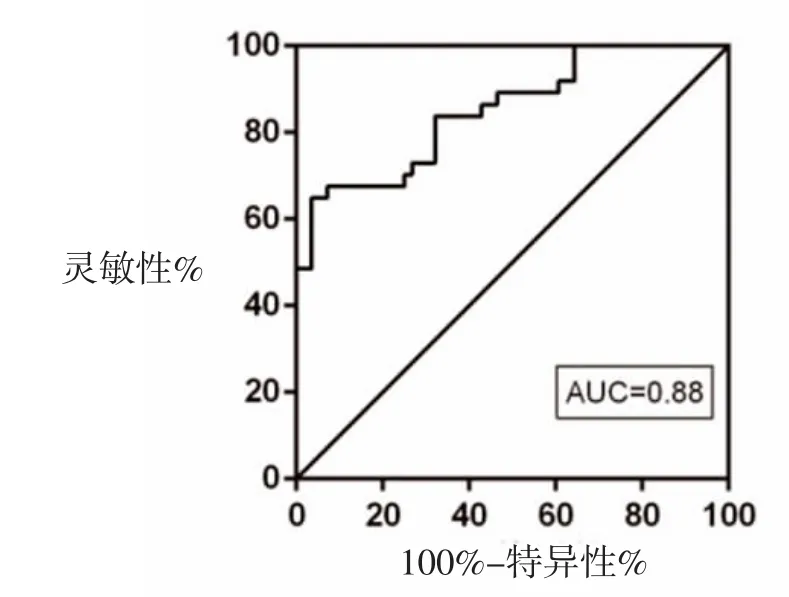
图2 SAA为变量判断MPP预后ROC曲线结果
3 讨论
在我国,MP是引起儿童社区获得性肺炎的主要病原体之一,其通过呼吸道进行传播,除了引起呼吸道疾病外,还可导致哮喘等气道高反应疾病和肺外疾病[7]。儿童为MPP高发群体,由于早期临床症状缺乏特异,易与流感等其他呼吸道疾病混淆,导致疾病治疗延误,进而诱发多系统、多器官受损,使临床治疗难度较大[8]。因此,对潜在MPP患儿进行早期筛查,能够有效减少发展为重症的可能,并利于临床采取有效防治措施,对改善患儿预后具有重要意义。
炎症是MP黏附、定植于支气管上皮细胞后产生的毒素而引起的[9,10],是MPP的一项重要临床表现。SAA属于载脂蛋白家族异构体,主要由肝脏中激活的单核细胞合成,研究证实其也是一种急性期时相蛋白,对单核细胞和中性粒细胞等吞噬细胞具有趋化作用,一方面促进单核细胞分泌组织因子,另一方面诱导中性粒细胞分泌炎症介质,参与炎症调节过程[11,12]。本研究结果显示,与健康对照组比较,MPP患儿SAA水平升高,且重症儿童SAA水平高于轻症儿童(P<0.05),SAA水平与病情程度呈正相关。同时还发现预后良好患儿SAA水平低于预后不佳患儿(P<0.05),SAA水平与疾病预后呈负相关,均提示SAA参与MPP进程和临床转归。MPP患儿SAA水平升高可能与MP感染后使机体内内毒素含量增加有关。内毒素的增加可引起病变部位多种炎性介质聚集,其中即包括SAA,从而加重病变部位的损伤并影响疾病预后[13]。有研究表明[14],SAA可参与调解机体免疫应答反应,通过与细菌脂多糖结合,激活机体免疫系统后介导细菌清除,利于感染状态的控制。
SAA对MPP患儿的诊断价值方面,ROC曲线分析结果显示以SAA为变量的AUC高达0.837,95%CI为0.815~0.943。以SAA=5.27 μg/ml为cut off值,诊断MPP的敏感性为85.91%,特异性为78.19%。SAA与临床常用炎症标志物-CRP相似,也可反应急性炎症进程,但SAA比CRP反应更为灵敏,在微弱炎症刺激下即可快速反应,结合本研究结果,提示其有可能成为临床上早期MPP诊断的一项筛查指标。鉴于在细菌、病毒等感染性疾病中SAA亦可升高,并非MPP诊断的特异性指标[15],但不同感染类型发生时SAA水平升高程度有所差别,可通过实时监测SAA水平变化程度,以达到准确诊断MPP的作用。进一步评估SAA对MPP患儿预后判断的价值,以SAA为变量的ROC曲线AUC为0.884,95%CI为0.837~0.968。以SAA=16.31 μg/ml为cut off值,评估MPP预后的敏感性为90.82%,特异性为81.33%。SAA是反映患者炎症状态的灵敏指标,其含量高低与MPP患儿预后有关,也进一步证实了炎症严重程度影响了MPP儿童的预后情况[16]。
综上所述,MPP患儿SAA水平升高,与疾病严重程度及预后密切相关,早期监测SAA变化情况在临床对MPP的辅助诊断和预后判定具有重要意义,可用作疾病的监测指标。

