miR-34a-5p过表达靶向抑制MET对肝癌细胞HepG2恶性增殖、侵袭和肿瘤形成的影响
杨慧萍,朱梦佳,王 淋,赵文霞,陈 雨
肝细胞癌是位于人类肝脏中的常见肿瘤。由于手术切除,转移和异质性的复杂性,肝细胞癌被认为是世界上3大最致命的肿瘤之一。在肝癌的临床治疗中已经采用了许多治疗策略,包括药物干预、化学栓塞、保守治疗和手术治疗,但是由于缺乏对病理机制的深刻理解,肝癌的临床治疗效果仍不理想。微小RNA(microRNA,miRNA)可有效地调节各种生物过程,进一步研究miRNA的表达模式和作用可能为肝癌提供新的诊断和治疗靶标。
miR-34a-5p是miR-34a家族成员,可调节多种细胞的增殖和侵袭。已有研究表明miR-34a-5p在肝癌组织中表达明显低于非肝癌肝组织。间质表皮转化因子(mesenchymal to epithelial transition factor,MET)是PTKs家族成员,MET表达水平与肝癌的术后复发、生存时间关系密切,可作为肝癌术后预后指标。该文通过荧光素酶报告实验验证miR-34a-5p与MET靶向关系,探讨miR-34a-5p过表达对HepG2细胞增殖、侵袭及肿瘤生长的影响。
1 材料与方法
1.1 实验动物
10只雄性4~5周龄Balb/c裸鼠,体质量18~22 g,由成都达硕实验动物有限公司提供,动物许可证号:SCXK(川)2020-030,所有裸鼠均饲养于特定的无病原体条件下。1.2 实验试剂
RPMI-1640培养基、胎牛血清、青霉素/链霉素双抗溶液、胰蛋白酶购自美国Gibco 公司;荧光素酶检测试剂盒购自北京solarbio公司;BCA蛋白浓度测定试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、TUNEL细胞凋亡检测试剂盒均购自上海碧云天生物技术研究所;兔抗人Ki67、增殖细胞核抗原(proliferating Cell Nuclear Antigen,PCNA)、Bax(ab53154)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Caspase-3、cleaved caspase-3、β-actin均购自英国Abcam公司。1.3 细胞培养
人肝癌细胞株HepG2来源于中国典型培养物保藏中心,将细胞接种于RPMI 1640培养基(含10 %胎牛血清、1×10U/L青霉素/链霉素双抗溶液)中,于恒温培养箱(5 % CO、37 ℃)中培养。实验用细胞为对数生长期细胞。1.4 RT-PCR
通过采用TRIzol溶液从HepG2细胞中抽提总RNA,反转录获得cDNA,按SYBR PremixEX Taq Ⅱ试剂盒说明书进行检测。反应条件为:预变性95 ℃ 2 min,变性95 ℃、5 s,60 ℃、10 s,95 ℃、5 s,40个循环,60 ℃、1 min。miR-34a-5p上游引物为:5′-AGCCGCTGGCAGTGTCTTA-3′,下游引物为:5′-CAGAGCAGGGTCCGAGGTA-3′;U6上游引物为:5′- ATTGGAACGATACAGAGAAGATT-3′,下游引物为:5′- GGAACGCTTCACGAATTTG-3′。以U6为内参,miR-34a-5p的相对表达使用公式2计算。1.5 荧光素酶报告实验
通过生物信息学网站targetscan分析显示MET是miR-34a-5p的潜在靶点,采用荧光素酶报告实验进行验证,构建野生型和突变型MET 3、UTR荧光素酶报告基因质粒,转染至HepG2细胞。采用荧光素酶检测试剂盒检测细胞荧光素酶相对活性。1.6 MET过表达
构建MET pcDNA载体过表达MET,转染至HepG2细胞,将细胞随机分为3组:Control、pcDNA和pcDNA-MET组。通过RT-PCR和Western blot确定过表达是否成功。1.7 细胞分组
miR-34a-5p mimic与pcDNA-MET单独或联合转染肝癌HepG2细胞,Control组、miR-34a-5p mimic组(mimic)、pcDNA-MET组(MET)和miR-34a-5p mimic+pcDNA-MET组(mimic+MET)。1.8 克隆形成实验
取方法1.7转染后的各组细胞,按500个/孔接种于6孔板,于恒温培养箱(5 % CO、37 ℃)中培养14 d,当出现肉眼可见的克隆时,4 %多聚甲醛固定30 min,0.5 %结晶紫染色30 min,拍照观察克隆形成数目,计算细胞克隆形成率。细胞克隆形成率=细胞克隆数/接种细胞数×100%。1.9 流式细胞仪检测细胞凋亡
收集方法1.7转染后培养48 h的细胞,PBS清洗2遍,加入结合缓冲液制成细胞悬液,避光加入5 μl AnnexinⅤ-FITC和5 μl PI混匀,孵育15 min,采用流式细胞仪上机分析,检测各组细胞凋亡率。1.10 Transwell
将基质胶均匀铺至Transwell小室上室,并加入100 μl细胞悬液 (10/ml),下室加入500 μl完全培养基,37 ℃孵育24 h后多聚甲醛固定20 min, 0.1 %结晶紫染色20 min,于荧光显微镜随机选择5个视野计数穿模细胞数。1.11 Western blot
取方法1.7转染后各组细胞,用含蛋白酶抑制剂的细胞裂解液提取总蛋白,BCA试剂盒测定蛋白含量。采用SDS-PAGE凝胶电泳法分离蛋白质样品并转移至PVDF膜,于4 ℃条件下加入MET、Ki67、PCNA、Bax、Bcl-2和Caspase-3一抗(1 ∶1 000)孵育过夜,TBST清洗,4 ℃条件下加入辣根过氧化物酶标记的二抗(1 ∶10 000)孵育2 h,ECL显影发光并曝光处理。通过ImageJ软件分析灰度值,以目的条带灰度值/Actin灰度值表示蛋白表达水平。1.12 裸鼠皮下移植瘤模型
将荷瘤裸鼠随机分成2组:Control和mimic组,取方法1.7对数生长期的Control和mimic组细胞,调整接种HepG2细胞浓度为1×10/ml,接种于裸鼠右侧腋窝处(皮下注射,0.2 ml)。每5 d测量1次移植瘤的体积,30 d后处死裸鼠,剥离肿瘤并称取瘤子重量。1.13 免疫组化
取部分肿瘤组织,石蜡包埋切片,切片厚度为4 μm,按免疫组化检测试剂盒说明书进行免疫组化染色,DAB显色,苏木精复染1 min,盐酸乙醇分化2 s,显微镜下观察Ki67表达情况,Ki67阳性细胞定位于细胞和,阳性表达为细胞核染成黄色或棕黄色。1.14 TUNEL
取方法1.13切片,按TUNEL细胞凋亡检测试剂盒说明书加TUNEL反应液,光学显微镜下随机选取5个视野并计数凋亡细胞。凋亡阳性细胞核为有棕黄色着染者,正常细胞呈蓝色。肿瘤组织细胞凋亡率(%)=肿瘤组织凋亡细胞数量/肿瘤组织总细胞数×100%。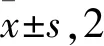
2 结果
2.1 miR-34a-5p靶向下调MET
为明确miR-34a-5p对MET的靶向关系,采用荧光素酶报告实验进行验证,搜索生物信息学网站获得MET 3′UTR序列如图1A所示,MET Wt加入miR-34a-5p mimic处理后荧光素酶活性降低(F
=33.40,P
<0.05,图1D),表明miR-34a-5p和MET存在靶向作用关系。RT-PCR检测miR-34a-5p、MET mRNA水平(图1B、C),与Control组比较,mimic组miR-34a-5p mRNA水平升高(t
=1.226,P
<0.05),MET mRNA水平降低(t
=2.040,P
<0.05)。
图1 miR-34a-5p与MET靶向关系
2.2 MET过表达升高MET mRNA水平和蛋白表达水平
构建MET pcDNA载体,通过RT-PCR和Western blot确定过表达是否成功(图2),与Control组比较,pcDNA-MET组MET mRNA水平和蛋白水平均升高(t
=1.615、1.270,P
<0.05)。
图2 MET过表达对MET mRNA水平和蛋白表达水平的影响
2.3 miR-34a-5p过表达抑制HepG2细胞增殖,降低Ki67、PCNA蛋白表达水平
通过克隆形成法检测各组细胞增殖情况(图3A),与Control组比较,mimic组细胞克隆形成率降低(t
=1.750,P
<0.05),MET组细胞克隆形成率升高(t
=4.000,P
<0.05),mimic+MET组细胞克隆形成率低于MET组(t
=3.125,P
<0.05);通过Western blot检测各组细胞Ki67、PCNA蛋白表达水平(图3C),与Control组比较,mimic组细胞Ki67、PCNA蛋白水平降低(t
=1.316、1.381,P
<0.05),MET组细胞Ki67、PCNA蛋白水平升高(t
=1.880、2.000,P
<0.05),mimic+MET组细胞Ki67、PCNA蛋白水平低于MET组(t
=1.802、1.830,P
<0.05)。2.4 miR-34a-5p过表达促进HepG2细胞凋亡,升高Bax/Bcl-2、cleaved Caspase-3/Caspase-3比值
通过流式细胞仪检测各组细胞凋亡情况(图4A),与Control组比较,mimic组细胞凋亡率升高(t
=1.402,P
<0.05),MET组细胞凋亡率降低(t
=4.035,P
<0.05),mimic+MET组细胞凋亡率高于MET组(t
=1.516,P
<0.05);通过Western blot检测各组细胞Bax、Bcl-2、Caspase-3蛋白表达水平(图4B),与Control组比较,mimic组细胞Bax/Bcl-2、cleaved Caspase-3/Caspase-3比值升高(t
=1.157、1.270,P
<0.05),MET组细胞Bax/Bcl-2、cleaved Caspase-3/Caspase-3比值降低(t
=1.200、2.333,P
<0.05),mimic+MET组细胞Bax/Bcl-2、cleaved Caspase-3/Caspase-3比值高于MET组(t
=1.058、1.400,P
<0.05)。2.5 miR-34a-5p过表达抑制HepG2细胞侵袭
通过Transwell检测各组HepG2侵袭细胞数(图5),与Control组比较,mimic组侵袭细胞数降低(t
=1.886,P
<0.05),MET组侵袭细胞数升高(t
=5.542,P
<0.05)。与MET组比较,mimic+MET组侵袭细胞数降低(t
=2.803,P
<0.05)。
图3 miR-34a-5p过表达对HepG2细胞克隆形成率和Ki67、PCNA蛋白表达水平的影响 × 200

图4 miR-34a-5p过表达对HepG2细胞凋亡和Bax、Bcl-2、Caspase-3蛋白表达水平的影响
2.6 miR-34a-5p过表达对肝癌裸鼠移植瘤的影响
与Control组比较,mimic组第25、30天肿瘤体积降低(t
=2.103、2.029,P
<0.05),肿瘤组织重量降低(t
=1.820,P
<0.05),mimic组Ki67阳性细胞数降低(t
=1.271,P
<0.05),肿瘤组织细胞凋亡率升高(t
=1.141,P
<0.05)。见图6。3 讨论
越来越多的研究显示,miRNA的表达失控与肝癌的发生发展密切相关。在肿瘤中,miRNA常常起到抑癌基因或癌基因的作用。相关研究表明,在乳腺癌骨转移中,miR-34a-5p的缺失与MET的表达呈负相关。本研究表明miR-34a-5p和MET存在直接靶向作用关系,miR-34a-5p可能是治疗肝癌的有效潜在靶点。
调控肿瘤细胞的增殖是治疗肿瘤的重要方式。Ki67属于增殖相关蛋白,其表达水平的高低可评估癌细胞的增殖能力。PCNA是一种与细胞增殖状态有关的核蛋白,PNCA指数越高,细胞的分裂增殖越快,有可能促进细胞获得无限增殖的能力并最终使细胞的形态结构和机能发生改变。张亚飞 等发现miR-34a-5p靶向GMFB抑制SH-SY5Y细胞增殖。Sun et al发现上调肝癌细胞中miR-34a-5p表达可抑制肝癌细胞增殖。本研究显示miR-34a-5p过表达靶向抑制MET通过降低克隆形成率、Ki67及PCNA蛋白表达量,提示miR-34a-5p过表达抑制HepG2细胞增殖。且降低肝癌裸鼠移植瘤模型肿瘤组织Ki67阳性细胞数,提示miR-34a-5p过表达抑制肝癌裸鼠移植瘤模型肿瘤组织细胞增殖。

图5 miR-34a-5p过表达对HepG2细胞侵袭的影响 ×200
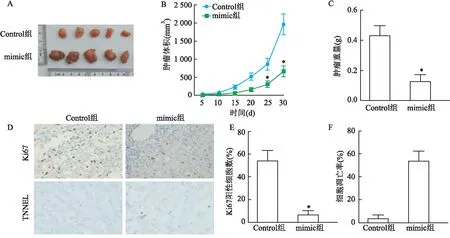
图6 miR-34a-5p过表达对肝癌裸鼠移植瘤的影响 ×200
肿瘤治疗最本质的策略是诱导肿瘤细胞的凋亡,细胞凋亡是发生在响应异常和细胞损伤的重要细胞机制,异常凋亡反应在许多类型的人类癌症的发生发展过程中十分常见。相关研究表明,Bax/Bcl-2比值升高诱导细胞凋亡,Bax/Bcl-2比值降低细胞凋亡受到抑制,在肝癌细胞中miRNA主要通过Bcl-2家族来影响细胞凋亡。Caspase蛋白的改变是细胞凋亡发生的重要标志,而Caspase-3是以无活性的前体存在,在细胞接受到一系列的凋亡信号后Caspase-3经过剪切成为活化的执行因子Caspase-3,其是细胞凋亡不可逆的标志。李勤 等发现miR-34a-5p过表达可促进滋养层细胞凋亡。冯婉琴 等发现miR-34a-5p mimic促进子宫内膜基质细胞凋亡。miR-34a-5p过表达靶向抑制MET具有升高HepG2细胞Bax/Bcl-2、cleaved Caspase-3/Caspase-3比值和升高肝癌裸鼠移植瘤肿瘤组织细胞凋亡率的作用。提示miR-34a-5p过表达靶向抑制MET促进HepG2细胞凋亡和裸鼠肿瘤组织细胞凋亡。
大量研究表明,肝癌预后不良的原因在于肝癌细胞的侵袭和转移能力,抑制肝癌细胞的侵袭活力是治疗肝癌的重要方式。李鹏 等发现上调miR-34a-5p靶向TPD52抑制膀胱癌细胞侵袭。本文表明miR-34a-5p过表达靶向抑制MET具有降低HepG2细胞侵袭细胞数的作用。提示miR-34a-5p过表达靶向抑制MET抑制HepG2细胞侵袭。
综上所述,miR-34a-5p过表达靶向MET抑制抑制HepG2细胞增殖、侵袭,诱导细胞凋亡,抑制裸鼠移植瘤肿瘤的形成。以miR-34a-5p为靶点的干预治疗有望成为肝癌治疗的新方法, 值得临床进一步研究探讨。

