蝶形花亚科花发育的基因调控网络
姜 雨,张耀华,冯献忠
(1.中国科学院 东北地理与农业生态研究所 大豆分子设计育种重点实验室,吉林 长春 130102;2.中国科学院大学,北京 100049)
0 引 言
花是植物体中最复杂的器官,是隐花植物向显花植物进化的标志性特征。在侏罗纪晚期到白垩纪早期时期,频繁变化的气候和地理条件为最早有花植物新物种的产生提供了驱动力,而显花植物在随后适应生存环境和气候变化的过程中逐渐演化成为分布最广和最繁盛的植物类群[1-2]。全世界目前有近30万种有花植物,分布于约四百个科内。豆科(Leguminosae)作为被子植物中仅次于菊科和兰科的第三大科,约有650属,18 000种,是与人类生活息息相关的食物、油料、饲料、木材、染料、树胶、树脂及纤维等资源植物。豆科因丰富的物种,多样的形态,成为研究植物形态发生和遗传发育的经典材料。根据花对称性和花被卷叠模式,传统植物分类学研究将豆科分为3个亚科:云实亚科(Caesalpinioideae,171属,2 250种)、含羞草亚科(Mimosoideae,83属,3 271种)和蝶形花亚科(Papilionoideae,478属,13 800种),其中,蝶形花亚科是豆科最大的亚科。蝶形花亚科植物的花型为两侧对称,而含羞草亚科和云实亚科的花大多呈辐射对称。为解决长期以来云实亚科并非单一起源的问题,近年来通过对分子系统进化的研究,科学家们提出了包含6个亚科的豆科新分类系统[3]。在新的分类系统中,只有传统的蝶形花亚科(Papilionoideae)保留了下来,而传统的云实亚科被拆分为五个新界定的亚科:紫荆亚科(Cercidoideae)、甘豆亚科(Detarioideae)、山姜豆亚科(Duparquetioideae)、酸榄豆亚科(Dialioideae)和新的云实亚科(Caesalpinioideae),传统的含羞草亚科则被作为一个超族划入新的云实亚科中。
蝶形花亚科植物与拟南芥和金鱼草等模式植物相比,其花发育过程更加复杂和精巧,存在着一些特殊的发育事件和形态结构,研究这些发育现象和结构的分子机制不仅对认知豆科植物发育和进化机制具有重要的科学意义,而且对豆科植物的驯化和改良具有潜在的应用前景。本文主要综述了豆科蝶形花亚科研究比较深入的大豆、豌豆、蒺藜苜蓿和百脉根4个物种的花发育过程和相关分子机制的研究进展,归纳了蝶形花亚科花发育的模式和基因调控网络,旨在为全面了解蝶形花亚科植物花发育提供理论依据。
1 蝶形花亚科植物的花发育过程
显花植物花的发育主要包括花分生组织的决定、花原基起始、花器官原基起始和器官原基属性决定4个关键的发育过程。当植物从营养期进入生殖期后,随着花序分生组织属性基因表达,顶端分生组织转化为花序分生组织;之后,花分生组织属性基因表达,花器官原基从花序分生组织上分化;接着下游花器官属性基因被激活,花器官原基分化出各轮花器官;最后,各轮花器官在不同器官发育特异性基因的作用下完成器官功能的特化。
蝶形花亚科植物的花为两侧对称花型,有21个花器官,呈五基数排布:包括五枚萼片;五枚覆瓦式排列的花瓣,其中一枚旗瓣两侧对称,两枚翼瓣和两枚龙骨瓣两侧不对称;两轮共十枚雄蕊,背部的一枚雄蕊独立,其他九枚雄蕊与花粉管基部融合,中心位置为一枚心皮[4]。与拟南芥的花相比,蝶形花亚科植物和金鱼草一样,具有比拟南芥更为复杂的两侧对称花型的发育过程;与金鱼草的花相比,蝶形花亚科植物具有更多的雄蕊以及复杂的融合和排布方式(图1)。同时,蝶形花亚科植物常为总状花序或圆锥花序,少为头状花序或穗状花序,花序属性和结构的决定是其发育过程的重要事件。
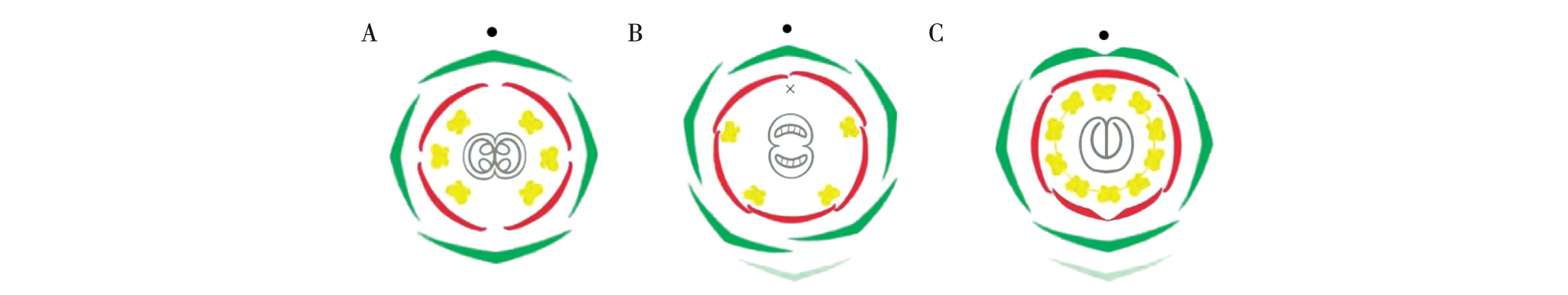
注:拟南芥(A)、金鱼草(B)和蝶形花亚科(C)花图式。浅绿部分表示苞片,绿色部分表示萼片,红色部分表示花瓣,黄色部分表示雄蕊,交叉位置表示退化雄蕊,灰色部分表示心皮,黑色圆圈表示花轴。Note:The floral diagrams of Arabidopsis thaliana(A),Antirrhinum majus (B)and Papilionoideae(C).The light green part represents bract,the green part represents sepal,the red part represents petal,the yellow part represents stamen,the cross position represents staminode,the gray part represents carpel,and the black circle represents rachis.图1 模式植物与蝶形花亚科植物花图式Fig.1 Floral diagrams of model plants and Papilionoideae
蝶形花亚科植物的花发育研究起始于传统遗传学经典材料豌豆(Pisumsativum),目前的研究主要集中在豆科模式植物蒺藜苜蓿(Medicagotruncatula)和百脉根(Lotusjaponicus)中。随着大豆(Glycinemax)基因组的公布,对于其花发育的研究也在不断深入(图2A-D)。与模式植物相比,蝶形花亚科植物花发育具有几个典型的特征[5-6]:(1)花器官原基从远轴端(腹部)向近轴端(背部)单向起始;(2)有些豆科植物花瓣和雄蕊在初期以共同原基的状态出现,导致同一轮中出现不同属性的器官;(3)不同轮的器官起始时间相互重叠(图2E)。

注:大豆(A)、豌豆(B)、蒺藜苜蓿(C)和百脉根(D)成熟的花,标尺,2 mm;(E)蝶形花亚科植物花发育阶段模式图,绿色部分表示萼片,红色部分表示花瓣,蓝色部分表示共同原基,黄色部分表示雄蕊,灰色部分表示心皮,FS表示花发育阶段。Note:The flowers of Glycine max(A),Pisum sativum (B),Medicago truncatula(C) and Lotus japonicas(D),scale bar,2 mm.(E) Schematic diagram of floral development of Papilionoideae.The green part represents sepal,the red part represents petal,the blue part represents common primordia,the yellow part represents stamen,and the gray part represents carpel,FS represents floral developmental stage.图2 蝶形花亚科代表性植物的花和发育阶段模式图Fig.2 Representative flowers and schematic diagram of floral development in Papilionoideae
在豆科植物发育形成花器官的过程中,分生组织属性基因和花器官属性基因以及其他一些调控基因共同作用,形成复杂的基因调控网络(图3),精确地调控花序和花器官的决定及形成。在这些基因调控网络中,模式植物的多数基因在豆科植物中功能较为保守,也有部分基因的功能在豆科植物中发生了显著的变化[7],同时豆科中也存在一些特有的基因参与花发育过程[8]。下面,我们重点从花分生组织属性决定、花序发育相关基因、花器官属性基因和花对称性四个方面的进展进行总结。
2 花分生组织属性决定的基因调控网络
在拟南芥中,FT(FLOWERINGLOCUST)和SOC1(SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1)是开花转变过程中的两个重要的调控因子,其中,FT接受光信号刺激决定营养生长向生殖生长的转化;SOC1与AGL24(AGAMOUS-LIKE 24)参与开花自主调控途径,决定植物从营养生长向生殖生长的转化;SOC1与FUL(FRUITFULL)共同激活下游LFY(LEAFY)基因,促进AP1(APETALA1)的表达,从而实现顶端分生组织侧翼的花发育[9-10]。另一方面,TFL1(TERMINAL FLOWER 1)和AGL24作为花序分生组织属性基因,通过与LFY等一系列花分生组织基因相互拮抗作用,实现花序原基和花原基的转变[11]。
在大豆中已报道了9个FT的同源基因,其中,GmFT2a和GmFT5a被证实主要决定营养期顶端分生组织向生殖期花序分生组织的转变[12]。GmFT2a和GmFT5a调控下游GmLFY2、GmAP1s、GmSOC1s和GmFULs基因,共同参与光周期调控开花的过程[13];在过表达GmFT2a导致开花时间提前的大豆中,GmSOC1基因的转录水平升高[14]。在大豆早期花发育过程中,发现了3个MADS-box转录因子(GmMADS3a,GmMADS3b,GmMADS3-like),是AGL6亚家族的新成员;它们不仅在整个花序和花分生组织中表达,在花不同发育时期也都起着重要的作用,这有别于拟南芥的分生组织属性决定基因[8]。

注:大豆(A)、豌豆(B)、蒺藜苜蓿(C)和百脉根(D)花发育过程的基因调控网络示意图。I1M代表初级花序分生组织;I2M代表次级花序分生组织;FP代表花原基;CP代表共同原基。黑色的箭头和短线分别表示正调控和负调控作用。Note:Schematic diagram of gene regulatory networks of floral development of Glycine max(A),Pisum sativum(B),Medicago truncatula(C) and Lotus japonicas(D).I1M,primary inflorescence meristem;I2M,secondary inflorescence meristem;FP,floral primordium;CP,common primordium.Black lines ending in an arrow and ending in a bar denote positive and negative regulatory interactions respectively.图3 蝶形花亚科四种植物花发育基因调控网络示意图[7-36] Fig.3 Schematic diagram of gene regulatory networks of floral development in Papilionoideae
豌豆的突变体brac(frondosus)与拟南芥的突变体lfy表型相似,主要表现为苞片增生,萼片苞片化,花瓣数目减少,次级花序分生组织取代花的位置[15]。豌豆中TFL1的两个同源基因存在功能分化,其中DET(DETERMINATE)在初级花序分生组织中表达,维持花序的未分化状态,而代替拟南芥TFL1对花期造成影响的是另一个同源基因LF(LATEFLOWERING)[7]。另外,豌豆中还有3个主要影响花序发育的基因,分别是GI(GIGAS)、VEG1(VEGETATIVE1)和VEG2。GI作为FT的同源基因,起到促进开花的作用[16];VEG1被鉴定为FULc同源基因,它作为次级花序分生组织属性基因在复合花序的发育中起到重要的作用[17];VEG2作为FD(FLOWERINGLOCUSD)同源基因,影响开花过程和次级花序分生组织的发育[18]。VEG2与FT蛋白共同作用,调控下游TFL1、LFY同源基因以及VEG1和PIM(PROLIFERATINGINFLORESCENCEMERISTEM)的表达,进一步影响花的发育过程[19]。
在蒺藜苜蓿中克隆到了MtTFL1、MtFULc、MtPIM和SGL1(SINGLE LEAFLET 1),这些基因分别参与初级花序分生组织,次级花序分生组织,花原基以及共同原基的形成过程,其中,MtPIM和SGL1基因是拟南芥AP1和LFY同源基因[20-21]。与拟南芥不同,苜蓿缺少关键的开花抑制调控因子FLC(FLOWERINGLOCUSC)和CO(CONSTANS)[22-23]。这一过程中,SVP(SHORTVEGETATIVEPHASE)与SOC1和AGL24相互作用,并在营养组织中普遍表达[24]。MtSVP1过表达后,只影响了突变体的花器官发育,并未影响开花时间,提示该基因可能并不会对开花转变的过程产生抑制作用。MtVRN2(MtVERNALISATION2)作为开花抑制因子,抑制MtFTa1基因的表达[25];MtSOC1a在过表达FTa1的早花苜蓿和Mtvrn2突变体中均有较高的表达[26]。NMH7(Nodule MADS-box homologue 7)[27]基因在苜蓿根瘤中首次被检测到,属于MADS-box转录因子。研究发现,它不仅可以在根瘤中检测到表达,还影响光周期和花发育过程,是豆科特有的参与光周期的基因;其同源基因在大豆生长发育过程的多个阶段发挥着多种作用[28]。
百脉根中LFY的同源基因LjFLO(LjFLORICAULA)发生功能缺失后,在突变体中并没有检测到TFL1同源基因LjCEN(LjCENTRORADIALIS)的异位表达[29],提示百脉根中TFL1和LFY、AP1之间反馈协调作用与拟南芥不同。LjFT与豆科其他植物中作用相似,可以响应光周期信号,从而促进开花[30]。
豆科植物存在复合花序,致使开花诱导到花分生组织形成的调控机制更加复杂;除拟南芥中已知的调控基因外,还有一些新的基因参与其中。深入研究相关基因在豆科中的新功能,揭示它们在豆科植物花发育中的基因调控网络,可以为豆科花发育特殊机制解析提供分子证据。
3 花序发育的基因调控网络
在模式植物拟南芥中,LFY基因作为主要的分生组织属性基因,其表达量达到一定阈值后,将会激活下游花器官属性基因的表达;在这一过程中,LFY基因无法单独作用,而是通过UFO(UNUSUALFLORALORGANS)和WUS(WUSCHEL)基因共同完成对花器官B功能和C功能基因的激活。目前,对于豆科花序发育的研究主要集中在对模式植物同源基因功能的研究上。
大豆中的WUS基因的同源基因GmWUS在茎顶端分生组织和花原基中都有表达,说明其在花序分生组织向花分生组织转变过程中起着重要的作用。GmWUS突变后的表型与拟南芥wus突变体表型基本一致,表明大豆中GmWUS功能较为保守[31]。大豆GmFILa(GmFILAMENTOUSFLOWERa)基因属于FIL亚家族,编码YABBY转录因子。GmFILa的异位表达会引起叶片极性、茎顶端分生组织发育和开花时间的改变。除了影响大豆花发育之外,GmFILa可能同时参与调控植物的抗逆能力[32]。
豌豆中UNI(UNIFOLIATA)和STP(STAMINAPISTILLOIDA)分别是LFY和UFO的同源基因,在uni和stp双突变体中,突变体的表型与B功能基因缺失突变体类似,表明豌豆中UNI和STP同样共同调控B功能基因的表达[33-34]。除了作为激活花器官属性基因的关键调控因子参与花发育过程外,研究还发现UNI和STP基因共同作用,调控豌豆复叶发育的新通路[33-34]。
AGLF(AGAMOUS-LIKEFLOWER)和AGTFL(AGAMOUSANDTERMINALFLOWER)是在蒺藜苜蓿中发现的参与调控花序和花原基发育的新调控因子[35-36]。AGLF功能丧失后,导致雄蕊和心皮转变为额外的花瓣和萼片,与拟南芥中C功能缺失突变体ag(agamous)表型相似,AGLF通过在转录水平上激活MtAG来调控苜蓿花器官属性[35]。在A功能基因MtAP1和B功能基因MtPI(MtPISTILLATA)突变体中去除AGLF基因,都会得到更强的C功能缺失表型[35]。AGTFL(AGAMOUSANDTERMINALFLOWER)基因突变,不仅具有末端花状花序,同时也有ag突变体的表型,导致心皮和雄蕊向花瓣和萼片转变,改变初级花序分生组织的特性,AGTFL可以通过调控MtAGs和MtTFL1的转录来控制花器官属性和花序发育[36]。这些结果揭示了蒺藜苜蓿决定花器官属性过程既有独特的分子机制又有相对保守的一部分功能。
豆科植物的花器官属性基因被激活,除了UFO和WUS两个共转录因子外,还发现了GmFILa、AGLF和AGTFL等新的调控因子,共同参与花序发育和花器官的形成,对其深入的研究将会有助于揭示豆科花序决定的分子机制。
4 花器官属性决定的基因调控网络
拟南芥中被广泛研究的花器官属性基因的发挥功能模式是经典的“ABC模型”,其成功地解释了花器官原基属性决定的分子机制。ABC功能基因是植物花不同器官形态建成所必需的,每类功能基因各司其职,共同调控不同器官的发育,进一步的研究提出了更加完善的“ABCE模型”。目前,模式植物研究最具代表性的基因包括A功能基因AP1、AP2,B功能基因AP3、PI,C功能基因AG和E功能基因SEP(SEPALLATA)[37]。
对大豆的研究表明,大豆中A功能基因GmAP1s[38]决定花发育的起始,参与萼片和花瓣的形成; E功能基因GmSEP[39]参与花器官形成过程,其功能相对保守;而对大豆中B功能基因和C功能基因的研究比较空白。
在豌豆中,AP1的同源基因PEAM4(pea-MADS4)突变后,突变体出现早花的表型,并没有出现萼片和花瓣被雄蕊和心皮取代的现象[15]。随后发现cc(calyxcarpellaris)突变体出现萼片心皮化,花瓣缺失,雄蕊数目减少,心皮打开的表型;同时发现该突变体的次级花序分生组织的侧翼异位生长出柱头组织,说明CC与PEAM4基因共同行使A功能[15];B功能基因PsAP3[40]和PsPI[34]控制花瓣和雄蕊的发育,C功能缺失突变体pe(petalosus)中雄蕊花瓣化后心皮通常不融合,在其内部长出各种器官,造成花瓣-雄蕊共同原基和心皮属性的不决定[41]。进一步研究发现,在pe和stp双突变中,B功能缺失的表型加强,表明豌豆中C功能基因与B功能基因之间存在互作[41]。比较豌豆中上述突变体的表型,推测STP和CC可能共同参与共同原基的起始,随后影响共同原基的器官数目,而PE则参与决定共同原基的属性。PsSEP1/2[42]作为E功能基因,在花发育整个过程中发挥着重要的作用。
蒺藜苜蓿中发现了1个A功能基因MtPIM[43];3个B功能基因MtNMH7、MtTM6(MtTOMATO MADS BOX GENE6)[27]和MtPI[44],前两个是AP3同源基因;2个冗余的C功能基因MtAGa和MtAGb[45];1个E功能基因MtSEP[46]。对Mtaga和Mtagb双突变体研究发现,雄蕊和心皮转变为许多类旗瓣状花瓣,这与拟南芥中ag突变体表型不同。苜蓿中MtAGa和MtAGb基因抑制A功能基因、B功能基因以及MtWUS基因的表达,但对D功能基因表达有促进作用。Mtaga和Mtagb双突变体的表型与TCP(TEOSINTE-BRANCHED1/CYCLOIDEA/PCF)基因上调有关[47]。
百脉根中LjFLO表达后,激活下游LjAP1a和LjAP1b在花分生组织外围环状表达,决定萼片属性,起始花瓣-雄蕊分生组织区域化。LjFIM(LjFIMBRIATA)占据了花瓣-雄蕊共同原基的位置,决定共同原基起始。同时,LjAGa、LjAGb和LjSEP3在花分生组织中间区域表达,决定心皮原基形成。B功能基因LjPIa和LjPIb在腹部共同原基表达,参与维持早期共同原基的状态,而LjAP3特异在花瓣和雄蕊原基中表达,参与花瓣和雄蕊的属性决定,维持功能区域化[5]。
基于豆科植物花发育的特殊性,花器官形成过程中A-E类功能基因除了决定不同花器官属性,还参与共同原基的形成,对这些基因之间相互调控网络的认知,将有助于揭示豆科植物花发育的独特性。
5 蝶形花亚科植物花型发育的基因调控网络
与模式植物金鱼草一样,豆科蝶形花亚科植物的花为两侧对称花,但其花型发育控制的分子机制似乎更为复杂。豆科植物中,决定花型发育的背腹极性和内部不对称性是由两个相互独立的分子途径控制[48],这与金鱼草的花型发育调控机制有所差异。对大豆CYC(CYCLOIDEA)、RAD(RADIALIS)和DIV(DIVIRICATA)同源基因的研究结果显示,GmCYCs基因和GmRADs基因主要在旗瓣表达,GmDIVs基因则集中在翼瓣和龙骨瓣中表达,其中龙骨瓣中表达更高,其表达模式与金鱼草中的基因表达模式基本一致,这表明GmCYCs、GmRADs和GmDIVs对大豆花对称性发育过程的调控与金鱼草中相似[49-50]。
豌豆SYP1(SYMMETRIC PETAL 1)突变后,翼瓣和龙骨瓣都表现出了两侧对称的表型,结合k(keeledwings)/lst1(lobed standard 1)/syp1三突变体中所有花瓣都表现腹部花瓣的属性,说明SYP基因参与决定了豌豆花器官内部不对称性。之后,豌豆中又发现,ELE1(ELEPHANT EAR-LIKE LEAF 1)和ELE2基因与SYP1在同一遗传途径中,共同参与了花瓣内部不对称性发育的调控过程[51-52]。
对豌豆和百脉根中CYC同源基因的研究表明,尽管豆科两侧对称花型不同于金鱼草,是独立进化而来的,但豆科中CYC基因同样参与花的对称性发育过程,控制两侧对称花型背腹极性的建立[53-54]。豌豆中同样克隆到调控花型发育的两个CYC同源基因,K基因突变后侧部花瓣腹部化,LST1基因突变后旗瓣裂痕加深,说明K基因和LST1基因在豌豆中分别控制翼瓣和旗瓣属性,共同决定豌豆花型的背腹极性[51]。LATH(LATHYROIDES)基因也对豌豆花型发育有重要的作用,其在背部、侧部和腹部花瓣均表达,但对花瓣的影响存在背腹极性的差别,LST1基因与LATH基因相互抑制,通过协调作用共同调控某些基因,决定背部花瓣的形态发育[4]。
除CYC途径外,蝶形花亚科植物中还发现了一系列调控花型发育的新机制,其中,LATH基因和CYC基因相互作用,决定背部花瓣属性;ELE基因和SYP1基因共同参与决定花瓣内部不对称性。保守的CYC途径与调控花瓣属性和花瓣对称性的新基因共同决定蝶形花亚科植物特殊的花型结构,对其深入研究将有助于了解植物花型进化的演化历程。
6 展望
蝶形花亚科植物的花发育与模式植物拟南芥和金鱼草相比,在形态学和分子机制上存在较显著的差异。在花发育过程中,蝶形花亚科植物的花原基是由次级花序分生组织发育而来;心皮原基在萼片原基之后,花瓣原基之前形成;每轮花器官原基起始有方向性,都从腹部向背部起始;大多蝶形花亚科植物的花瓣原基和雄蕊原基是通过共同原基分化而来。从开花诱导到花序和花分生组织形成、起始花器官,蝶形花亚科植物花发育的特殊性导致其花发育机制相比模式植物更为复杂和精细。
尽管目前已经对蝶形花亚科模式植物复合花序和共同原基形成的相关机制有了一定的认识,但对于调控花发育和花型发育的基因网络的认知仍然相当薄弱。今后的研究中,有几个重要的科学问题值得深入探究:(1)共同原基的形成在蝶形花亚科植物花发育过程中是否为必需的阶段?在这一过程中,共同原基与豆科作物的驯化历程是否相互关联。(2)蝶形花亚科植物雄蕊数目的变化幅度是几个到几百个,决定豆科植物器官数目的相关分子机制尚不清楚。可以推测,雄蕊轮的发育对蝶形花亚科植物花瓣形态和数目之间存在一定的关联,但具体的调控网络并不清晰。(3)目前对于蝶形花亚科花型发育的研究更多地集中在花瓣对称性上,而对调控花瓣数目的基因发现的较少,探究控制花瓣数目的相关基因,将会更完整地认识蝶形花亚科花型发育的分子机理。
随着豆科植物发育生物学、进化生物学研究的不断深入,基因组学及代谢组学等研究技术的迅速发展,对于蝶形花亚科植物花发育分子机理认知会越来越丰富,将有助于我们揭开这一进化枝中存在的花序起始与决定、共同原基发育、花对称性与花瓣对称性调控等特征性的发育机制,为花器官改良和驯化提供科学的依据。对于蝶形花亚科之外的其他五个亚科植物的研究,也将会加深我们对豆科花发育的遗传调控网络和进化发育研究,为解析有花植物的生殖发育进化历程提供线索。

