电休克治疗恢复期老年抑郁症患者多导睡眠图特征研究
王晨,孔晓明,陈领,张丽,王克永,孙艳
老年期抑郁症是指年龄>60岁的抑郁症患者[1],因身体机能减退,躯体疾病增多,负性事件增多,往往症状严重,容易复发。临床症状主要表现为心境低落,相当高比例患者伴睡眠障碍和焦虑症状,容易导致自伤自杀等严重后果,具有高致残率等特点,社会负担沉重。电休克治疗(electroconvulsivetherapy,ECT)是治疗老年期抑郁症最快速有效的方法,但机制尚不明确[2],有研究认为ECT会产生脑结构和机体功能病理生理性变化[3],故定义ECT结束后1周为电休克恢复期。在电休克恢复期,可观察到抑郁核心症状及伴随的睡眠障碍普遍有改善[4]。这些研究目前主要集中在成年抑郁症患者,利用主观睡眠问卷和临床症状量表等工具,较少见客观睡眠指标。
多导睡眠监测(polysomnography,PSG)又称睡眠脑电图[5],主要通过动态记录被试的脑电、眼动、肌电、心电、体动、呼吸及血氧等生理指标,来分析个体的客观睡眠进程、结构及其他相关特征。孔晓明等[6]发现老年期抑郁症患者存在睡眠潜伏期延长、快速眼动睡眠前移、非快速眼动睡眠时间减少。张斌等[7]发现抑郁症患者经过SSRIs类药物治疗后其快速眼动睡眠的潜伏期缩短,N1期睡眠时间短于对照组,睡眠进程与结构异常。但老年期抑郁症患者电休克治疗恢复期的客观睡眠状况缺乏深入研究。因此,本研究拟利用PSG,来初步探索老年期抑郁症患者在ECT恢复期的客观睡眠特征。
1 资料与方法
1.1 一般资料
纳入2014年1月至2019年12月在安徽省精神卫生中心的老年期抑郁症患者30例为研究组,男9例,女21例;平均年龄(68.33±4.90)岁;治疗恢复期汉密尔顿抑郁量表(Hamilton Depression Scale,HAMD-24)总分(2.93±3.09)分,汉密尔顿焦虑量表(Hamilton Anxiety Scale,HAMA)总分(2.37±2.49)分。入组标准:符合国际疾病与相关健康问题统计分类第10版(ICD-10)精神与行为障碍分类中“抑郁发作”及“复发性抑郁障碍”的诊断标准;年龄≥60岁;告知患者或监护人测试内容并签署知情同意书;符合ECT的相关适应证。排除标准:患严重的躯体疾病;合并其他的精神疾病史;药物或酒精滥用药史;近期有中枢神经系统感染、脑血管意外、脑积水、脑肿瘤等神经系统疾病;痴呆。另选择健康体检合格的老年人19例为对照组,男9例,女10例;平均年龄(65.00±11.58)岁。入组标准:HAMD-24评分<8分,年龄≥60岁;既往无严重的躯体疾病史,无任何精神疾病史,近期无重大生活事件;签署知情同意书。2组性别、年龄差异无统计学意义(P>0.05)。本研究经安徽省精神卫生中心医学伦理委员会批准。
1.2 方法
1.2.1 客观睡眠监测 采用俄罗斯Neurosoft公司生产的Neuron-Spectrum-5型多导睡眠监测仪进行整夜监测。研究组在ECT结束后1周内监测客观睡眠。监测室温度稳定在20℃~26℃,湿度适宜。监测当晚约20时进入监测室,由专业技术人员安置电极并进行多导睡眠监测,记录数据包括脑电、眼动、肌电、口鼻气流、胸腹式呼吸、血氧饱和度、心率等数据。患者根据作息习惯自行选择入睡时间,第二日8时结束监测。监测数据采用美国睡眠医学学会的睡眠判读规则(AASM 2012),由经过培训的技术人员分析判读。分析指标主要包括总睡眠时间(total sleep time,TST)、睡眠效率(sleep efficiency,SE)、睡眠潜伏时间(sleep latency,SL)、快速眼动睡眠期潜伏期(rapid eye movement latency,REML)、N1期、N2期、N3期、快速眼动睡眠(rapid eye movement,REM)期睡眠时间及所占百分比(N1%、N2%、N3%、REM%)。
1.2.2 临床症状评定 分别采用HAMD-24、HAMA[8]对研究组在治疗恢复期,对照组入组时给予评定。HAMD-24由24项组成,包括焦虑/躯体化、体重、认知障碍、日夜变化、迟缓、睡眠障碍、绝望感7个因子,HAMD-24>20分为抑郁,HAMD-24<8分为无抑郁。HAMA由14项组成,包括躯体性焦虑和精神性焦虑两类,HAMA≥14分为肯定有焦虑,HAMA<7分为无焦虑。
1.3 统计学处理
采用SPSS22.0软件分析数据,计量数据以(±s)表示,非正态分布计量资料比较采用非参数检验,正态分布计量资料组间比较采用配对t检验;Spearman秩相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 2组客观睡眠进程及睡眠结构比较
2组TST、SE、SL、REML、N1%、N2、N2%、REM、REM%差异无统计学意义(均P>0.05),研究组的N1低于对照组,N3及N3%高于对照组,差异有统计学意义(均P<0.05),见表1。
表1 2组睡眠进程及客观睡眠结构比较(±s)
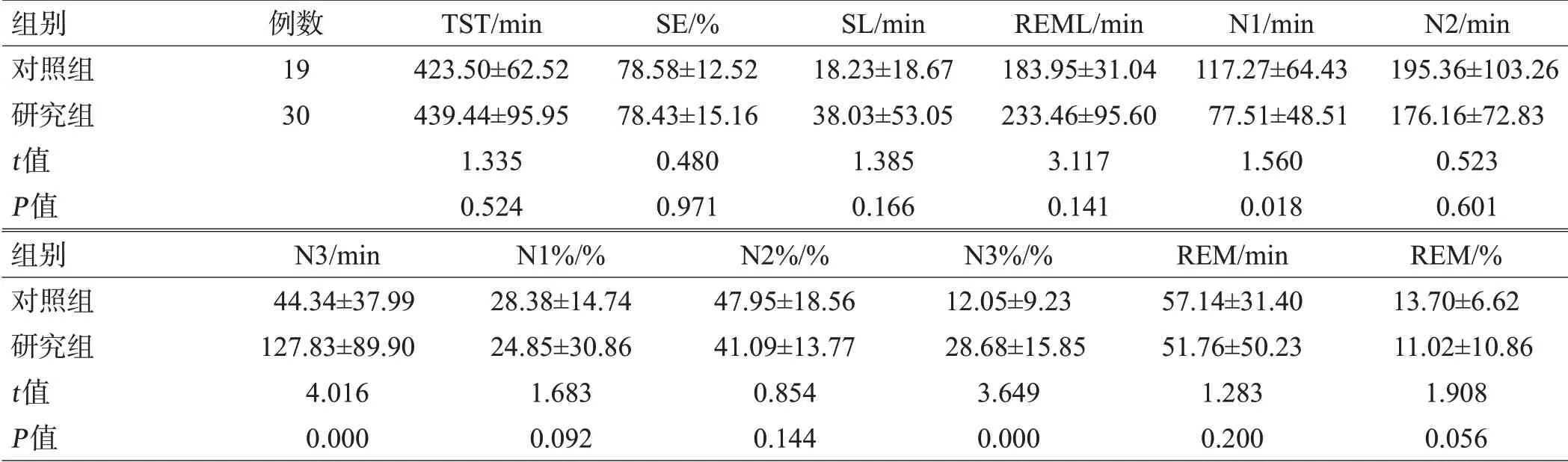
表1 2组睡眠进程及客观睡眠结构比较(±s)
组别对照组研究组t值P值例数19 30 TST/min 423.50±62.52 439.44±95.95 1.335 0.524 SE/%78.58±12.52 78.43±15.16 0.480 0.971 SL/min 18.23±18.67 38.03±53.05 1.385 0.166 REML/min 183.95±31.04 233.46±95.60 3.117 0.141 N1/min 117.27±64.43 77.51±48.51 1.560 0.018 N2/min 195.36±103.26 176.16±72.83 0.523 0.601组别对照组研究组t值P值N3/min 44.34±37.99 127.83±89.90 4.016 0.000 N1%/%28.38±14.74 24.85±30.86 1.683 0.092 N2%/%47.95±18.56 41.09±13.77 0.854 0.144 N3%/%12.05±9.23 28.68±15.85 3.649 0.000 REM/min 57.14±31.40 51.76±50.23 1.283 0.200 REM/%13.70±6.62 11.02±10.86 1.908 0.056
2.2 研究组睡眠检测指标与HAMD-24和HAMA评分相关性分析
研究组的SL与HAMD-24总分呈负相关,TST、SE与HAMD-24总分呈正相关(P<0.05)。研究组N1和N1%与HAMA总分呈负相关,N3和N3%与HAMA总分呈正相关(P<0.05),见表2。
3 讨论
睡眠障碍包括睡眠进程障碍和睡眠结构障碍。研究显示,随着年龄增长,正常老年人群逐渐出现入睡时间延长,总睡眠减少[9]。孔晓明等[6]发现抑郁症患者随着年龄增加,睡眠效率下降,REML缩短,SL延长。谢琴等[10]研究发现老年期抑郁症ECT后HAMD睡眠障碍因子分数下降。但缺少客观睡眠指标佐证这一观点。在本研究中,PSG结果显示研究组在电休克恢复期包括SL、REML、SE和TST等睡眠进程指标与对照组的差异无统计学意义。推测ECT对于老年抑郁症患者具有良好的睡眠障碍治疗效果,其总体睡眠的节律可恢复正常。
睡眠结构是由非快速眼动(non-rapid eye movement,NREM)睡眠和REM睡眠两个不同睡眠时相构成。在整个睡眠过程中,两个时相交替出现。其中NREM包括N1期、N2期和N3期。现有研究发现老年期抑郁症患者N3期睡眠时间显著减少[6],而在成年抑郁症患者中,经过ECT后的N3期睡眠时间则显著增多[11,2],与对照组无显著差异。本研究发现,老年期抑郁症患者电休克恢复期的N1期睡眠时间显著短于对照组,N1期比例则无差别;N3期睡眠时间和比例均长于对照组。这表明电休克恢复期的老年抑郁症患者的慢波睡眠时间增加,甚至长于正常老年人。一方面,这可能与ECT的疗效有关。研究显示,N3期属于慢波睡眠,其与睡眠质量、机体体力恢复等关系密切[13]。经颅电刺激和经颅磁刺激作为一种小剂量电刺激治疗已被证明[14]有助于增加慢波睡眠和巩固记忆。ECT是通过使用超过癫痫阈值电量并产生全身强直性发作[15],推测电休克作为一种强烈电刺激,使大脑神经元过度放电,导致慢波睡眠明显增加。另一方面,抑郁症的发病与扣带回、海马、额叶等多部位脑区解剖结构和功能变化有关[16]。ECT被发现可以改善海马功能,增加海马体积[17]。而海马与慢波睡眠的调控机制密切相关[18]。由此推测ECT可能通过改善海马相关脑区功能达到治疗作用。最后,从包括癫痫、脑炎等脑器质性疾病患者的脑电图与动态脑电图结果研究中可以发现,相关患者的慢波脑电背景增加,这可能是大脑神经元异常放电或其它形式的脑结构损伤病理性激活大脑网络导致[19]。这也可能就是电休克恢复期慢波睡眠增多,甚至高于正常对照的原因所在。即ECT可能对于老年抑郁症患者的脑电活动存在一定程度的负面损害。因此需进一步探索ECT的副反应,最终改良ECT,减少不良反应。
本研究中相关性分析提示,部分睡眠进程指标与HAMD总分相关,部分睡眠结构与HAMA总分相关。因本研究纳入患者ECT结束后HAMD总分低于阈值,睡眠指标与症状量表之间具体相关性不能明确。笔者下一步将扩大样本量,探索阈下抑郁与睡眠特征的相关性。

表2 研究组睡眠指标与HAMD和HAMA评分相关性分析
综上所述,ECT恢复期老年期抑郁症患者的总体睡眠进程指标与对照组差异无统计学意义,睡眠结构中N1、N3期睡眠时相的部分指标与对照组差异有统计学意义,这可能同ECT对老年期抑郁症的治疗机制及副反应均有密切联系。本研究的研究组样本尚不足,下一步将扩大样本量,结合认知功能、主观睡眠指标和功能磁共振等手段进一步探索。
