创伤性脑损伤后认知障碍的海马氢质子磁共振波谱分析
胡霞,周苏键,苏静,彭慧平
创伤性脑损伤(traumatic brain injury,TBI)是目前全球范围内最常见的外科损伤之一,不同损伤程度的TBI常引起长、短期认知障碍[1],不仅影响患者的生活质量,更阻碍其早期康复。氢质子磁共振波谱(proton magnetic resonance spectroscopy,¹H-MRS)作为一种无创的定量检查技术,可在大脑组织微结构发生变化之前就获取相关生化信息,是客观检测脑损伤后物质代谢异常的一种重要方法[2]。脑组织在受到创伤撞击等因素后,其物质代谢随之发生改变,即出现代谢易感性状态。先前的研究表明海马对损伤具有高度的代谢易感性[3],因此,本研究通过对TBI后认知障碍患者进行¹H-MRS检查,观察其海马区N-乙酰天门冬氨酸(N-acetylaspartic acid,NAA)、胆碱(choline,Cho)、肌酸(creatine,Cr)等代谢指标的变化,联合神经认知功能量表测试结果,探讨TBI后认知障碍患者脑内物质代谢与认知改变的关系,为TBI后认知障碍的辅助诊断和预后评估提供影像学依据。
1 资料与方法
1.1 一般资料
选取2019年12月至2020年10月在中国人民解放军联勤保障部队第九〇〇医院住院的TBI后认知障碍患者28例,纳入标准:有明确外伤史,符合《外科学》中“颅脑损伤”的诊断标准;格拉斯哥昏迷评分(Glasgow Coma Scale,GCS)9~15分,且简易精神状态检查表(mini-mental state scale,MMSE)≤26分,即存在认知功能障碍且能配合完成认知功能评定;年龄18~60岁;病程≤1月;受伤前后未服用促进或抑制脑内乙酰胆碱神经递质释放的相关药物。排除标准:经检查证实有脑卒中、颅脑肿瘤、癫痫等其他疾病引起的认知障碍;存在严重视、听、言语及意识障碍等影响认知评估;因药物中毒或手术干预引起的认知障碍;具有严重代谢性疾病(如过度肥胖、肝性脑病、糖尿病酮症酸中毒等)影响MRS检查结果;幽闭恐惧症、颅内金属内固定及金属假牙等磁共振检查禁忌证;妊娠及哺乳期女性。所有患者根据入院时GCS评分分为2组:①轻度TBI后认知障碍组(mi-TBI组,GCS 13~15分)9例,男4例,女5例;年龄31~58岁,平均(46.00±9.38)岁;受教育程度为小学2例,初中1例,高中3例,大学3例;车祸外伤5例,高处坠落伤2例,重物砸伤1例,跌倒伤1例。②中度TBI后认知障碍组(mo-TBI组,GCS 9~12分)19例,男12例,女7例;年龄29~60岁,平均(48.00±8.87)岁;文化程度为小学4例,初中4例,高中5例,大学6例;车祸外伤10例,高处坠落伤4例,重物砸伤3例,跌倒伤2例。同时在本院健康体检中心招募健康对照者10例为健康对照组,纳入标准:既往无脑损伤病史,签署知情同意书且无相关禁忌证。男5例,女5例;年龄22~57岁,平均(42.50±11.88)岁;受教育程度为小学3例,初中2例,高中2例,大学3例。各组的年龄、性别及受教育程度差异无统计学意义(P>0.05)。该研究已经通过本院生物医学伦理委员会批准(伦理批件号:2020-014)。在首次招募时,有自主签字能力的患者均给予书面知情同意,对于缺乏能力的患者,家属与临床医师协商后签署知情同意书。
1.2 方法
1.2.1 常规MRI及¹H-MRS检查 本试验过程中¹H-MRS检查及数据分析均在本院医学影像中心完成,采用德国西门子Trio Tim3.0T超导MR扫描设备和12通道相控阵头颅线圈。扫描前研究者对患者进行一般情况评估,并告知注意事项,每位受试者的扫描时间点均统一安排在下午14点至18点,检查时室温保持在18℃~25℃。首先进行T13D定位扫描(T1WI),从横状面、冠状面、矢状面三个方向进行定位,扫描参数:TR=2 100 ms,TE=30 ms,FOV=260×260 mm;而后进行T2FLAIR扫描(T2-FLAIR),扫描参数:TR=4 200 ms,TE=92 ms,FOV=250×250 mm;根据冠状位图像用于确定波谱扫描感兴趣区域(volumes of interest,VOI),最后行磁共振波谱扫描,采集方法:选择多体素化学位移成像(chemical shift imaging,CSI)方法,选取受试者左右两侧的海马结构为VOI,全范围扫描体积为80 mm×80 mm×80 mm,单个体素大小为2.0 mm×2.0 mm×2.0 mm,扫描参数TR=1 700 ms,TE=135 ms,采集次数192次,通过手动匀场处理使半高宽(full width at half maximum,FWHM)值在20左右行MRS扫描,CSI的放置要尽量避免与皮下脂肪、颅骨和脑脊液等接触,以减轻垫片和水抑制效应。在被扫描区域外部添加八条体积饱和带,以抑制来自可能污染波谱的其他信号,扫描时间为413 s。¹H-MRS数据处理在本院磁共振系统上进行,将采集的波谱原始数据刻入光盘,研究者将光盘数据传送至磁共振后处理工作站,先后进行高斯、指数倍增(Gauss multiply、Exponential multiply)、零填充(zero fill)、傅里叶变换(fourier transformation)、频率位移 校 正(frequency correction)、相 位 校 正(Phase correction)、基线校正(baseline correction)等处理,以Cr峰面积为参照,使用系统自带的Spectroview波谱分析软件计算出NAA/Cr、Cho/Cr以及NAA/(Cho+Cr)值,计算感兴趣区双侧海马头部、体部及尾部的各代谢物数值之和,取其平均值即为各代谢物最终值。
1.2.2 神经认知测试 联合使用MMSE和MoCA进行认知功能评估,两项量表总分均为30分,其中MMSE≥27分为正常,北京版MoCA量表界值≥26分为正常,分数越低表示认知功能越差。两项认知量表测试均由经过两名统一培训的神经外科和康复科医生进行,操作流程和得分记录均按标准化量表测试流程进行。
1.3 统计学处理
采用SPSS20.0统计学软件分析数据,计数资料以率表示,采用χ2检验;符合正态分布的计量资料以(±s)表示,多组间均数比较采用单因素方差分析(ANOVA),不符合正态分布则采用秩和检验;符合正态分布的计量资料相关性分析采用Pearson相关分析,不符合正态分布的计量资料则采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 3组神经认知结果比较
与健康对照组相比,mi-TBI组MMSE及MoCA评分均降低,有显著性差异(P=0.001,P=0.000),mo-TBI组MMSE及MoCA评分均降低,有显著性差异(P=0.008,P=0.000);mo-TBI组的MMSE、MoCA评分均低于mi-TBI组,差异有统计学意义(P=0.000,P=0.014),见表1。
表1 3组神经认知结果比较(分,±s)
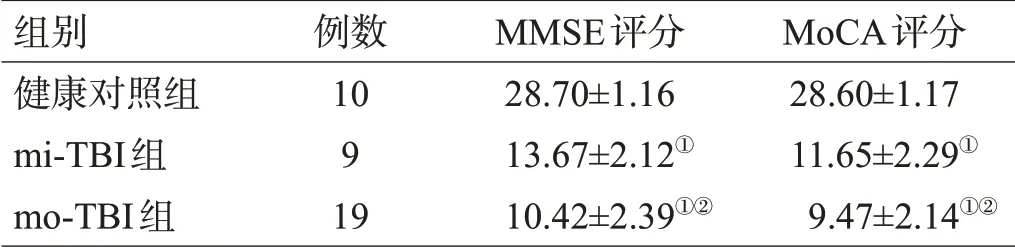
表1 3组神经认知结果比较(分,±s)
注:与健康对照组比较,①P<0.01;与mi-TBI组比较,②P<0.01,③P<0.05
组别健康对照组mi-TBI组mo-TBI组例数10 9 19 MMSE评分28.70±1.16 13.67±2.12①10.42±2.39①②MoCA评分28.60±1.17 11.65±2.29①9.47±2.14①②
2.2 3组¹H-MRS指标比较
与健康对照组相比,mi-TBI组患者双侧海马NAA/Cr值均低于健康对照组(P左=0.004,P右=0.006)、NAA/(Cho+Cr)值均低于健康对照组(P左=0.032,P右=0.021),mo-TBI组的双侧海马NAA/Cr值均低于健康对照组(P左=0.003,P右=0.017)、NAA/(Cho+Cr)值均低于健康对照组(P左=0.040,P右=0.006);mo-TBI组的双侧海马NAA/Cr值均低于mi-TBI组(P左=0.007,P右=0.004)、NAA/(Cho+Cr)值均低于mi-TBI组(P左=0.032,P右=0.027);2组患者右侧海马Cho/Cr值均高于健康对照组(P左=0.014,P右=0.008),左侧海马Cho/Cr值差异无统计学意义(P左=0.458,P右=0.067),见表2。
表2 3组海马¹H-MRS各代谢指标比较(±s)
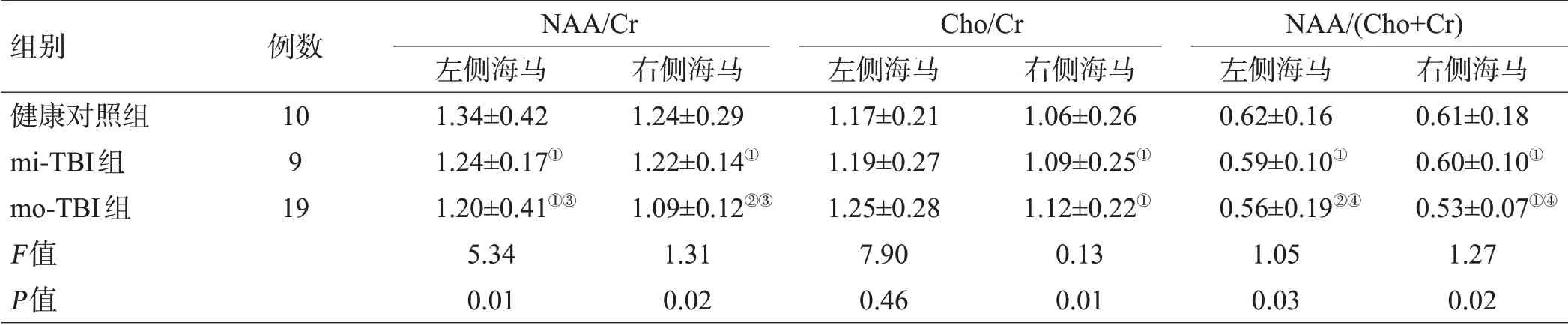
表2 3组海马¹H-MRS各代谢指标比较(±s)
注:与健康对照组比较,①P<0.01,②P<0.05;与mi-TBI组比较,③P<0.01,④P<0.05
组别健康对照组mi-TBI组mo-TBI组F值P值例数10 9 19 NAA/Cr左侧海马1.34±0.42 1.24±0.17①1.20±0.41①③5.34 0.01右侧海马1.24±0.29 1.22±0.14①1.09±0.12②③1.31 0.02 Cho/Cr左侧海马1.17±0.21 1.19±0.27 1.25±0.28 7.90 0.46右侧海马1.06±0.26 1.09±0.25①1.12±0.22①0.13 0.01 NAA/(Cho+Cr)左侧海马0.62±0.16 0.59±0.10①0.56±0.19②④1.05 0.03右侧海马0.61±0.18 0.60±0.10①0.53±0.07①④1.27 0.02
2.3 mi-TBI组认知测试与¹H-MRS指标的相关性
mi-TBI组的MMSE与MoCA评分呈正相关(r=0.773,P=0.015),mi-TBI组的MMSE、MoCA评分均与双侧海马NAA/Cr呈正相关(P<0.05),与左侧海马Cho/Cr无显著相关性(P>0.05),与右侧海马Cho/Cr呈负相关(P<0.05),与双侧海马NAA/(Cho+Cr)均呈正相关(P<0.05),见表3。
2.4 mo-TBI组认知测试与¹H-MRS指标的相关性
mo-TBI组MMSE与MoCA评分呈显著正相关(r=0.724,P=0.000)。mo-TBI组MMSE、MoCA评分均与左侧海马NAA/Cr呈正相关(P<0.05),与右侧海马NAA/Cr呈负相关(P<0.05),与双侧海马Cho/Cr无显著相关性(P>0.05),但与健康对照组相比,Cho/Cr比值有升高的趋势,与双侧海马NAA/(Cho+Cr)均呈正相关(P<0.05),见表4。
3 讨论
TBI是指大脑遭受直接或间接的外部机械力或压力所致的损伤,道路交通意外伤害是其主要致伤因素[4,5]。美国疾病控制与预防中心的报告估计,美国每年约有160万~380万例TBI,其中,70%~90%属于轻、中度TBI[6],认知功能障碍是TBI后最常见的神经功能障碍之一,主要表现为注意力受损、执行功能差及记忆力下降[7]。海马是参与机体认知功能系统的经典结构之一,以影响学习、记忆功能最多见[8]。创伤会导致一系列复杂的细胞损伤、神经炎症、线粒体功能障碍及物质代谢的动态改变,临床研究表明脑部创伤对海马功能和结构的改变可能提高患阿尔兹海默病的风险[9]。在动物实验中也观察到由于重复创伤性脑损伤引起的海马组织改变,Aungst等[10]对大鼠反复进行mTBI后,检测到大鼠海马体内大量神经元细胞丢失,小胶质细胞数量显著增加,神经行为学显示大鼠在水迷宫和新物体识别测试中出现明显的认知障碍。TBI发生后,由于代谢异常通常先于结构的变化发生,传统的计算机断层扫描和结构磁共振序列通常不能检测到损伤后的代谢变化[11],而¹H-MRS以其相对较高的灵敏度成为研究和监测活体组织脑代谢和功能的最受欢迎的光谱技术,根据回波时间长短,可检测到的物质包括NAA、Cho、Cr等在内的十多种代谢产物比值[12]。
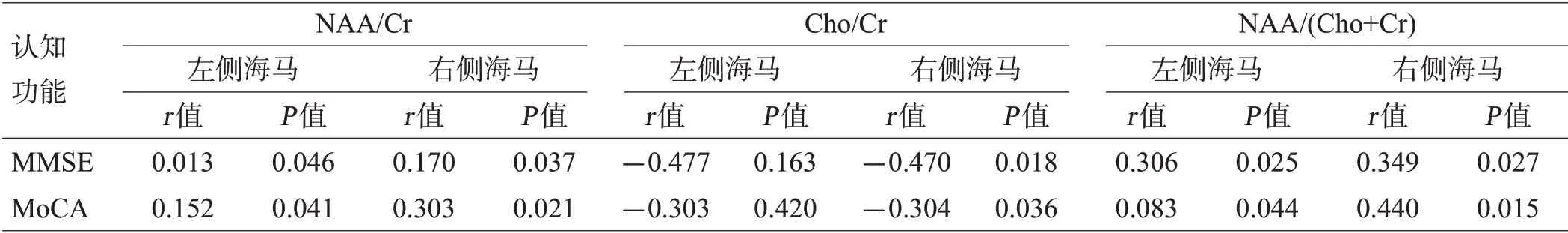
表3 mi-TBI组MMSE、MoCA与¹H-MRS指标的相关性(n=9)
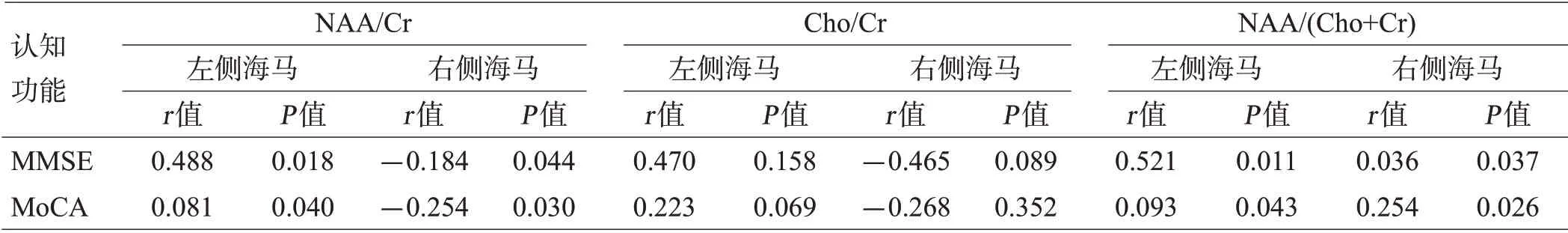
表4 mo-TBI组MMSE、MoCA与¹H-MRS指标的相关性(n=19)
Cr是包括肌酸和磷酸肌酸在内的总肌酸化合物,是整个大脑中细胞能量代谢和线粒体功能的标记,Cr常被认为是恒定的,目前的许多研究没有报告TBI后肌酸的变化,因此Cr经常被用作计算代谢物比率的分母[13]。NAA主要存在于神经元中,是与三磷酸腺苷(adenosine triphosphate,ATP)相关的神经元线粒体活动的标记物,它沿着轴突运输,释放,并被少突胶质细胞吸收,并被分解成乙酸和天冬氨酸,其波谱峰位置在2.02 ppm处[14]。一项对轻度复杂TBI(complicated mTBI,cmTBI)和 非 复 杂TBI(uncomplicated mTBI,umTBI)患者的¹H-MRS研究发现,与对照组相比,cmTBI和umTBI中的NAA/Cr值降低[11]。Babikian等[15]对中重度TBI儿童和健康对照组均进行两次全脑¹H-MRS扫描和认知功能评估,结果表明儿童TBI患者胼胝体和海马区域NAA显著降低和Cho升高,并且这些物质代谢的变化与儿童认知行为测试评分显著相关(P<0.01)。这与本研究结果相似,本研究发现mi-TBI和mo-TBI患者的双侧海马NAA/Cr均显著低于健康对照组,不同损伤程度的海马NAA/Cr值与MMSE、MoCA评分均呈正相关。Fidan等[16]对mTBI大鼠使用质子磁共振波谱检查海马区神经化学变化,发现与假手术组相比,mTBI大鼠海马、胼胝体及大脑皮质均出现NAA/Cr的显著降低,磁共振弥散加权成像(diffusion tensor imaging,DTI)检查结果表明海马区FA值(分数各向异性)下降,TBI后NAA的快速下降可能是由于神经轴突结构损伤和线粒体功能障碍所导致。
3.24 ppm处的Cho峰由游离胆碱、磷酸胆碱和甘油磷酸胆碱形成,可在高浓度时与细胞膜磷脂结合,因此被认为是细胞膜破裂损伤或神经胶质细胞增生的标志物[17]。Lawrence等[18]对18例伤后24 h内的TBI患者及18例健康对照进行¹H-MRS和全脑DTI检查,结果表明轻度组未见明显异常,而伤后24 h内的中度患者后扣带皮质和胼胝体NAA/Cr降低,Cho/Cr显著升高,DTI参数FA值的减少与Cho/Cr呈正相关,Cho/Cr的变化可能是相关脑区轴突膜的损伤所致。Singh等[19]对轻、中度TBI大鼠于伤后第4小时、第1天和第5天进行体外1H-MRS检查发现,大鼠海马区在损伤早期至中期均发现NAA下降,而Cho早期急剧升高,中后期恢复至正常。张训等[20]对脑外伤综合征患者进行前额叶¹H-MRS检查,患者左额叶区NAA/Cr、NAA/(Cho+Cr)显著低于健康对照组,右额叶区Cho/Cr无明显变化。本研究结果表明,与健康对照组相比,mi-TBI组和mo-TBI组的右侧海马Cho/Cr显著升高(P=0.01),左侧海马区差异无统计学意义,而两组患者双侧海马NAA/(Cho+Cr)均低于对照组。由此可见,不同损伤部位及损伤时期也有可能影响最终代谢物检测结果。
临床上对TBI后认知障碍的评定包括神经电生理检查、标准化的神经心理学测试及脑成像方法等[21]。越来越多的研究者们应用1H-MRS和神经心理学测试的方法来共同评价TBI后认知功能。李静等[22]综合分析近年来1H-MRS在不同损伤程度TBI中的应用,并肯定其在TBI后功能缺损的诊断和预后评估中的价值。Sivak等[23]对22例TBI患者和健康对照组进行研究发现,患者组双侧额叶的NAA/Cr值较健康组显著降低,左额叶NAA/Cr与Stroop认知测试呈明显正相关(P<0.01),该研究发现TBI后急性期¹H-MRS代谢产物变化与认知能力下降有关。George等[24]研究发现,mTBI亚急性期患者丘脑和半卵圆中心Cho/Cr与自动化认知功能评分(automated neuropsychological assessment metrics,ANAM)呈正相关。
本研究结果表明,TBI后海马发生代谢紊乱主要表现为NAA/Cr的降低、Cho/Cr的升高以及NAA/(Cho+Cr)的降低,且这些改变与认知评分呈一定的相关性,因此,海马NAA/Cr及NAA/(Cho+Cr)值的测量可能作为TBI后认知障碍的辅助诊断和预后标志物。本研究的不足之处在于未分析不同的原发损伤位置对TBI后认知障碍患者海马代谢的影响,在接下来的研究中,将以此为切入点进行深入的探索。目前有关TBI的基础和临床研究主要集中在理解疾病的生物学过程,开发先进的诊断工具,尽量减少继发性脑损伤和改进治疗指南,还需要进一步的大样本随机对照研究及更优化的试验方案来确定目前研究中的联合MRS和神经认知评估是否可用于监测TBI后认知障碍患者的恢复情况和干预措施的有效性,以更好地理解TBI损伤机制和探索其损伤修复的新方法。
