比较白蛋白结合型紫杉醇联合治疗与单药治疗晚期难治性恶性肿瘤的疗效及安全性
傅薇薇,曹桂侠,周冬梅,姬海宁,周飒飒
新沂市人民医院肿瘤内科,江苏新沂 221400
临床早期恶性肿瘤缺乏典型表现,易被忽视,当患者就诊时多数已是中晚期,临床表现较为严重,同时也失去了治疗的最佳时机,对此临床通常会采用化疗方式,帮助患者提高生存率[1]。白蛋白结合型紫杉醇(albumin-buond paclitaxel;nab-paclitaxel)属于一种新型药物,截止目前,已在我国审批批准上市,在国内外多项研究中,此药物治疗非小细胞肺癌、胃癌、卵巢癌等系列恶性肿瘤疾病有显著疗效[2-3]。为探究其有效性与安全性,该次探究方便选取了2018年1月—2020年6月在该院收治的70例晚期难治性恶性肿瘤患者为研究对象,旨在探究白蛋白结合型紫杉醇联合治疗晚期难治性恶性肿瘤的临床疗效以及安全性,现报道如下。
1 资料与方法
1.1 一般资料
方便选取该院收治的70例晚期难治性恶性肿瘤患者为研究对象,纳入标准:①于该院接受相关诊断、检查和治疗;②肿瘤分期为Ⅲ~Ⅳ期、至少接受一线化疗、预计生存期≥3个月、KPS评分≥60分;③可独立思考、正常沟通;④该次研究经该院伦理委员批准;⑤患者(家属)知晓研究内容且签订知情同意书。经数字随机法分为两组,对照组35例,男19例、女16例;最大年龄76岁,最小年龄45岁,平均(60.5±9.0)岁。试验组35例,男20例、女15例;最大年龄77岁,最小年龄46岁,平均(61.5±9.5)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组单独接受白蛋白结合型紫杉醇(国药准字H20183378;规格:100 mg)静脉滴注,加入100 mL的生理盐水与130 mg/m2,控制滴注时间为30 min,第1、8天给药,21 d为1个化疗周期。
试验组接受联合药物治疗,即白蛋白结合型紫杉醇给药方式同对照组,联合铂类药物:①顺铂注射液(国药准字H20040813)静脉注射,将30 mg药物加入500 mL 0.9%生理盐水,80 mg/m2;②卡铂注射液(国药准字H20020180),卡铂加入5%葡萄糖注射液500 mL,卡铂剂量为:卡铂剂量(mg)=所设定的AUC[mg/(mL·min)]×[肌酐清除率(mL/min)+25],AUC[mg/(mL·min)]取值:常取5~7。
1.3 观察指标与评价标准
①观察记录两组各类型患者治疗有效率、控制率;根据WHO标准评价近期疗效,完全缓解(CR):表明患者肿瘤消失或恢复至正常水平,且时间>1个月。部分缓解(PR):表明患者的肿瘤体积减少≥50%,时间持续>1个月;稳定(NC):表明患者的肿瘤体积减少<50%,1个月内肿瘤增幅<25%;进展(PD):表明患者肿瘤体积不减反增加。疾病控制率=完全缓解(CR)+部分缓解(PR)+稳定(NC)/总例数×100.0%;有效率=完全缓解(CR)+部分缓解(PR)/总例数×100.0%。②观察记录两组患者不良反应发生率,采取化疗急性与亚急性反映分级,分为为0~Ⅳ级,级别越高则不良反应越严重。③观察记录两组患者治疗前后生活质量评分变化,内容包含躯体功能、心理状态、社会交往、自护能力,总分0~100分,每项25分,分数越高,生活质量越佳。
1.4 统计方法
采用SPSS 20.0统计学软件分析数据,计量资料用均数±标准差(±s)表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗有效率、控制率对比
试验组治疗有效率、控制率均高于对照组,差异有统计学意义(P<0.05)。见表1。
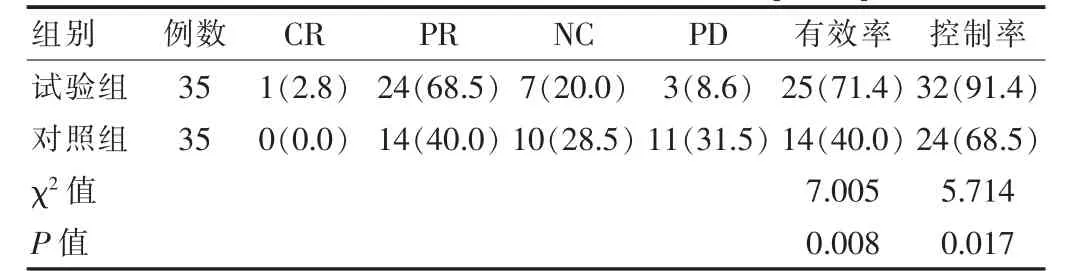
表1 两组患者治疗有效率、控制率对比[n(%)]
2.2 两组患者不良反应发生率对比
不良反应多以骨髓抑制、消化道反应、脱发等为主,试验组不良反应发生率高于对照组,差异有统计学意义(P<0.05)。见表2。
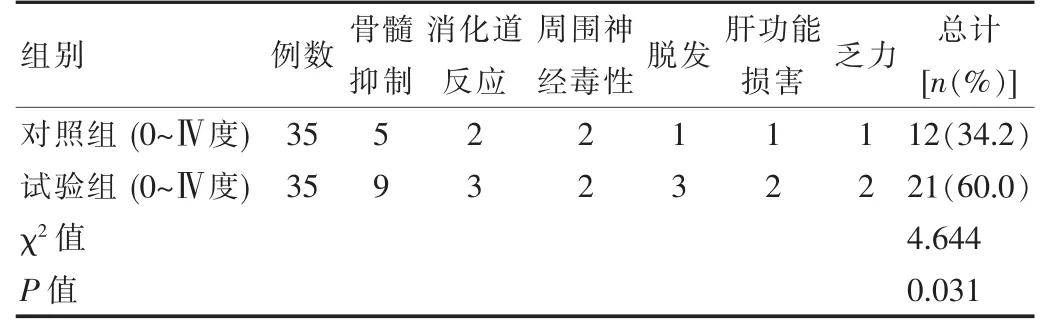
表2 两组患者不良反应发生率对比
2.3 两组患者治疗前后生活质量评分对比
治疗前两组患者生活质量评分对比,差异无统计学意义(P>0.05),治疗后试验组生活质量评分高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者治疗前后生活质量评分对比[(±s),分]

表3 两组患者治疗前后生活质量评分对比[(±s),分]
组别躯体功能心理状态社会交往 自护能力试验组(n=35)治疗前治疗后对照组(n=35)治疗前治疗后16.98±2.41 20.08±1.12 16.88±2.68 20.12±1.14 16.91±2.25 20.03±1.07 16.84±1.76 20.47±1.09 t治疗前组间值P治疗前组间值t治疗后组间值P治疗后组间值16.92±2.33 19.18±1.21 0.106 0.458 3.229 0.002 16.86±2.69 18.86±1.19 0.031 0.488 4.523<0.001 16.93±2.26 18.95±1.17 0.037 0.485 4.030<0.001 16.86±1.78 19.14±1.11 0.047 0.481 5.058<0.001
3 讨论
临床中紫杉醇属于恶性肿瘤化疗中常用化疗药物,属于传统型药物,在辅助化疗治疗的过程中,患者会出现骨髓抑制、脱发等不良反应等弊端[4-5]。而白蛋白结合紫杉醇属于临床新型药物,即是由一个个的白蛋白结合紫杉醇纳米微粒所构成,将人血清白蛋白作为载体,之后再将紫杉醇与人血白蛋白利用高压振动技术制定纳米微粒冻干剂,而这些微粒的大小相当于人体红细胞的1/100,外层被白蛋白包裹,且内核不溶于水[6-7]。该药物优势避免了因助溶剂而产生不良反应,因而最大程度降低不良反应的发生[8-9]。在应用于治疗难治性恶性肿瘤中,药物通过患者细胞膜上的白蛋白受体与Gp60相结合,将细胞膜上的小窝蛋白激活,接着利用紫杉醇可穿透血管内皮细胞的作用,将药物作用于肿瘤细胞中,使得内部局部药物浓度有效增强,继而使药物杀伤肿瘤细胞的能力增强[10]。在人体生长过程中,肿瘤细胞可吸取足够营养,分泌SPARC蛋白,吸取细胞间质中的蛋白质,通过此药物纳米微粒特点吸附在肿瘤细胞上将细胞毒物释放,从而起到将肿瘤细胞杀死,达到治疗目的[11]。
通过临床研究证实,白蛋白结合型紫杉醇联合治疗在多种晚期恶性肿瘤的治疗中都有较佳疗效,结合该次研究数据可发现,试验组联合治疗控制率为91.4%高于对照组68.5%(P<0.05),对照组不良反应发生率为34.2%低于试验组60.0%,生活质量评分略低于试验组,试验组总有效率为71.4%,高于对照组40.0%,这一结果与李文文等人[12]的研究数据结果一致,其给予联合治疗的试验组治疗总有效率为51.7%高于单药治疗对照组治疗有效率37.1%。由此可知白蛋白结合型紫杉醇可通过不同类型病症相应辅助其他类药物,进一步增加药物耐受性。
综上所述,与白蛋白结合型紫杉醇单药治疗比较,联合治疗晚期难治性恶性肿瘤临床效果显著,疾病控制率较佳,有效率较高,同时可提高患者生活质量。

