盐穗木根际产ACC脱氨酶耐盐菌株的筛选及鉴定
王伟楠,兰智勇,喻文丽,孙庆培,李佩琪,樊永红
(新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046)
盐穗木(Halostachys caspica)是藜科盐穗木属的一类盐生、旱生多汁半灌木,对盐分适应性极强,贮水组织发达,是荒漠、半荒漠的主要植物之一[1]。
1-氨基环丙烷-1-羧酸(ACC)是乙烯生物合成的直接前体。ACC脱氨酶可以将根部的ACC分解成α-丁酮酸和氨,降低了在高盐碱度[2-4]、旱[5-6]、水涝[7]、重金属污染[8]等非生物胁迫条件下植物所产生乙烯的含量。因此,用产ACC脱氨酶的植物根际促生菌(PGPR)接种可促进在胁迫条件下的植物生长。
目前,国内外关于产ACC脱氨酶细菌的研究,主要集中在产ACC脱氨酶菌株的筛选及鉴定[9-11],产ACC脱氨酶微生物对促进植物在逆境胁迫(盐碱胁迫、干旱胁迫、重金属污染等)下生长的能力和定殖情况[2-8],以及控制ACC脱氨酶合成的基因及相关转基因技术的应用[12]等方面。独特的自然地理环境,使新疆成为了典型的干旱地区和盐碱地的重发区。如何更有效地利用并治理盐碱地,已成为新疆农业发展的重要任务。本研究从新疆盐碱地植物根际筛选产ACC脱氨酶的耐盐菌株,目的在于将ACC脱氨酶活性以及耐盐性能均较强的菌株,作为植物根际促生菌接种到植物根际,从而提高植物在盐胁迫下的生存能力,为丰富产ACC脱氨酶的植物根际促生菌的菌种资源及后续制作生物菌肥奠定基础。
1 材料与方法
1.1 材料
1.1.1 土壤样品
土壤样品采自新疆五家渠市103团盐碱地的盐穗木根际,装于无菌自封袋中,保存于4℃冰箱内待用,一部分土样过筛去杂质后送至新疆农科院测试中心进行测定土壤理化性质,另一部分用于筛菌。
1.1.2 主要试剂
本实验所用的TSB培养基、PAF培养基、DF培养基、ADF培养基、LB培养基,具体配方参考Penrose等[13]的配方。
1.2 方法
1.2.1 产ACC脱氨酶菌株的初筛
本实验基于Penrose等[13]和张国壮等[14]的方法上稍作了改变,称取2 g土样于100 mL PAF培养基中,30℃ 180 r/min培养24 h后,取1 mL加入50 mL DF液体培养基中,同样条件培养24 h,再取1 mL上述培养液,加入50 mL ADF液体培养基中,30℃ 180 r/min培养48 h,梯度稀释后,每个梯度各取200μL,涂布于ADF平板上,30℃培养48~72 h后观察结果,选取不同菌落形态的菌株进行编号并划线纯化,记录纯化后菌株的菌落形态。
保存时,将纯化好的菌株用ADF培养液30℃180 r/min培养至浑浊,取1 mL菌液加入1 mL的20%无菌甘油中混匀至冻存管中,于-80℃保存。
1.2.2 ACC脱氨酶活性测定
ACC脱氨酶可以将ACC分解成α-丁酮酸和氨,本次酶活测定以产物α-丁酮酸作为检测指标,用2,4-二硝基苯肼作为染料,来测定菌液中α-丁酮酸的含量,从而说明菌株的ACC脱氨酶活力,具体步骤参考Penrose等[13]和Glick等[15]的方法。蛋白质含量的测定选择考马斯亮蓝法,该实验重复3次。
酶活的计算方式以每分钟产出1μmol α-丁酮酸的量为1酶活力单位(U),计算方式参考Bal等[16]和姬文秀等[17]的方法。
1.2.3 耐盐菌株的筛选
将ADF固体培养基分别调至不同的盐(NaCl)浓度,再将所筛菌株通过划线的方式接到这些平板上,30℃培养3~5 d后观察记录其生长情况。盐(NaCl)浓度选择0%、4%、8%、12%和16%,该实验重复3次。
选择耐盐能力较好且ACC脱氨酶活性高的菌株进行后续实验。
1.2.4 菌株形态观察
对所选菌株进行革兰氏染色和扫描电镜形态观察。
1.2.5 生理生化实验
用所选的菌株做生理生化鉴定实验。所采用的方法参照《微生物学实验》[18]和《常见细菌系统鉴定手册》[19]上有关细菌的生理生化测定部分。本次实验选择了石蕊牛奶实验、葡萄糖、乳糖、蔗糖的糖酵解实验、明胶水解实验、淀粉水解实验、油脂水解实验和过氧化氢酶实验这8项,将这8项实验结果与细菌伯杰氏手册上的描述进行比对,初步鉴定所选菌株的科属。
1.2.6 Biolog鉴定
Biolog检测是通过检测菌株在一定时间内对不同碳氮源的利用程度,来鉴定菌株种属关系的一种方法。Biolog专用的微孔板上,除第一个孔是未加任何碳源的蒸馏水外,其他95个孔中加入了95种单一碳氮源和四唑染料。微生物利用了孔内碳氮源,四唑染料就会变成紫色。颜色的深浅说明了碳氮源被利用的程度。不同种类的微生物有不同种类的处理液和微孔板。
将所选菌株划线接种至牛肉膏蛋白胨培养基上,37℃培养12~18 h后,挑单菌落划线接种在BUG培养基上,37℃下培养12~24 h。在浊度仪上检验接种液的浊度,将接种液浊度调至100后,用Biolog专用的无菌棉签轻轻蘸取单菌落,接入接种液中,摇匀。再检测其浊度,浊度控制在95左右即可。将处理液倒在专用的无菌小槽中,用加样枪吸取小槽中的接种液,加到GenIII板的每一个孔中,记录好时间,37℃培养24 h后,进行检测。系统会根据所测微孔板每个孔的OD值,与系统内数据进行比对,从而提供匹配度最高的结果。
1.2.7 16S rDNA测序及系统发育分析
将菌株样品送至上海生物工程有限公司进行16S rDNA测序,对测序结果进行BLAST比对,并从Ezbiocloud上找到相应的模式菌株的16S rDNA序列,之后利用MEGA7软件构建系统发育树,确定其种属关系。
2 结果与分析
2.1 土壤理化性质
从表1中可以看出,所选的3份土样均是碱性土壤,pH均在9左右,且含盐量较高,属于典型的盐碱地土壤。

表1 土样理化测试结果
2.2 ACC脱氨酶活性测定
α-丁酮酸标曲的回归方程为y=0.6043x+0.0175,相关系数为0.9949,考马斯亮蓝标准曲线的回归方程为y=0.6361x+0.0047,相关系数为0.9973。经3次 测 量(图1),菌 株W1、W2、W3、W4、W5、W6、W7、W8、W9和W10的酶比活力依次为3.611、4.921、12.430、2.957、9.412、3.642、2.301、7.671、13.013和1.958 U/mg。其 中W3、W5、W8、W9这4株菌株的ACC脱氨酶活性较高,W9的酶比活力最高,为13.013 U/mg。
2.3 菌株耐盐碱实验结果
综合3次实验结果(表2),菌株W1、W5、W8、W9的耐盐能力最强,在12%的盐浓度下仍能生长,部分实验结果见图2。

图1 各菌株ACC脱氨酶活性测定结果

表2 菌株耐盐实验结果
综合菌株的ACC脱氨酶活性以及其耐盐能力,选择两方面能力都最为突出的W5、W8、W9作为后续实验的供试菌株。

图2 菌株耐盐实验部分实验结果
2.4 菌种鉴定
2.4.1 菌落形态及显微观察结果
从图3~图5可以看出,W5和W8菌落呈白色不透明圆形凸起,为革兰氏阳性的杆菌,W9菌落呈无色透明圆形凸起,为革兰氏阴性的杆菌。
2.4.2 生理生化实验结果
由表3可知,3株菌均能使明胶液化,有过氧化氢酶活性,可以利用葡萄糖,且都能使石蕊牛奶颜色改变并产生凝乳反应。W5和W8可以利用蔗糖,但W9不能。

图4 W5、W8、W9革兰氏染色结果

图5 W5、W8、W9扫描电镜结果照片

表3 生理生化实验结果
2.4.3 Biolog鉴定结果
W5在培养48 h后,检出可利用糊精、N-乙酰-D-葡萄糖胺、L-果糖、乳酸钠、甘油、α-氨基乙酰-L-脯氨酸、果胶、葡糖醛酰胺、L-乳酸和L-苹果酸等20多种碳氮源,经系统比对得出最匹配的结果为乳酪短杆菌(Brevibacterium casei),可能性(PROB)为0.704,相似性(SIM)为0.704;W8培养48 h后,检测出可利用D-麦芽糖、蔗糖、D-松二糖、N-乙酰-D-半乳糖胺、L-果糖、乳酸钠、α-氨基乙酰-L-脯氨酸、L-丙氨酸和β-羟基苯乙酸等20多种碳氮源,经系统比对得出最匹配的结果也是乳酪短杆菌(Brevibacterium casei),可能性(PROB)为0.864,相似性(SIM)为0.576;W9经48 h的培养,检测出可利用D-麦芽糖、D-海藻糖、D-纤维二糖、龙胆二糖、蔗糖、D-松二糖、棉子糖、α-D-乳糖、蜜二糖、β-甲酰-D-葡萄糖苷、D-水杨苷、α-D-葡萄糖、D-果糖、D-半乳糖、L-鼠李糖和D-甘露醇等30余种碳氮源,系统给出的最匹配结果为放射型根瘤菌(Rhizobium radiobacter),可能性(PROB)为0.562,相似性(SIM)为0.562。
2.4.4 16S rDNA同源序列比对和系统发育分析
如表4、图6和图7所示,经BLAST后W5和W8匹配度最高的种属均为短杆菌属,W5和W8的测序结果经过与乳酪短杆菌标准菌株和其他一些短杆菌属的序列进行比对后,在系统发育树上被分在同一分支,说明W5和W8均为短杆菌属的乳酪短杆菌(Brevibacterium casei)。W9则为根瘤菌属,亲缘关系最近的是普沙根瘤菌(Rhizobiumpusense)。

表4 三株菌的16S rDNA基本信息与核酸序列比对(BlastN)结果
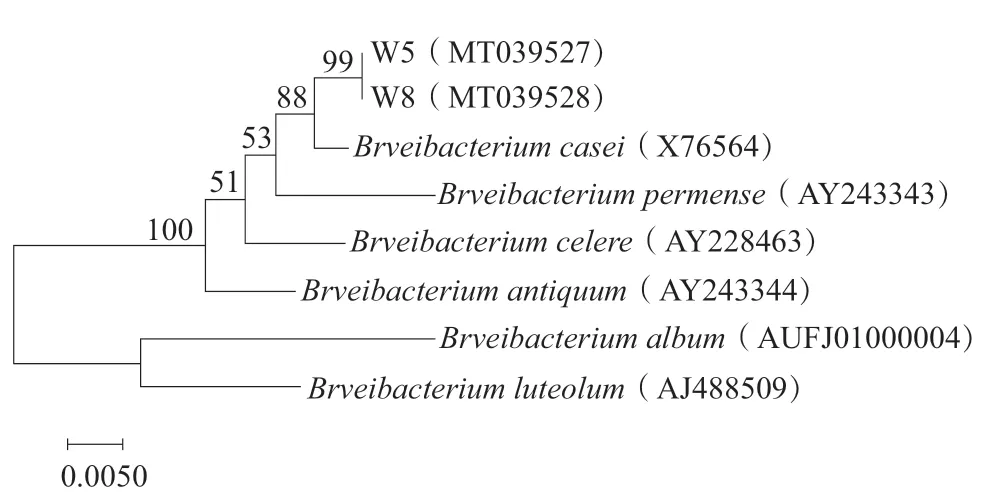
图6 菌株W5和W8基于16S rDNA构建的系统进化树

图7 菌株W9基于16S rDNA构建的系统进化树
3 讨论
本次实验所得的产ACC脱氨酶菌株,酶比活力在2.3~13.1 U/mg之间,最高为13.013 U/mg。费诗萱等[9]从红枣根际筛出的产ACC脱氨酶菌株,按本文所用的计算方法,酶比活力在0.5~7.3 U/mg之间,最高为7.218 U/mg,与本实验相比,都是从植物根际筛得的菌株,测酶活的方法和计算方式也相近,但酶活力的区间和最大值均比本实验所得的结果要低一些,这可能是由于本实验所用的土样性质以及植物本身的抗胁迫能力都有不同;姬文秀等[17]从人参中筛出的产ACC脱氨酶内生细菌的酶比活力在0.2~10 U/mg之间,最高为9.728 U/mg,与本次实验的结果相比,本次实验所用方法和计算方式与之相同,酶活力的区间以及最大值稍低于本次实验,可能是由于菌株的来源不同;代金霞等[20]从柠条根际筛出的产ACC脱氨酶菌株,酶活区间在0.33~2.43 U/mg之间,最高酶活为2.427 U/mg,与本次实验相比,都是从荒漠植物根际土壤中筛得的菌株,所用方法和计算方式也相同,但本次实验所得的结果要明显更高一些,可能与土壤性质以及植物本身抗胁迫能力的差异有关。
在细菌鉴定过程中,本次实验结合了传统鉴定方法,基于碳氮源利用的Biolog检测手段和目前广泛使用的通过16S rDNA鉴定方法,3种方法相互佐证,各有特点。传统方法操作繁琐,且生理生化实验项目有限,存在一定误差;Biolog由于数据库有限,也会存在一定误差;16S rDNA鉴定方法是现代生物技术发展的结果,数据库丰富,所以所得结果也较为可靠。本次实验的W9菌株Biolog检测结果与16S rDNA鉴定的结果在种水平上并不一致,最终以16S rDNA鉴定的结果为准。Biolog检测结果不一致,可能是由于在接近菌的生长对数期时,Biolog并未给出鉴定结果,而继续培养至48 h后过了菌株的对数期,或者其数据库中没有普沙根瘤菌的数据这两方面原因导致。
本次实验所筛出的W5和W8菌株虽都是乳酪短杆菌,但在酶活和菌体形态,以及碳氮源利用等方面还是有一定程度的不同。在产ACC脱氨酶细菌的文献中也少有短杆菌属的菌株报道,这一结果也进一步丰富了产ACC脱氨酶细菌的菌种资源。乳酪短杆菌有能富集重金属离子[21],产腈水解酶[22],合成银和金的纳米颗粒[23]等报道。根瘤菌属也属于常见的产ACC脱氨酶的菌属,有根瘤菌的ACC脱氨酶基因能促进其结瘤[24-25]的报道。普沙根瘤菌也有作为植物根际促生菌,能够富集镉污染土壤中的镉[26],以及作为油田增油细菌[27]的报道。后续也可以继续进行对这3株产ACC脱氨酶的耐盐碱菌株的促生能力、接种效应,以及在植物根际定殖情况等方面研究。
4 结论
本文通过ADF培养基,以ACC为唯一氮源,从3种不同的盐穗木根际土样中,筛选出10株菌落形态不同的产ACC脱氨酶的菌株,通过对其ACC脱氨酶活性的测定和耐盐实验得出W5、W8和W9这3株菌株有较高的ACC脱氨酶活性,W1、W5、W8和W9这4株菌株均能在盐(NaCl)浓度12%下生长,有很好的耐盐能力,故选择W5、W8和W9这3株进行了后续的实验。经菌落形态和显微观察、生理生化实验、Biolog检测、16S rDNA测序、BLAST比对和系统发育分析后,最终鉴定W5和W8为短杆菌属乳酪短杆菌(Brevibacterium casei),W9为普沙根瘤菌(Rhizobium pusense)。

