一测多评法测定黄芪中异黄酮及苷类成分
郑云枫,李 洋,段伟萍,赵晨光,孙 捷,李存玉,彭国平*
1.南京中医药大学药学院,江苏 南京 210023
2.江苏省中药资源产业化过程协同创新中心,江苏 南京 210023
黄芪为豆科植物蒙古黄芪Astragalus membranaceus(Fisch.) Bge.var.mongholicus(Bge.)Hsiao或膜荚黄芪Astragalus membranaceus(Fisch.)Bge.的干燥根[1],具有补气升阳、固表止汗之功效。现代研究表明,黄芪中含有丰富的异黄酮类活性成分,具有抗氧化[2-3]、抗炎[4-5]、免疫调节[6-7]、抗衰老[8]等活性,是黄芪中主要活性成分类型之一,现行多个国家及地区的药典亦把异黄酮成分作为黄芪药材质量评价的指标。《中国药典》2015年版黄芪药材及饮片项下将毛蕊异黄酮7-O-β-D-葡萄糖苷(calycosin-7-O-glycoside,CYG)作为异黄酮类成分含量测定的指标[1];《美国药典》2017年版将CYG、芒柄花苷(formononetin-7-Oglycoside,FMG)、毛蕊异黄酮(calycosin,CY)及芒柄花素(formononetin,FM)4个成分作为黄芪药材项下异黄酮类含量测定指标,并规定了总含量限度不得低于0.03%[9]。值得注意的是,黄芪药材及饮片中除了以上几种常见的异黄酮成分外,亦含有丙二酰毛蕊异黄酮苷(calycosin-7-Oglycoside-6′′-O-malonate,CYM)、丙二酰芒柄花苷(formononetin-7-O-glycoside-6′-O-malonate,FMM)等含量高,且具有生理活性的丙二酰基异黄酮苷成分[10-11]。因此,仅以CYG等单一或几个异黄酮成分作为含量测定指标,尚不能全面反映黄芪的内在质量,应综合考虑丙二酰异黄酮苷成分修订黄芪质量控制方法。
已有文献对黄芪中异黄酮类成分开展了质量控制研究,采用HPLC-UV、LC-MS/MS等建立了以异黄酮单一或多指标的定性/定量检测方法[12-14]。研究发现,虽然药材中CYM含量较高,但它的结构并不十分稳定,在较高温度条件下提取或长期存放过程中容易脱乙酰基转化成相应的异黄酮苷,由于对照品制备困难,因此在已有的研究中往往采用长时间回流转化法[1]或峰面积归一化法[15-16]等进行分析,方法的效率及耐用性不高,含量测定结果的准确度亦受影响,因而其质量控制方法仍有待进一步的完善。
本研究在现有文献以及前期黄芪丙二酰基异黄酮苷化学成分研究的基础上,首次以CYG为内参物,从供试品溶液制备、色谱条件优化、方法学考察及相对校正因子等多个方面,建立同步测定黄芪药材及饮片中CYM、FMM、CYG、FMG、CY及FM6种异黄酮类成分的一测多评(quantitative determination analysis multi-component by a single-marker,QAMS)质量控制方法。该法检测成本低,耐用性强、重现性好、准确度高,可以为黄芪药材及饮片质量标准的制订或修订提供技术依据,并可为黄芪的品质评价、生产加工以及资源开发等研究提供支撑。
1 仪器与试剂
1.1 仪器
Waters 2695型高效液相色谱仪,2998 PDA检测器,Empower色谱工作站(美国Waters公司);Agilent 1100高效液相色谱仪,VWD紫外检测器,Agilent Chemstation色谱工作站(美国Agilent公司);Thermo U 3000高效液相色谱仪,DAD检测器,Chromeleon TM 7色谱工作站(Thermo公司);色谱柱(250 mm×4.6 mm,5 μm):Waters Symmetry C18、Thermo Hypersil ODS、Vensil XBP C18、Phenomenex luna C18,Kromasil C18、Hedra C18、Agilent Eclipse XDB C18、Boston Green ODS;MS-105DU电子天平(十万分之一,梅特勒-托利多仪器有限公司);KH-500DB数控超声仪(昆山禾创超声仪器有限公司)。
1.2 材料与试剂
CYG(批号111920-201606,质量分数97.6%)、FM(批号111703-201504,质量分数≥98%)均购于中国食品药品检定研究院。FMG(批号JBZ-0778,质量分数≥98%),CY(批号JBZ-0786,质量分数≥98%)均购于南京金益柏生物科技有限公司。CYM、FMM对照品均由实验室自制[17],经HPLC分析,质量分数≥98%;乙腈(色谱纯,美国Tedia公司);甲醇(色谱纯,江苏汉邦科技有限公司),甲酸(色谱纯,Merck公司);超纯水(Milli-Q超纯水系统制备)。
16批黄芪药材采集于山西大同浑源县、内蒙古包头固阳县、内蒙古通辽开鲁县、陕西榆林子洲县、甘肃定西岷县药材种植基地,3批黄芪饮片购自安徽亳州药材市场及南京药店。黄芪药材由南京中医药大学中药鉴定教授刘训红教授鉴定为豆科植物蒙古黄芪Astragalus membranaceus(Fisch.) Bge.var.mongholicus(Bge.) Hsiao或膜荚黄芪A.membranaceus(Fisch.) Bge.的干燥根,信息见表1。

表1 黄芪药材及饮片样品采集信息Table 1 Specific information of collected Astragali Radix and decoction pieces
2 方法与结果
2.1 色谱条件
Agilent 1100高效液相色谱仪;Waters Symmetry C18(250 mm×4.6 mm,5 μm)色谱柱;流动相为乙腈(A)和0.2%甲酸(B);梯度洗脱:0~25 min,15%~32% A;25~50 min,32%~62% A;检测波长260 nm;体积流量1.0 mL/min;柱温30 ℃,进样量10 μL。在当前色谱条件下,各色谱峰分离度>1.5,拖尾因子≈1.00,见图1。
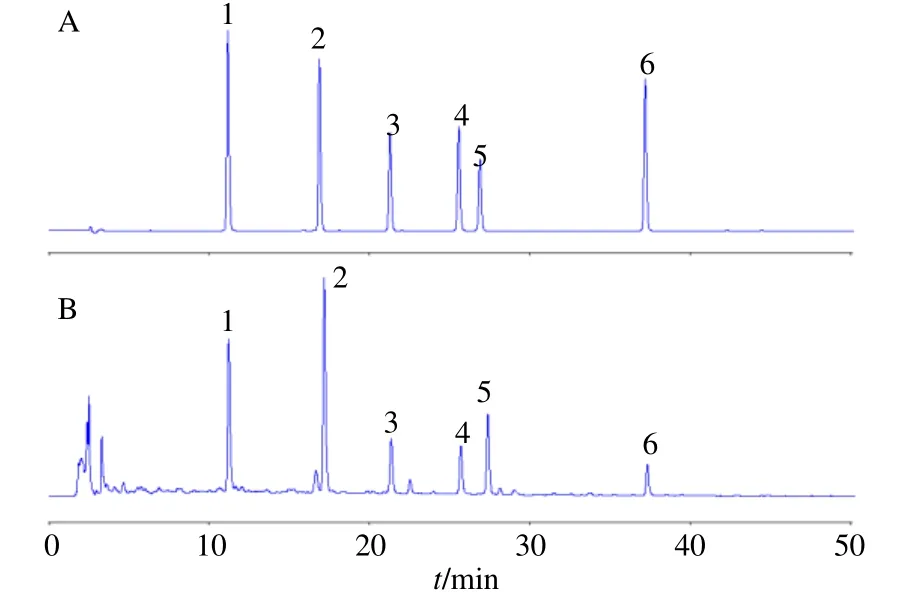
图1 黄芪混合对照品 (A) 和样品 (B) HPLC图Fig.1 HPLC chromatograms of mixed references (A) and Astragali Radix samples (B)
2.2 对照品溶液的制备
分别精密称取CYG、CYM、FMG、FMM、CY及FM对照品适量,置10 mL量瓶中,加甲醇(含0.1%甲酸)溶解并定容至刻度,配制成质量浓度分别为209、176、96、87、76、95 μg/mL的混合溶液, 即得1号混合对照品溶液。将1号混合对照品溶液依次稀释2.5、5、10、25、50、100倍,制备得2~7号混合对照品溶液。
2.3 供试品溶液的制备
黄芪异黄酮含量测定提取方法常采用甲醇回流提取或超声提取,因此对2种提取方法及提取时间进行了考察:取本品粉末(过四号筛)约1.0 g,精密称定,置锥形瓶中,精密加入甲醇(含0.1%甲酸)50 mL,称定质量,分别按回流提取和超声(功率250 W,频率 40 kHz)2种方法分别提取0.5、1、2、4、6、8 h,取出,放冷,再称定质量,用甲醇补足减失质量,摇匀,滤过,精密量取续滤液25 mL,40 ℃条件下回收溶剂至干,残渣加甲醇(含0.1%甲酸)溶解,转移至5 mL量瓶中,加甲醇(含0.1%甲酸)至刻度,摇匀,滤过,取续滤液进行HPLC分析,以6个成分的峰面积为指标,对不同提取方法及时间条件下的提取效果进行比较,见图2。

图2 甲醇回流提取 (A) 和超声提取 (B) 对黄芪供试品液中6个异黄酮及苷类成分峰面积变化的影响Fig 2 Effects of methanol reflux extraction (A) and ultrasonic extraction (B) on peak area of six isoflavones and glycosides in Astragali Radix sample solution
结果显示,在回流提取条件下随着提取时间的延长,2个丙二酰异黄酮苷CYM和FMM的峰面积明显下降,2个相应的异黄酮苷CYG和FMG的峰面积显著上升,但异黄酮苷元CY和FM的峰面积基本没有变化,推测应为丙二酰异黄酮苷在加热条件下转化为相应黄酮苷所致,与文献报道相一致[13];而在超声提取条件下,6个异黄酮及苷类成分在8 h提取过程中峰面积的变化均不十分明显。因此,选择采用甲醇超声的方式提取样品,并进一步针对甲醇体积分数(20%、40%、60%、80%、100%),溶剂体积(25、50、75、100 mL)以及提取时间(15、30、45、60 min)进行了优选,结果显示,采用100%甲醇为提取溶剂时6个异黄酮及苷类成分提取率相对较高,而溶剂提取体积及提取时间对各成分提取效果影响不明显,最终确定了供试品溶液的制备方法,即取本品粉末(过四号筛)约1.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇(含0.1%甲酸)50 mL,称定质量,超声(功率250 W,频率40 kHz)处理0.5 h,取出,再称定质量,用甲醇补足减失质量,摇匀,滤过,精密量取续滤液25 mL,40 ℃条件下回收溶剂至干,残渣加甲醇(含0.1%甲酸)溶解,转移至5 mL量瓶中,加甲醇(含0.1%甲酸)至刻度,摇匀,滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 线性范围、检测限与定量限 将“2.2”项下制得的混合对照品溶液,每个浓度进样2针,分别测定6个异黄酮类成分峰面积,以每个成分质量浓度为横坐标(X),平均峰面积为纵坐标(Y)进行线性回归处理,得到6个成分的回归方程、相关系数及线性范围。进一步以7号对照品液逐级稀释、测定,确定各成分的检测限及定量限,结果显示,6种异黄酮类成分在相应浓度范围内,线性关系良好,并具有较高的灵敏度,见表2。

表2 6种异黄酮成分的回归方程、线性范围和检测限、定量限Table 2 Regression equations,linear range,limit of detection and limit of quantitation of six isoflavoniod components
2.4.2 精密度试验 取同一混合对照品溶液,按“2.1”项下色谱条件进行分析,连续进样6次,测得峰面积,计算质量分数RSD。结果CYG、CYM、FMG、FMM、CY及FM峰面积RSD分别为1.85%、0.77%、1.69%、1.13%、0.97%及0.88%。
取同一黄芪样品,依“2.1”项与“2.3”项下方法制备与分析,测得峰面积,计算质量分数RSD。结果CYG、CYM、FMG、FMM、CY及FM峰面积RSD分别为1.47%、0.68%、1.05%、1.37%、0.55%、1.15%。表明仪器的精密度良好。
2.4.3 稳定性试验 取同一混合对照品溶液,在0、2、4、6、8、10、12 h测得峰面积,计算质量分数RSD。结果CYG、CYM、FMG、FMM、CY及FM峰面积RSD分别为2.37%、1.00%、2.53%、1.66%、1.85%及1.66%。
取同一黄芪药材样品,依法制备与分析,在0、2、4、6、8、10、12 h测得峰面积,结果CYG、CYM、FMG、FMM、CY及FM质量分数RSD分别为1.58%、1.28%、1.14%、1.76%、1.20%、0.99%。表明供试品溶液在12 h内稳定性良好。
2.4.4 重复性试验 取同一批次(SX-3)黄芪药材样品,平行6份,依“2.3”项下方法制备供试品溶液,依法测定,并计算各成分的平均质量分数及RSD,结果测得该批次黄芪药材样品的CYG、CYM、FMG、FMM、CY及FM的质量分数分别为0.474、0.671、0.163、0.124、0.263、0.059 mg/g,RSD分别为0.93%、0.87%、1.21%、1.82、1.16%,0.15%。表明方法的重复性良好。
2.4.5 加样回收率试验 取已测定的黄芪药材(SX-3)粉末(过四号筛)约0.5 g,精密称定,平行6份,分别按药材含量-对照品(1∶1)加入一定量的对照品溶液,按“2.3”项下方法制备供试品溶液,依法测定,计算加样回收率,CYG、CYM、FMG、FMM、CY及FM的加样回收率分别为100.2%、97.4%、98.9%、101.5%、97.4%、98.2%,RSD分别为1.28%、1.07%、3.50%、1.54%、1.52%、2.93%。
2.5 相对校正因子 (fs/i) 的确定
2.5.1 相对校正因子的计算 按“2.2”项下方法制备1~6号混合对照品溶液,依法测定6个成分的峰面积,以CYG为参照物,分别采用多点法和斜率法[18]计算CYG、FMG、CY、FMM及FM相对于CYG的fCYM/CYG、fFMG/CYG、fCY/CYG、fFMM/CYG、fFM/CYG,结果见表3、4。
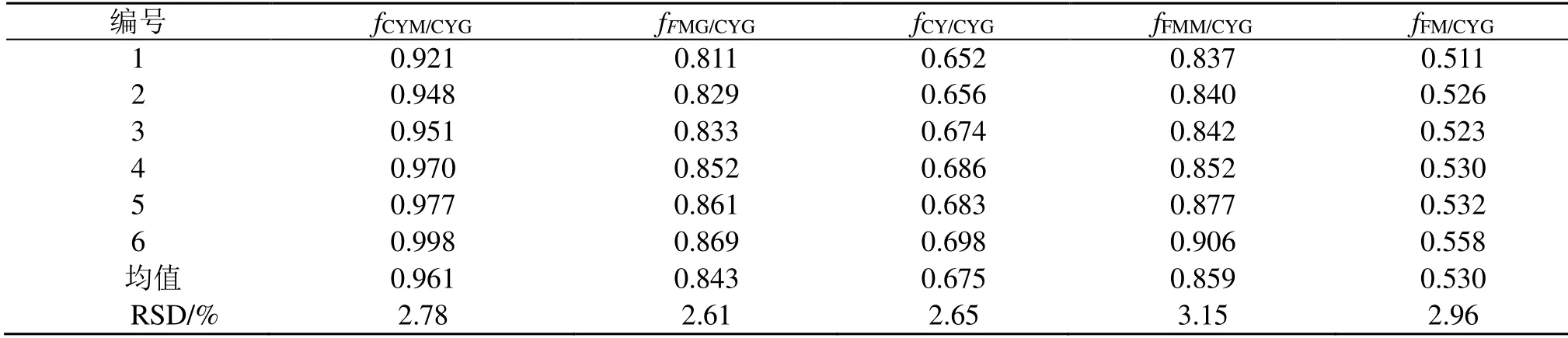
表3 多点法测定的fs/iTable 3 Relative correction factors (RCFs) calculated by multi-point method

表4 斜率法测定的fs/i (n=6)Table 4 Relative correction factors (RCFs) calculated by slope method (n=6)
结果显示,采用多点法计算获得的fCYM/CYG、fFMG/CYG、fCY/CYG、fFMM/CYG、fFM/CYG分别为0.961、0.843、0.675、0.859及0.530,与斜率法计算的结果没有显著性差异,两者的相对误差分别为−2.73%、−1.11%、−0.65%、−2.93%、−2.24%,均小于3.0%,表明两者fs/i均可采用。
2.5.2 不同高效液相色谱仪及色谱柱测得的相对校正因子比较 采用Agilent 1100,Waters 2695,Thermo U3000 3种不同高效液相色谱仪,以Thermo hypersil C18、Waters symmetry C18、Agela Vensil XBP C183种不同品牌的色谱柱,分别测定并计算各成分与CYG的fs/i,结果显示3种品牌色谱柱在不同HPLC仪上所测定的fs/i的RSD<3.0%,表明黄芪中6个异黄酮成分在不同高效液相色谱仪及色谱柱上的耐用性较好,见表5。

表5 不同色谱柱在不同高效液相色谱仪条件下测得的fs/iTable 5 RCFs measured by three C18 columns on different HPLC instruments
2.5.3 不同柱温对fs/i的影响 采用Aglient 1100色谱仪和Thermo hypersil C18色谱柱,分别测定并计算不同柱温条件下(25、30、35 ℃)各成分与CYG的fs/i,计算RSD。结果显示,fCYM/CYG、fFMG/CYG、fCY/CYG、fFMM/CYG、fFM/CYG在不同温度条件下的RSD分别为0.15%、0.34%、0.46%、0.32%、0.43%,表明相对校正因子在温度25~35 ℃的耐受性良好。
2.5.4 不同体积流量对fs/i的影响 采用Aglient 1100色谱仪和Waters symmetry C18色谱柱,分别测定了不同体积流量条件下(0.9、1.0、1.1 mL/min)各成分与CYG的fs/i,结果显示,fCYM/CYG、fFMG/CYG、fCY/CYG、fFMM/CYG、fFM/CYG在不同体积流量下的RSD分别为0.23%、0.64%、0.29%、0.58%、0.73%,表明fs/i在体积流量0.9~1.1 mL/min的耐受性良好。
2.5.5 待测成分色谱峰的定位 中药化学成分复杂,色谱图中除了待测成分峰外还存在其它色谱峰,因此待测成分色谱峰的准确定位是实现QAMS的前提。对黄芪样品中6个待测组分的保留时间进行了考察,采用与参照物的“保留时间差法”和“相对保留时间法”进行了分析。结果显示,不同仪器和不同色谱柱对待测成分与参照物保留时间绝对差值的影响较大,RSD超过10%;相对而言,待测成分与参照物相对保留时间的差异较小(表6),CYM、FMG、FMM、CY及FM相对于CYG的相对保留时间(RT)均值分别为1.497、1.823、2.200、2.311、3.202,RSD≤3.85%,表明采用待测组分与内参物相对保留时间值来定位具有可行性。

表6 不同高效液相/不同色谱柱下各组分测得的相对保留时间Table 6 Relative retention time measured in different instruments and columns
2.5.6 样品含量测定及QAMS法的验证 按“2.3”项下方法,分别制备采集的16批不同产地黄芪药材以及3批市售饮片供试品溶液,依法测定,进一步采用外标法(external standard method,ESM)和QAMS法对所测得的数据分别进行含量计算,并以相对误差(relative error,RE)进行评价,以验证QAMS法测定上述6种异黄酮类成分含量的准确性,结果见表7。结果显示,在16批不同产地来源药材及3批市售饮片均能测得6个异黄酮成分,其样品ESM法含量测定结果与QAMS法测得的结果相比差异较小,RE<5.0%,表明QAMS法检测的含量结果较为准确。

表7 ESM法与QAMS法测定黄芪中6种异黄酮成分的含量 (n=2)Table 7 Content of six isoflavonoids in samples of Astragali Radix by QAMS and ESM (n=2)
3 讨论
在前期研究及文献报道的基础上,首次建立了以CYG为内参物,同步测定CYM、FMG、FMM、CY及FM等6种异黄酮类成分的QAMS方法,该方法检测简便、耐用性好、准确度高、成本较低,可以为黄芪药材和饮片质量标准的修订提供技术依据。
3.1 分析方法的建立与优化
采用二极管阵列检测器,对6个异黄酮类成分进行了200~400 nm全波长扫描,结果显示CYG、CYM、FMG、FMM、CY和FM 6个成分的紫外光谱图十分相似,均在248~258 nm波长处有最大吸收。研究发现,在254 nm波长条件下6种待测成分的灵敏度均较好,且色谱图中基线平稳,具有良好的基线分离,可以满足定量分析的要求,因此,最终选择254 nm作为检测波长。
本实验对供试品溶液的提取方式进行了较为系统的考察,对提取方式(回流和超声)、提取溶剂(甲醇20%、40%、60%、80%、100%),溶剂体积(25、50、75、100 mL)、提取时间(15、30、45、60 min)进行了考察,同时考虑到丙二酰基异黄酮成分中酯键的稳定性,在提取溶剂及供试品溶液甲醇中加入了0.1%的甲酸,不仅可以降低丙二酰基异黄酮苷的降解转化,提升供试品溶液的稳定性,而且弱酸性条件还可以使得样品中异黄酮成分更好地呈现分子态,保证溶剂提取的效果。
本实验色谱条件优化过程中发现,不同型号C18色谱柱对异黄酮类成分的分离效果影响显著,在考察的已有8种型号色谱柱中,仅Waters Symmetry C18,Thermo Hypersil ODS,Agela Vensil XBP C183种色谱柱可以实现对6个异黄酮组分的有效分离(R>1.5),其余色谱柱的分离效果均不佳,尤其是不能将CY与FMM色谱峰分开,影响分析结果。从固定相填料性质上看,这3种型号均为硅胶基质上硅醇基封端的C18填料,其稳定性及选择性较好,可作为黄芪质量分析用色谱柱。
3.2 参照物的选择
参照QAMS法建立的技术指南[19],内参物尽量选择在样品中含量较高,保留时间适中的有效成分,本实验选择CYG为内参物,主要考虑该物质在《中国药典》黄芪药材标准中已有使用,性质稳定且易于获得,故选其作为QAMS法的内参物。以CYG为参照物时,各成分fs/i的RSD均小于3.5%,不同柱温、不同体积流量、不同色谱柱对fs/i的影响较小(RSD<3%),表明选择CYG作为内参物建立QAMS法可行。
3.3 黄芪中异黄酮类成分QAMS质量标准制定分析
本实验结果显示,黄芪中苷类成分(CYG、CYM、FMG、FMM)含量较高,而苷元(CY、FM)含量相对较低。值得注意的是,本实验研究中检测的2018年采集的7批药材成分含量与刚采集时测定的含量相比,CYG、CYM、FMG、FMM含量发生了明显下降,而CY及FM含量显著上升,其苷类成分平均总含量与苷元成分平均总含量的比值为3∶1,明显要低于2019年采集的9批黄芪药材中两者10∶1的比值。有学者研究发现[20],在温度37 ℃及润湿条件下,药材或饮片中丙二酰基异黄酮苷及异黄酮苷成分会发生酶解而转化生成异黄酮苷元,使得苷类成分含量下降而苷元成分显著升高。本研究中2018年采集药材存放时间较长,且所在地区夏季温润潮湿,易于酶解,这可能是导致该年度样本中异黄酮苷含量降低而异黄酮苷元含量相对升高的原因。
黄芪饮片在临床及制剂工艺中大多以水煎煮提取为主,其水提取物及配方颗粒中主要为CYG等苷类成分[21],苷元因极性小基本不被水提取出,因此酶解过程很可能会影响到黄芪质量及临床疗效。这提示黄芪药材及饮片应避免在较高温度和湿度条件下长期存放,并在黄芪药材及饮片质量标准建立过程中,考虑将CYG、CYM、FMG、FMM4个异黄酮苷成分总量建立最低含量下限,并设立CY及FM2个苷元含量的上限值。同时,还应进一步对黄芪药材和饮片的干燥、储藏、加工等影响质量的关键因素进行考察,积累数据,为修订完善黄芪药材的标准奠定基础。
利益冲突所有作者均声明不存在利益冲突

