过敏性紫癜患儿血浆C3、C4、IgA水平变化及其与肾脏损伤的关系
蔡浩,王强,赵风云
安徽医科大学附属阜阳医院,安徽阜阳236000
过敏性紫癜(HSP)是儿童时期常见的自身免疫性血管炎,大多预后良好,但部分患儿可出现HSP肾炎,严重者甚至进展为肾功能衰竭,极大影响患儿生长发育与长期预后。因此,早期明确诊断HSP,并深入研究HSP肾脏损伤的机制,可为制定合理治疗方案、预防HSP肾炎发生、促进病情转归等提供客观依据[1-2]。目前,已经明确HSP的发病与免疫功能异常密切相关[3-4]。补体存在于人和脊椎动物血清及组织液中,可被抗原—抗体复合物或微生物激活,活化后具有酶活性,可介导免疫应答和炎症反应,促进病原微生物裂解或被吞噬[5]。C3、C4是机体两种重要的补体,活动性系统性红斑狼疮患者血浆C3、C4降低,并与病情恶化有关,病情缓解时血其水平恢复正常,提示二者可能与自身免疫性疾病有关。但是,C3、C4在HSP中的水平变化尚存在争议,是否与肾脏损伤有关仍不确定[6-7]。免疫球蛋白A(IgA)占血清免疫球蛋白的10%~20%,有重要的免疫屏障作用[8],但与HSP及其肾脏损伤的关系仍有待探究。鉴于此,本研究观察了43例HSP患儿血浆C3、C4、IgA水平变化,并分析其与肾脏损伤的关系。现报告如下。
1 资料与方法
1.1 临床资料 经安徽医科大学附属阜阳医院医学伦理委员会批准,选取2017年8月—2020年3月我院收治的HSP患儿。纳入标准:①符合急性期HSP诊断标准[9];②年龄<15岁;③首次发病,入院前未给予激素等相关药物治疗;④无链球菌、支原体等感染类疾病;⑤患儿监护人知情同意。排除标准:①入组前3个月内有肾脏毒性药物、激素、免疫抑制剂应用史;②凝血功能障碍;③患有原发性、遗传性肾小球疾病;④IgA肾病;⑤合并HSP外其他自身免疫疾病;⑥心脑肝肺伴有严重功能障碍者。共收集HSP患儿43例(观察组),选取同期体检健康儿童98例作为对照组。观察组男18例、女25例,年龄(8.12±1.45)岁,体质量(28.65±7.73)kg;11例有肾脏损伤,尿微量白蛋白(254.35±36.47)mg/L、血尿素氮(BUN)为(7.96±2.44)mmol/L;32例无肾脏损伤,尿微量白蛋白(30.55±10.01)mg/L、BUN(4.55±1.52)mmol/L。对照组男20例、女23例,年龄(7.96±1.90)岁,体质量(29.14±8.36)kg。两组性别、年龄、体质量具有可比性。
1.2 血浆C3、C4、IgA检测方法 采集受试者清晨空腹静脉血5 mL,以离心半径15 cm、3 000 r/min离心10 min,采用雅培G-8000型全自动生化分析仪以比浊法检测血浆C3、C4、IgA。C3试剂盒购自深圳市锦瑞电子有限公司,C4试剂盒购自天津悦和康生物技术有限公司,IgA试剂盒购自上海杰美基因医药科技有限公司。
1.3 统计学方法 采用SPSS22.0统计软件。计量资料以±s表示,组间比较行t检验;采用Pearson分损伤患儿,C4、IgA高于无肾脏损伤患儿(P均<0.05)。见表2。析各指标与肾功能指标尿微量白蛋白、BUN的相关性,以Logistic多元回归分析明确各指标与肾脏损伤的关系。P<0.05为差异有统计学意义。
2 结果
2.1 两组血浆C3、C4、IgA水平比较 观察组血浆C3低于对照组,C4、IgA高于对照组(P均<0.05)。见表1。

表2 观察组有无肾脏损伤患儿血浆C3、C4、IgA水平比较(g/L,-x±s)

表1 两组血浆C3、C4、IgA水平比较(g/L,-x±s)
2.2 观察组有无肾脏损伤患儿血浆C3、C4、IgA水平比较 观察组有肾脏损伤患儿血浆C3低于无肾脏
2.3 观察组血浆C3、C4、IgA与肾脏损伤的关系 相关性分析显示,观察组血浆C3与尿微量白蛋白呈负相关(r分别为-0.570、-0.637,P均<0.05),C4与尿微量白蛋白、BUN呈正相关(r分别为0.651、0.723,P均<0.05),IgA与尿微量白蛋白、BUN呈正相关(r分别为0.652、0.609,P均<0.05)。多元线性回归分析显示,在控制了性别、年龄等因素后,血浆C3、IgA仍与尿微量白蛋白、BUN相关(P均<0.05)。见表3。
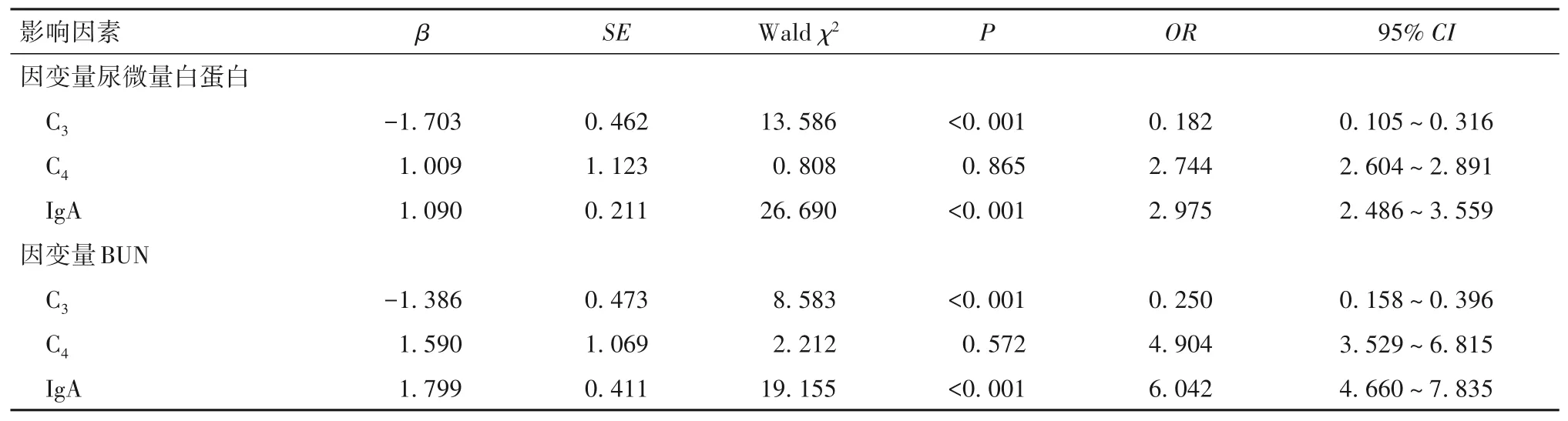
表3 观察组血浆C3、C4、IgA与肾脏损伤的Logistic多元回归分析结果
3 讨论
IgA以单体或双体形式存在,是高度糖基化的免疫球蛋白,外周血中IgA多为单体形式,黏膜免疫系统则产生分泌型双体IgA[10]。HSP患儿皮肤活检直接免疫荧光法发现,IgA的沉积最为常见,提示IgA在HSP的发病中起重要作用[11-12]。本研究显示,观察组血浆IgA水平高于对照组,与梁晨等[13]报道相似,说明IgA与HSP的发病有关。同时本研究还发现,观察组有肾脏损伤患儿的血浆IgA高于无肾脏损伤患儿,且血浆IgA水平与尿微量白蛋白、BUN呈正相关;在控制了性别、年龄后,血浆IgA与尿微量白蛋白、BUN仍显著相关,表明IgA是HSP患儿肾脏受累的独立影响因素。有研究显示,给予糖皮质激素治疗可降低HSP肾炎患儿血浆IgA水平及尿蛋白、尿红细胞水平,进一步提示IgA与HSP肾脏损伤有关[14]。IgA在HSP中存在分子的异常糖基化,使IgA易于自身聚集形成大分子复合物,而不能通过正常单体形式分解代谢途径被清除,造成IgA复合物水平增高;并且由于糖基化异常,IgA在铰链区缺乏半乳糖和唾液酸残基,导致肝细胞去唾液酸糖蛋白受体无法清除异常的IgA,造成外周血IgA水平升高;IgA形成的循环免疫复合物沉积在肾小球、皮肤小血管壁,引起细胞增生、细胞外基质成分的过度表达等,从而导致肾脏损伤[15]。
C3主要由巨噬细胞和肝脏合成,是血清中含量最高的补体成分。在C3转化酶的作用下,裂解成C3a和C3b两个片段,在补体经典激活途径和旁路激活途径中均发挥重要作用[16]。本研究显示,观察组血浆C3水平低于对照组,表明C3与HSP的发病有关。因C3是补体经典激活途径和旁路激活途径的汇合点,在补体系统活化过程中发挥重要作用,且作为关键分子替代途径,所以外周血C3被大量消耗而降低。HSP患儿中肾炎发生率为20%~80%,其中大部分患儿的肾损伤发生在起病6个月内,并成为影响预后的重要因素[17]。本研究发现,观察组有肾脏损伤患儿血浆C3低于无肾脏损伤患儿,与尿微量白蛋白、BUN呈负相关;在控制了性别、年龄后,血浆C3与尿微量白蛋白、BUN仍显著相关,表明C3是HSP肾脏损伤的独立影响因素。赵国晓[18]研究显示,低水平血清C3可导致较高的IgA/C3值,与HSP肾脏损伤有关。HSP患儿外周血C3水平降低,降低了其对异常糖基化IgA免疫复合物的清除能力,导致IgA免疫复合物在皮肤小血管壁、肾小球系膜区进一步沉积,并通过细胞外基质等途径引起肾脏损伤。
C4存在于血浆中,是一种多功能β1球蛋白,在补体经典激活途径中起重要作用。C4被水解为C4a、C4b后,能够起到防止免疫复合物沉积、促进吞噬、中和病毒等多方面作用[19]。本研究显示,观察组血浆C4水平高于对照组,提示C4与HSP发病有关。但C4在HSP中的详细机制尚不完全清楚,推测可能是IgA免疫复合物过度沉积导致的应激性结果。同样作为补体,C4在HSP中表现与C3明显不同,可能与二者在补体激活过程的地位高低及激活途径不同有关。C3是补体经典激活途径和旁路激活途径的汇合点,而C4仅是经典激活途径中第二个被活化的补体成分,C4较C3参与度降低;这也说明机体补体不仅通过经典激活途径参与HSP的发病,还通过旁路激活途径参与HSP的发病。同时本研究还发现,观察组有肾脏损伤患儿血浆C4水平高于无肾脏损伤患儿,C4与尿微量白蛋白、BUN呈正相关,提示C4参与了HSP肾脏损伤的发病过程;但多元线性回归分析显示,C4非HSP的独立影响因素,说明C4对HSP肾脏损伤的影响受其他因素的干扰。
综上所述,HSP患儿血浆C3水平明显降低,C4、IgA水平明显升高;三者均与HSP发病及肾脏损伤有关,其中C3、IgA是HSP肾脏受累的独立影响因素。因此,临床应重视HSP患儿免疫紊乱的纠正,防治HSP及其肾脏损伤并发症,以改善患儿预后。

