新型烟草制品风险评估框架要求研究进展及建议
李 翔,严大为,赵 阁,尚平平,赵俊伟,华辰凤,王 昇,郑赛晶*,谢复炜*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001 2.上海新型烟草制品研究院,上海市浦东新区秀浦路3733号 201315
新型烟草制品主要是指不同于传统燃烧型卷烟的烟草制品,大致可以分为4类:加热卷烟、电子烟、口含烟及其他烟草制品。与传统燃烧型卷烟相比,新型烟草制品具有“无需燃烧、可释放烟碱、焦油或某些有害成分释放量水平显著降低”3个共同特征[1]。加热卷烟和电子烟等新型烟草制品在欧美、日韩市场迅速崛起,国际烟草企业如菲莫国际、英美烟草、雷诺烟草、日本烟草等纷纷投入巨资研发[2],各国政府和世界卫生组织(WHO)也开始着手研究相应监管政策[3-4]。美国食品与药品管理局(FDA)负责监管在美国合法制造、销售和分销烟草制品的所有途径[5],没有获得FDA的烟草制品销售许可的新烟草制品(2007年2月15日之前没有在美国上市销售的烟草制品,或2007年2月15日之后在美国上市销售的烟草制品的改良产品)不能在美国合法销售,FDA针对烟草制品的市场准入制定了相应的申请导则和评估框架[6-9],产品评估基于对整体人群的风险,要求新产品上市前须提供全面的可降低健康风险的科学证据。欧盟也提出了类似的要求,对于新型烟草制品、电子烟和电子烟填充容器(Refill containers for electronic cigarettes)等采取上市前通告的方式进行审核[10]。
健康风险评估是以科学证据为基础的分析过程,可以为评估人群实际暴露下的健康损害程度提供参考依据,已成为管理机构和公众健康机构决策程序的重要组成部分[11-12],并应用于环境污染物、食品、药品和化妆品等领域的管控程序中。美国和欧盟对烟草制品的监管,以及国际各大烟草公司对新产品的评价均将健康风险评估作为重要的评估框架要求。深入解读新型烟草制品风险评估框架要求,对指导新型烟草制品的研发,拓展国际市场,以及制定国内相关监管策略具有重要意义。因此,分析并综述了烟草制品健康风险评估的相关法规和文献,对我国开展此项工作提出了政策建议。
1 新型烟草制品风险评估法规
截至2020年7月,美国和欧盟对新型烟草制品的监管和上市前风险评估要求主要有以下规定:
(1)美国医学研究院(Institute of Medicine,IOM)发布的“风险改良烟草制品(Modified Risk Tobacco Product,MRTP)研究的科学标准”
2009年6月美国发布“家庭吸烟预防与烟草控制法案”(Family Smoking Prevention and Tobacco Control Act,FSPTCA),授权FDA监管烟草制品。FSPTCA提出了“MRTP”概念,定义为以减少商业销售的烟草制品带来的危害或烟草相关疾病风险,可销售、分销供消费者使用的任何烟草制品[5]。该法案还指导FDA与IOM协商,制定关于设计和进行MRTP科学研究的规则和指南。IOM在总结以往烟草制品风险评估研究结果的基础上,于2012年提出了MRTP的风险评估框架,即:“MRTP研究的科学标准”[6]。根据该框架,MRTP的科学证据要回答3个方面的问题:MRTP的健康影响,MRTP的成瘾可能性,消费者对MRTP的认知。针对这3个方面的问题,IOM建议进行相应的风险评估研究,包括烟草制品的性能和组成成分分析、临床前毒理学研究、临床实验研究、烟草制品滥用和成瘾可能性研究、烟草制品上市前和上市后风险认知和风险交流研究。
(2)美国FDA发布的烟草制品上市前申请(Premarket Tobacco Product Application,PMTA)导则
2011年9月美国FDA发布了PMTA导则[7],对于新烟草制品或现有烟草制品改良产品的推出,需要向FDA提交PMTA。PMTA途径中明确提出,在审批上市前,FDA需要评估该烟草制品对吸烟者和公众健康的影响,制造商必须提供科学数据用以证明该产品对吸烟者和公众健康有利。PMTA导则要求申请资料中关于科学研究与分析的内容应包括:①化学成分分析;②非临床研究;③成年人群研究;④对环境影响的研究。2015年11月10日,美国FDA审核通过了瑞典火柴公司提交的8种口含烟产品的PMTA,发放了上市许可。2019年4月30日,FDA审核通过了菲莫国际的iQOS加热卷烟产品的PMTA,发放了上市许可。2019年12月17日,FDA审核通过了22世纪公司的两种极低烟碱卷烟产品的PMTA,发放了上市许可[13]。2019年6月,美国FDA发布了电子烟PMTA导则[8],要求申请资料中关于科学研究与分析的内容应包括:①产品分析和生产制造;②非临床和人群研究;③对环境影响的研究。2019年7月12日,美国马里兰州地区法院命令FDA,要求截至2016年8月8日上市的电子烟、雪茄和其他被认为是新烟草制品的制造商在2020年5月12日之前提交上市前审查申请,2020年4月22日,鉴于新型冠状病毒引起的呼吸系统疾病在全球爆发,法院批准提交上市前审查申请的期限可延长至2020年9月9日[14]。
(3)美国FDA发布的MRTP申请导则
2012年3月,美国FDA发布了MRTP申请导则,FDA对MRTP的授权包括风险改良许可(Risk Modification Order)和暴露改良许可(Exposure Modification Order)[9]。要获得风险改良许可,MRTP申请导则要求申请材料必须能够证明:①该产品对个体使用者能够显著降低危害和烟草相关疾病风险;②对包括烟草制品使用者和当前非使用者在内的整体人群健康有益。风险改良许可是有特定时效性的,获得许可后申请者还需要进行产品上市后调查和研究,并每年向FDA提交研究报告。要获得暴露改良许可,申请材料必须能够证明:该产品减少或清除了对某些有害成分的暴露;并且现有科学证据表明,未来的研究有可能证明发病率和死亡率的可预见性和大幅度降低。暴露改良许可时效一般不超过5年,同时获得暴露改良许可的前提条件是每年要向FDA提交产品上市后调查和研究的结果报告。MRTP导则要求申请者需要回答5个问题:烟草制品的健康风险;对当前烟草使用者烟草使用行为的影响;对非使用者可能使用烟草的影响;产品的市场销售对消费者理解和认知的影响;对整体人群的影响。针对上述问题,应当进行相应风险评估研究:①产品分析;②非临床研究;③成年人群研究;④辅助数据分析和计算建模研究;⑤上市后监督和研究;⑥对环境影响的研究。自2011年至2019年10月22日,美国FDA共计接收到29份MRTP申请,拒绝受理10项,拒绝归档6项,申请者撤回5项,仅瑞典火柴公司8种口含烟产品在2019年10月22日通过审核并最终获得MRTP风险改良许可授权,有效期5年[15-16]。2020年7月7日,FDA批准了菲莫国际烟草公司“iQOS烟草加热系统”MRTP(暴露改良许可)的授权,包括iQOS加热设备、3种万宝路加热卷烟[16],FDA授权菲莫国际烟草公司在该产品宣传和营销中可使用的信息包括“现有证据显示:iQOS系统加热烟草但不燃烧烟草;这大大减少了有害及潜在有害化学成分的产生;科学研究表明,从使用传统卷烟彻底转换成iQOS系统,可以显著减少使用者对有害或潜在有害化学成分的暴露”。这一暴露改良许可有效期是4年,到期后必须重新申请获得授权。
截至目前,正处于实质性审查阶段的MRTP申请还有:雷诺烟草公司6种口含烟,美国无烟烟草公司1种湿鼻烟,22世纪公司两种极低烟碱卷烟产品[15]。
(4)欧盟相关监管规定
欧盟于2014年4月29日颁布了新修订的烟草制品指令—2014/40/EU[10],明确将新型烟草制品、含烟碱的电子烟及电子烟填充容器等纳入管制范围。烟草制品指令根据不同电子烟产品的特征,对电子烟烟液的填充容器、填充容器体积、添加剂、防护装置等各方面进行了限定。欧盟采取上市前通告的方式进行审核。指令规定,新型烟草制品、电子烟和填充容器的制造商和进口商应在产品拟上市前6个月,以电子文档形式向成员国主管当局提交其计划投放到有关国家市场的通告。通告应附有相关制品的详细说明、使用说明以及成分和释放物的信息。具体内容包括:产品的毒性、致瘾性和吸引力,特别是产品的成分和释放物的现有科学研究结果;不同消费群体(包括年轻人和当前吸烟者)消费偏好研究报告和市场调查结果;其他可获得的相关信息,包括产品风险-收益分析、对停止烟草消费的预期影响、对开始烟草消费的预期影响以及消费者认知预期等。
欧盟新兴及新鉴定健康风险科学委员会(Scientific Committee on Emerging and Newly Identified Health Risks,SCENIHR)曾评价了无烟气烟草制品的健康影响,采用的实验研究包括:体外试验、动物模型、人群实验以及流行病学研究等[17],为新型烟草制品上市前通告的风险评估研究提供了一定的思路。欧盟委员会要求欧盟健康、环境与新兴风险科学委员会(Scientific Committee on Health,Environmental and Emerging Risks,SCHEER)对开展烟草添加剂全面研究的方法和标准提供指导。2016年,SCHEER发布了第2版《对烟草制品用添加剂的意见》[18],除提供了相关研究方法的导则之外,还分析了15种优先添加剂的研究数据缺口,例如毒性、致瘾性、香味特征以及热裂解产物等方面的信息,但尚未涉及电子烟和加热卷烟的相关研究。
2 国际新型烟草制品风险评估研究
国际各大烟草公司都在积极开展新型烟草制品的研发,并为产品的国际市场准入进行产品减害和健康风险评估研究。瑞典火柴、菲莫国际和美国雷诺烟草等已经向美国FDA提交了相关烟草制品的PMTA和MRTP申请,开展的风险评估研究内容主要包括以下几个部分:
2.1 烟草制品使用者个体健康风险评估
主要包括烟草制品产品设计和控制原则、化学和物理特性分析、非临床毒理学研究和人群实验研究4个方面。
2.1.1 产品设计和控制原则
瑞典火柴口含烟产品风险评估报告的内容有:产品配方(包括成分、配料和添加剂的完整清单,以及每种产品的适用规格和预期功能的信息),烟叶掺配、重构、生产过程、质量控制措施信息,产品整体设计、材料、原料等信息[19]。
菲莫国际iQOS产品风险评估中,产品设计和控制原则方面的评估内容包括:产品研发条件、生产质量标准、变更管理和可比性等。其目的是确保产品的一致性生产,满足性能参数要求[20]。
雷诺烟草进行口含烟的MRTP申请时,对产品的设计、产品配方、产品稳定性及使用条件也进行了评估[21]。
2.1.2 化学和物理特性分析
瑞典火柴按照MRTP导则要求评估了口含烟产品的化学和物理特性,分析和报告了有害及潜在有害成分(Harmful and Potentially Harmful Constituents,HPHCs)的释放量水平[19]。
菲莫国际关于iQOS的评估中,烟气气溶胶化学和物理特性分析是评估的第二步,分析测试了烟气气溶胶中58种HPHCs成分,其中54种是美国FDA 93种烟草制品、卷烟烟气HPHCs清单[22]中的成分,另外4种为水、烟碱、总粒相物和焦油。测试了两个气溶胶物理特性主要参数,分别是质量中值粒径和几何标准偏差。将这些测试结果均与常规卷烟进行了比较,以证明iQOS具有实质性减害效果[20,23-24]。
雷诺烟草对于口含烟产品的评估,化学成分的分析数据主要来自文献的综述分析结果,化学分析按照FDA推荐的HPHCs清单进行测试[25]。
2.1.3 非临床毒理学研究
瑞典火柴按照MRTP导则要求对口含烟产品进行了非临床毒理学研究,主要开展了口腔非致癌的潜在健康风险评估,如:牙齿影响和牙周疾病、口腔黏膜损伤等评价。体外毒理学研究主要进行了Ames试验、TK-6和AHH-1细胞致突变试验、姐妹染色单体交换试验、染色体畸变试验、基因突变试验、微核试验以及中性红细胞毒性试验等。动物实验研究主要进行了仓鼠颊囊和口腔黏膜实验、大鼠人工唇管(Artificial Lip Canal in Rats)实验、小鼠口腔黏膜实验、致癌的启动和促进实验、60~90 d喂养实验(研究致癌影响)、终生饮水实验(NNK,NNAL,4NQO)、大鼠口腔致癌实验、病毒实验(HPV人乳头瘤病毒和HSV单纯疱疹病毒)以及转基因小鼠实验等[19,26-34]。
菲莫国际对iQOS的毒理学评估主要开展了常规毒理学评估、烟草相关疾病模型研究和系统毒理学评估研究。通过体外试验和动物研究,证明加热卷烟的气溶胶与传统卷烟(3R4F参比卷烟)相比毒性显著降低。采用的体外试验包括:中性红细胞毒性试验,Ames试验,小鼠淋巴瘤细胞致突变试验,口腔、鼻黏膜、支气管器官型组织培养的体外呼吸模型研究以及体外心血管模型研究。采用的动物实验包括大鼠90 d亚慢性吸入毒性研究、A/J小鼠18个月吸入毒性研究、Apoe-/-基因敲除小鼠的转换抽吸模型研究等。在开展的系统毒理学研究中,使用计算方法综合分析了一系列的分子事件、常规毒性实验指标、动物疾病模型的疾病终点评估指标(肺气肿、肺功能、动脉粥样硬化板块大小)等[20,23,35-46]。
雷诺烟草对口含烟产品的非临床毒理学评估数据主要来自文献综述。对于口含烟的体外毒理学评估主要采用了Ames试验、哺乳动物细胞姐妹染色单体交换试验、哺乳动物细胞微核分析、中性红细胞毒性试验以及人尿液致突变实验等。动物实验研究主要采用了2周大鼠饲喂实验、2周小鼠饲喂实验、2周重复高剂量小鼠饲喂实验、28 d重复剂量大鼠实验、28 d重复剂量小鼠实验、90 d亚慢性重复剂量大鼠实验、90 d亚慢性重复剂量小鼠实验、2年慢性毒性/致癌性大鼠饲喂实验等[47-54]。
各烟草公司在向FDA提交新型烟草制品PMTA或MRTP申请时,这些非临床毒理学评估的科学证据均是申请资料的重要内容。
2.1.4 人群实验研究
瑞典火柴关于口含烟的人群实验研究采用已报道的文献结果,并按照MRTP导则要求进行了总结。主要包括:使用口含烟和传统卷烟疾病发病率和致死率的流行病学比较(癌症、心血管疾病、呼吸系统疾病、代谢疾病等);转换口含烟、卷烟和口含烟双重使用以及戒烟3种行为下吸烟相关疾病发病率的比较;转换口含烟与转用烟碱替代疗法的疾病发病率对比;使用口含烟和抽吸卷烟的有害成分(烟碱、烟草特有亚硝胺、Cd、Se等)生物标志物评估[55-64]。
菲莫国际开展的iQOS人群研究包括短期(5 d)和中长期(90 d)实验。实验主要采用生物标志物方法,对不同人群,包括持续吸烟者、戒烟者以及转抽加热卷烟者的有害成分暴露和疾病风险进行评估,目的是考察加热卷烟是否能降低吸烟者有害成分暴露量及疾病风险。评估的暴露生物标志物主要包括烟碱、TSNAs(NNK)、CO、挥发性有机物(1,3-丁二烯、苯、丙烯腈、环氧乙烷、甲苯)、挥发性羰基物(丙烯醛、巴豆醛)、多环芳烃以及芳香胺(1-氨基萘、2-氨基萘、4-氨基联苯、邻甲苯胺)等;疾病风险标志物包括心血管疾病、慢性阻塞性肺病和肺癌的标志物,如炎症、氧化应激、肺功能等[65-74]。
雷诺烟草关于口含烟的评估研究包括流行病学研究和临床实验。流行病学研究分析了转用无烟气烟草后与抽吸卷烟相比相关疾病的降低程度,包括肺癌、口腔癌、呼吸系统疾病和心脏病等;同时使用卷烟和无烟气烟草与仅使用卷烟相比,使用无烟气烟草与其他烟草替代产品相比,疾病风险的增加情况。临床实验包括横断面研究和现场实验,主要采用生物标志物方法,比较无烟气烟草消费者和吸烟者之间、吸烟者转换无烟气烟草前后、转换无烟气烟草或烟碱替代疗法前后有害成分暴露和疾病风险情况[75]。评估的暴露生物标志物包括烟碱、烟草特有亚硝胺、CO、挥发性有机物(1,3-丁二烯、苯、丙烯腈、环氧乙烷、甲苯)、挥发性羰基物(丙烯醛、巴豆醛)、多环芳烃、芳香胺(1-氨基萘、2-氨基萘、4-氨基联苯、邻甲苯胺)和重金属等;疾病风险标志物包括心血管疾病、慢性阻塞性肺病和肺癌的标志物,如炎症、氧化应激等[75]。
2.2 整体人群健康风险评估
整体人群健康风险评估的调查人群要涵盖现有产品使用者、吸烟者、非吸烟者。评估内容主要包括对吸烟者使用行为的影响、对非吸烟者的影响、产品上市对消费者健康认知的影响、滥用性研究、对整体人群健康风险评估的模型研究以及上市后评估等6个方面。
2.2.1 对吸烟者使用行为的影响
瑞典火柴对吸烟者使用行为的影响研究主要包括:吸烟者开始使用口含烟产品的可能性;接受该产品后,吸烟者转抽或复抽其他风险更大烟草制品的可能性;消费者同时使用其他烟草制品的可能性;准备戒烟者使用产品的可能性;消费者按照产品设计使用的可能性等[76-80]。
菲莫国际的研究考察了成年吸烟者全部转抽或部分转抽加热卷烟的可能性,转抽加热卷烟者停止使用烟草制品的可能性,转抽加热卷烟者重新抽吸卷烟的可能性,消费者遵循产品说明使用的可能性以及消费者错误使用产品的可能性等[81]。
雷诺烟草的研究主要包括吸烟者开始使用产品的可能性、使用行为(完全转换、同时使用卷烟、戒烟等)、准备戒烟者使用产品的可能性等[82]。
2.2.2 对非吸烟者的影响
瑞典火柴对非吸烟者的影响研究主要包括:非吸烟者特别是青少年和年轻人使用口含烟制品的可能性,接受这种产品的非吸烟者转抽更高风险烟草制品的可能性以及戒烟者重新使用烟草制品的可能性[83-84]。菲莫国际的研究主要包括非吸烟者使用和戒烟者使用烟草制品的可能性等[81]。雷诺烟草的研究主要包括吸烟者和戒烟者开始使用产品的可能性[82]。
2.2.3 产品上市对消费者健康认知的影响
瑞典火柴对于口含烟、菲莫国际对于iQOS加热卷烟以及雷诺烟草对于口含烟开展的关于产品上市对消费者健康认知影响的研究,涉及的内容基本一致,主要包括:消费者对风险改良宣传的理解能力以及对个人健康影响信息重要性的认识,对使用该产品的健康风险和对使用其他烟草制品包括同类产品的健康风险的认知,对使用产品与烟草替代品以及戒烟的健康风险认知等[81-82,85-87]。
2.2.4 滥用性研究
瑞典火柴关于口含烟产品滥用性的研究主要为烟碱代谢动力学和药效学研究[88-89]。菲莫国际关于iQOS产品滥用性的研究包括3个方面:①产品特性,包括产品设计方面(如烟碱、薄荷醇的质量分数等)和气溶胶化学成分方面(如烟碱、丙烯醛和氨的递送);②使用的可能性,包括烟碱药代动力学(吸收速率和程度、烟碱摄入等)、药效学效应(个体效应)和增强效应(产品使用行为、健康风险、成瘾风险认知理解、不同人群使用意愿等);③使用后的结果(功能损伤,包括认知评估、心理表现、戒断症状)、身体依赖性(戒断症状)和不良事件(厌恶性不良事件、神经系统紊乱)[90]。雷诺烟草关于口含烟产品滥用性的研究主要为烟碱的代谢动力学研究[91]。
2.2.5 对整体人群健康风险评估的模型研究
瑞典火柴在进行口含烟整体人群健康风险评估时采用了队列模型,主要考察不同暴露组(吸烟者、戒烟者、口含烟使用者)的致病率和致死率[92]。菲莫国际在对iQOS进行评估时,评估模型为产品对消费者的风险或毒性与产品在人群中流行度的相关函数,需要考虑加热卷烟与传统卷烟的相对暴露量,美国市场中加热卷烟的接受度,产品初始使用、再次使用和停止使用的可能性以及消费者对不同烟草制品使用的可能性等[93]。雷诺烟草在进行口含烟评估时,模型研究采用DPM(+1)模型,主要是评估不同暴露组(吸烟者、非吸烟者、口含烟使用者)在不同场景下(吸烟但不使用口含烟、转换成口含烟)的致死率[94]。这些评估的研究结果均已作为新型烟草制品进行PMTA或MRTP申请时提交的科学证据。
2.2.6 上市后评估
瑞典火柴关于产品的上市后评估主要是收集证据,用以说明口含烟使用者的公共健康情况、产品使用情况,监控和收集因使用口含烟造成的不良事件等。除考虑PMTA中的相关问题外,还考虑消费者对不同烟草制品健康风险认知以及整体健康风险模型分析[95]。
菲莫国际围绕iQOS产品的上市后评估主要包括4个方面:安全性考察(非临床数据、文献综述、主动安全性检测、被动安全性监管)、横断面流行病学调查(产品的流行度、使用及停止使用情况、使用行为)、队列研究(消费者情况、实际使用情况、产品接受度、暴露和效应生物标志物情况)和人群健康影响模型(综合个人风险、产品流行情况、产品使用情况评估整体人群健康风险)[81]。
雷诺烟草围绕口含烟产品的上市后评估包括:产品和申请说明差异监管,消费者抱怨和FDA报道的不良事件监管,口含烟的认知、行为和健康信息,产品销售数据,口含烟消费者、吸烟者、戒烟者和非吸烟者数据,模型分析等[96]。
2.3 对环境影响的评估
这一部分评估包括产品组成分析、大气环境污染评估以及陆地和水生环境评估3个部分。
瑞典火柴为获得风险改良许可,主要评估了口含烟产品生产、运输、使用和废置处理过程中是否增加任何明显新的对环境的不利影响,包括空气、水生环境、陆生环境及生物有机体的环境影响评估。此外还进行了能源和资源消耗的评估,例如石油产品和煤炭等自然资源等的消耗[97]。
菲莫国际对iQOS的评估内容主要包括环境烟草烟气评估、水生和陆生环境评估以及能源和资源消耗的评估,提供了加热卷烟对室内空气质量的影响研究数据,分析了室内空气污染物。在进行水生和陆生环境评估时采用烟碱作为标志物,评估的材料主要包括加热卷烟的烟支、烟草薄片、器具和包装材料等[81]。
雷诺烟草进行的口含烟对环境影响的评估也是为了获得风险改良许可,主要评估了产品在生产、使用和废置处理3类过程中是否增加任何明显新的对环境的不利影响。此外还进行了能源和资源消耗的评估,主要包括电力、水及天然气等以及温室气体排放评估、生态环境评估等[98]。
3 国内新型烟草制品风险评估研究进展
近年来,国内围绕传统卷烟风险评估的相关研究较少,主要开展了基于7种代表性有害成分的“卷烟危害性指数”研究[99],实现了对卷烟主流烟气有害成分释放量的管控;开展了以3项体外毒理学测试的烟草制品生物学效应评价,制定了相应的企业标准;借鉴环境污染物风险评估的关键技术对烟草烟气中重要有害成分进行风险评价研究[100]。随着新型烟草制品的涌现,国内主要卷烟生产企业均在大力研发加热卷烟和电子烟等新型烟草制品,并推向国际市场。然而,世界各国关于新产品的法规要求中均对新型烟草制品的市场准入设置了门槛。国内关于新型烟草制品的风险评估研究起步较晚,目前尚无相关的评估框架和关键评估技术方法体系。现有形势下,国内烟草行业以郑州烟草研究院、上海新型烟草制品研究院、云南中烟工业有限责任公司、上海烟草集团有限责任公司、国家烟草质量监督检验中心等为代表的科研机构和工业企业技术中心在新型烟草制品的健康风险评估方面开展了一些先导性工作[101-110],主要包括:国内外法律法规文献调研,烟气气溶胶物理特性和有害成分分析,毒理学评估,小规模人群转换抽吸实验(吸烟行为研究、暴露生物标志物分析、消费者问卷调查以及烟碱成瘾性研究等),环境烟气影响研究等科研项目。这些前期工作的开展为后续产品的风险评估提供了科学证据和技术支撑,有助于推进国内新型烟草制品风险评估框架的制定进程。
4 结论与建议
4.1 结论
通过分析相关法规导则及文献,发现各大烟草公司对新型烟草制品的风险评估框架略有差异,具体见表1。
从表1可知:①在产品性能和组成成分分析方面,菲莫国际分为产品设计和控制原则、气溶胶化学和物理特性分析两部分,其他资料均将这些内容作为1个部分。②在毒理学研究方面,菲莫国际分为标准毒理学评价和系统毒理学评价两部分,雷诺烟草分为体外毒理学研究和体内毒理学研究两部分,其他资料均以非临床研究1个部分进行评估。③在人群研究方面,MRTP申请导则、菲莫国际、瑞典火柴和雷诺烟草的评估还包含单独的人群预测模型研究,而其他资料则将这部分内容合并到人群研究中预测产品对整体人群风险的降低。④P MTA导则和电子烟PMTA导则均未要求提供上市后研究和调查的资料。⑤I OM建议的评估框架中没有涉及对环境影响的评估。
FDA关于MRTP申请需提交的科学证据仅为指导性纲要,没有具体的限制,可提供的研究证据越全面、越充分,将越能支撑新产品风险降低的结论,并且支撑新产品健康风险降低的科学证据可以不断补充和更新。已批准的PMTA或MRTP申请,也有可能因为在市场上的表现有违减害原则而被取消。综上所述,要评估新型烟草制品对公众健康的影响,须获取各方面的科学证据,需要设计和开展许多不同类型的研究,包括产品的组成研究、毒理学研究、人群健康影响、致瘾性和滥用可能性、公众对新型烟草制品的认知和理解以及对环境影响的研究等多方面。
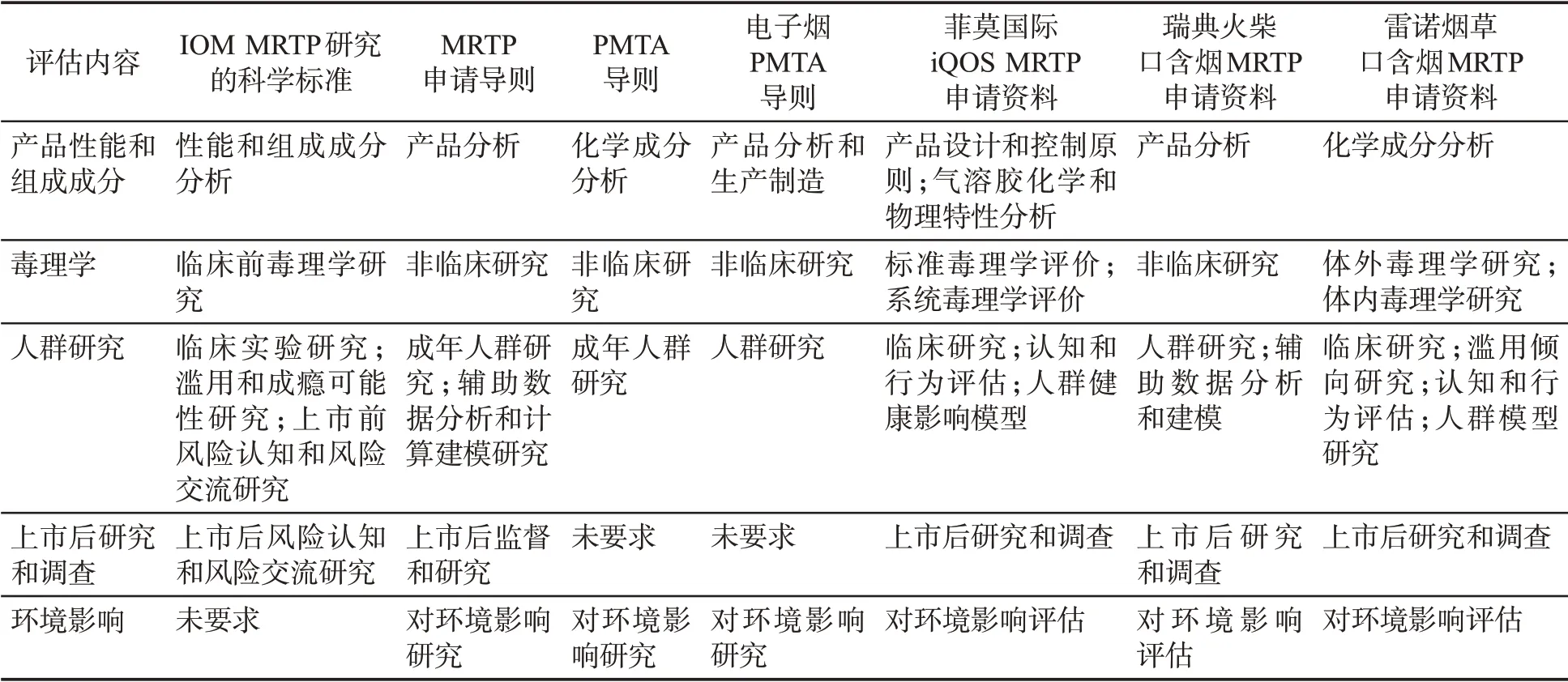
表1 新型烟草制品风险评估框架对比Tab.1 Comparison among risk assessment frameworks for novel tobacco products
4.2 建议
国内烟草行业应积极追踪和分析世界各国对新型烟草制品市场准入的法律法规,制定并不断完善风险评估框架,同步开展我国新型烟草制品的风险改良评估研究。针对新型烟草制品的风险评估提出建议框架如图1所示,以下分别详述。
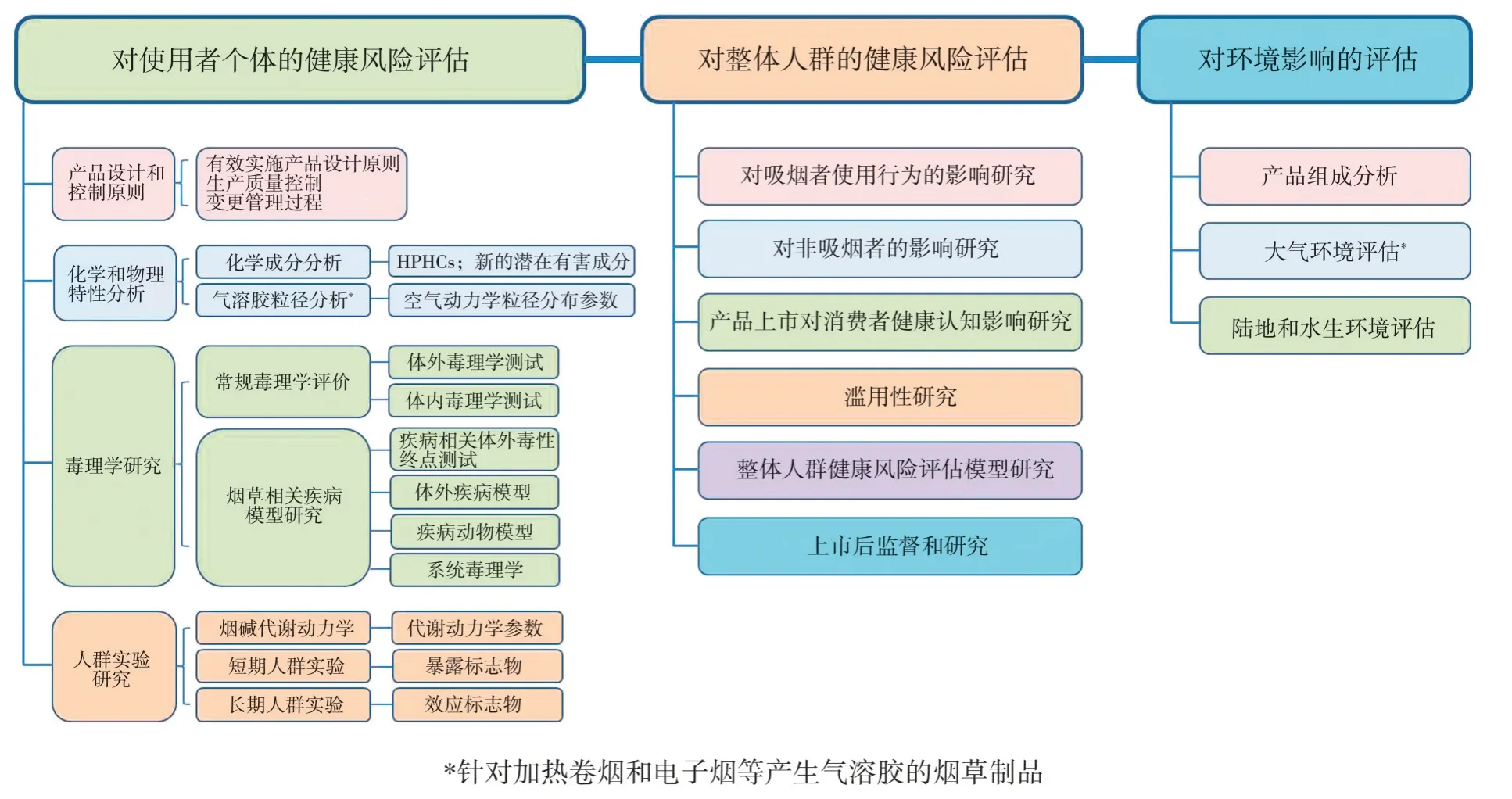
图1 建议的新型烟草制品风险评估框架要求Fig.1 Recommended framework for novel tobacco product risk assessment
4.2.1 对使用者个体的健康风险评估
评估内容应包括:①确保产品按照适当的质量标准生产,以满足产品性能参数设定的标准;②重点进行化学和物理特性分析,从而证明一致性或大幅减少有害及潜在有害成分生成,针对加热卷烟和电子烟等产生气溶胶的烟草制品进行气溶胶粒径分析;③采用法规要求的常规毒理学评价方法和烟草相关疾病模型开展体外和体内实验研究,以证明在实验室模型系统中降低危害和疾病风险的程度;④对成年吸烟者进行药代动力学/药效学(Pharmacokinetics/Pharmacodynamics,PK/PD)研究,以评估加热卷烟、电子烟或口含烟等传递的烟碱药代动力学特征与卷烟传递的药代动力学特征的相似性,同时开展短期和长期临床研究,从而证明转换使用加热卷烟、电子烟或口含烟等之后的临床暴露水平、疾病风险标志物变化与戒烟的风险指标变化的一致性。
4.2.2 对整体人群的健康风险评估
评估内容应包括:①考察吸烟者开始使用新产品的可能性,接受新产品后转抽或复抽其他风险更大烟草制品的可能性,消费者同时使用其他烟草制品的可能性,准备戒烟者使用新产品的可能性,消费者按照产品设计使用的可能性等;②考察非吸烟者使用新产品的可能性;③考察新产品上市是否会误导消费者对产品危害性的认知;④考察消费者滥用的可能性;⑤预测新产品对整体人群健康是否有益。
4.2.3 对环境影响的评估
评估内容应包括:①评估产品原料、器具、包装等可能对环境造成的污染;②分析新产品的使用对室内空气质量的影响;③通过水生和陆生生物的急性毒性试验,研究新型烟草制品对环境的危害风险。

