microRNA-125b在孕期酒精暴露所致新生小鼠脑神经元凋亡中的作用*
胡文广, 赵力立, 邓佳, 毛丹丹, 李思秀
成都市妇女儿童中心医院儿童神经内科(四川成都 610091)
尽管长期以来学者对饮酒对于人体的影响一直存在争议,但孕期酒精暴露对子代发育的危害已为人所熟知。孕期母亲饮酒会导致胎儿出现胎儿酒精综合征(fetal alcohol syndrome, FAS)[1]。FAS的最主要影响是其对子代神经系统的破坏。宫内酒精暴露可影响神经细胞功能,甚至影响脑部结构的发育而引起脑畸形,进而引发一连串的认知功能障碍,包括有记忆力低下、注意力不足、冲动的行为及较差的理解力等,另外亦会造成次级障碍,如对法律感到困难、心理疾病及药物上瘾[2]。近期研究显示在不知已受孕情况下,孕早期的酒精单次暴露同样可对子代神经系统发育产生诸多负面影响。因此探讨孕期酒精暴露的保护性因素至关重要。目前认为孕期酒精暴露致子代发育异常与细胞凋亡可能有关。然而具体机制研究仍有较大空白。microRNA是近些年发现的与基因沉默、下调密切相关的一类非编码小分子RNA[3-5]。最新研究发现microRNA-125b(miR125b)在哺乳动物脑组织中存在高丰都表达,其为新近发现的参与神经细胞代谢、凋亡的重要非编码RNA[6]。目前p53在凋亡中的关键作用已为学者所熟知,通过调控Bax/Bcl2、Fas/Apol及IGF-BP3 等蛋白,p53可直接促进细胞凋亡[7]。同时最新研究发现miR125b可负向调控p53基因表达,进而参与调控多种生理、病理过程[6]。而miR125b-p53通路在FAS中的作用尚无报道。因此我们推测在孕期酒精暴露模型中,miR125b可能通过负向调控p53而致子代神经细胞凋亡。2017年10月至2019年6月,本研究通过构建FAS动物模型,以microRNA调控为研究切入点,探讨孕期酒精暴露致子代神经细胞凋亡的可能分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 c57受孕雌性鼠(购于四川大学华西基础医学院动物中心)。
1.1.2 PC-12细胞培养及miR125b过表达转染 PC-12细胞株采购普赛诺(武汉)生物科技有限公司。miR125b-mimic由上海吉玛制药技术有限公司构建。
1.1.3 主要试剂 抗p53抗体;工作浓度1∶3 000;抗Bax抗体,工作浓度1∶3 000;抗GPADH鼠单克隆抗体,工作浓度1∶2 000;山羊抗兔及山羊抗小鼠带HRP标记的IgG(北京中杉金桥生物技术有限公司);BCA蛋白测定试剂盒(Pierce公司);总RNA提取试剂盒(TaKaRa公司);反转录试剂盒(TaKaRa公司);实时定量PCR试剂盒(天根生化技术有限公司);Tunnel 试剂盒(罗氏公司)。
1.2 实验方法
1.2.1 小鼠分组及处理 小鼠随机分为两组,整个孕期连续予以5 μL/g/d,50%的酒精连续灌胃19 d作为酒精暴露组,生理盐水灌胃作为对照组。新生小鼠采用CO2窒息处死,随即开颅取出全脑组织。
1.2.2 PC-12细胞体外培养 PC-12细胞复苏后在含神经生长因子(nerve growth factor,NGF)的培养条件培养5 d以获得神经元样细胞。给予浓度100 mmol/L乙醇暴露神经元样细胞,36 h后转染miR125b-mimic。
1.2.3 检测小鼠出生脑/体重比 子代小鼠生后即测其出生体重,单位以克(g)计,新生小鼠全脑组织称重,单位以毫克(mg)计,计算脑/体重比。
1.2.4 Tunnel检测新生鼠脑组织细胞凋亡 收集新生小鼠脑组织每组3个,4%多聚甲醛固定-30%蔗糖脱水处理-OCT包埋-冰冻切片。按照Tunnel试剂盒说明书步骤染色组织切片,荧光显微镜观察,细胞核被DAPI标记为蓝色荧光,Tunnel阳性细胞被标记为绿色荧光。我们随机选取5个切面,对于切面内凋亡细胞及总细胞进行计数,计算凋亡细胞/总细胞比,再进行统计学分析。
1.2.5 Western blot检测p53及Bax蛋白 冰浴下迅速取出全脑组织,放入PBS中清洗,尽量除去残留血液,存于液氮中备用。收集脑组织后,利用全蛋白提取试剂盒,提取全蛋白,调整上样量为30 μg,点样在10%的SDS-聚丙酰胺凝胶上进行电泳,再电转至0.45 μm的PVDF膜上,用封闭液稀释Ⅰ抗后4℃过夜,洗膜后再孵育Ⅱ抗(1∶2 000稀释),室温下后洗膜,化学发光成像,Quantity one软件获得其吸光度,以目的蛋白/GAPDH(吸光度值)来反映蛋白的相对表达量。
1.2.6 实时定量PCR 按照试剂盒说明书操作进行实时定量PCR检测。p53上游引物序列为:5′-CAAGCTTATGCCCCCAGGGAGCACTAAGCGAGCA-3′,下游引物序列为:5′-TCTCGAGTCAGTCTGAGTCAGGCCC-3′,产物长度为154 bp;Bax的上游引物序列为5′-GAGCATCTTTGCGATTACC-3′,下游引物序列为5′-GTTATTGACAACGAGGCAT-3′,产物长度为132 bp;miR125b的上游引物序列为5′-CATTCGTACAGCCGT-3′,下游引物序列为5′-ACGTTCGGGTGTG-3′,产物长度为109 bp;选取U6作为microRNA内参基因,上游引物序列为5′-GTACCGTTCATATC-3′, 下游引物序列为5′-GATTCGATCCGAC-3′,产物长度114 bp;选取GAPDH作为内参基因。所得数据用Bio-RadCFX96 荧光定量PCR 仪自带基于Pfaffl 原理的相对定量数据分析软件分析。

2 结果
2.1 子代小鼠出生脑/体重比 对照组小鼠出生脑/体重比为(5.32±1.06)mg/g,而酒精暴露组小鼠出生脑/体重比为(4.19±0.87)mg/g,孕期酒精暴露引起子代小鼠脑/体重比明显下降,两组差异有统计学意义(P<0.05)。
2.2 子代小鼠脑组织Tunel阳性细胞情况 发现孕期酒精暴露后新生小鼠脑组织中神经元细胞凋亡明显增多(1.4%vs0.08%)。见图1。
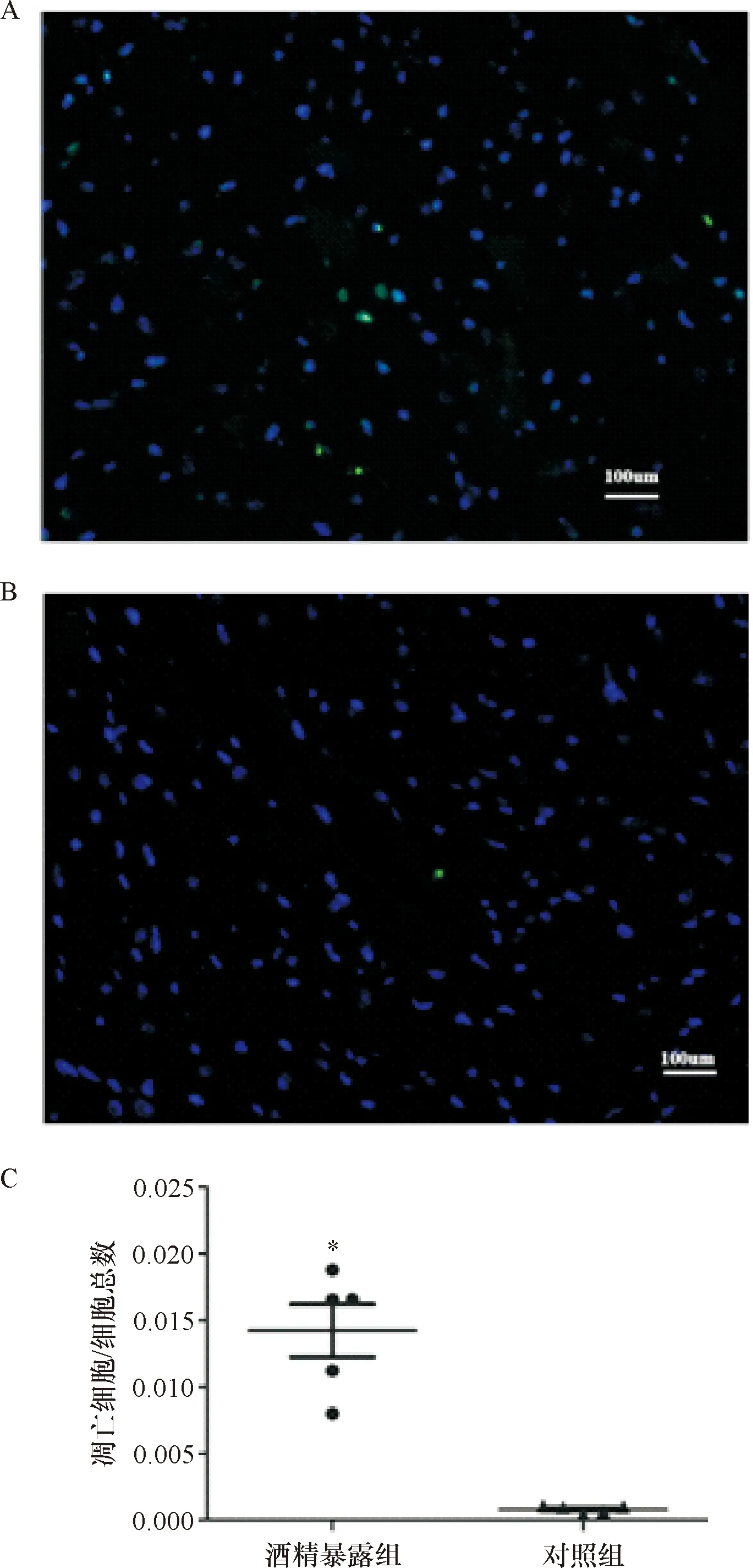
注:A:酒精暴露组;B:对照组。C:随机切面视野内凋亡细胞数/细胞总数比值,*与对照组比较 P<0.01(n=5)。细胞核被DAPI标记为蓝色荧光,Tunnel阳性细胞被标记为绿色荧光
2.3 子代小鼠脑组织中miR125b、p53及Bax mRNA表达水平 酒精暴露组F1代小鼠脑组织中miR125b mRNA较对照组降低(P<0.05),而p53及Bax的mRNA表达在酒精暴露组中显著升高(P<0.05),见表1。

表1 酒精暴露组与对照组各基因mRNA相对表达量
2.4 子代小鼠脑组织中p53及Bax蛋白表达水平 酒精暴露组子代小鼠脑组织p53及Bax蛋白水平较对照组均显著升高(P<0.05),见表2、图2。

表2 两组p53及Bax蛋白表达水平
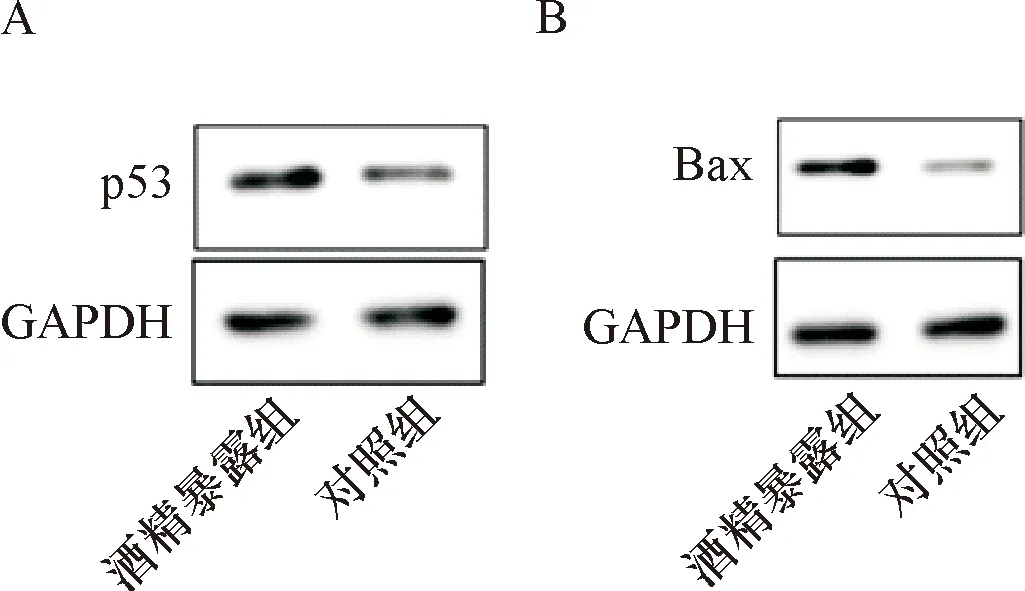
注:A:两组p53蛋白表达水平比较;B:两组Bax 蛋白表达水平比较
2.5 体外情况下乙醇干预PC-12细胞及miR125b-mimic转染后miR125b、p53及Bax mRNA表达水平 100 mmol/L乙醇干预神经元样细胞后检测miR125b、p53及Bax的mRNA表达水平;与体内结果相似,miR125b mRNA较对照组降低(P<0.05),而p53及Bax的mRNA表达在酒精暴露组中显著升高(P<0.05),见表3;将构建好的miR125b-mimic转染乙醇干预的神经元样细胞后,再次检测miR125b、p53及Bax的mRNA表达水平,结果发现过表达miR125b后,与酒精暴露组及对照组相比miR125b表达显著升高(P<0.05),与酒精暴露组相比p53及Bax表达水平显著降低(P<0.05),见表3。

表3 各组各基因mRNA相对表达量
3 讨论
FAS包括子代出生低体重、神经及心脏发育畸形等多种发育异常[1]。我们数据发现子代新生小鼠在出生时即存在脑体质比的显著下降。而凋亡是酒精致子代神经系统发育异常的重要机制之一[8]。本研究通过构建FAS小鼠模型,探讨FAS中神经细胞凋亡的可能分子机制。
microRNA在哺乳动物进化中高度保守[9-10],其通过降解靶基因mRNA而调控基因沉默[11]。目前已经发现诸多与神经发育生理、病理相关的microRNA[11-12 ]。miR125b是新近发现的一种在脑组织中高丰度表达的microRNA[6]。然而其是否参与影响FAS中神经系统发育异常仍不明确。本研究首次在FAS模型中检测并发现miR125b在FAS小鼠脑组织中表达明显降低。提示其靶基因可能过度激活而影响神经系统发育。而我们通过查阅文献发现p53是新近发现miR125b下游基因[6]。如前述,凋亡是FAS发生中的重要一环,而p53恰为经典的凋亡相关基因。诸多文献已经证实,p53可直接激活其下游促凋亡基因Bax而诱导细胞发生凋亡[13-14],此过程在肿瘤发生、脑血管梗死等多种生理、病理过程发挥重要作用[15-16]。因此我们进一步检测了FAS小鼠脑组织中p53及其下游凋亡基因Bax的表达。我们结果提示p53-Bax通路的上调可能是FAS小鼠脑组织神经元细胞凋亡的重要发生机制。
为了进一步验证miR125b-p53-Bax通路在FAS神经系统发育中的重要作用,我们进一步设计了细胞学实验,通过过表达miR125b以期明确其对神经元细胞凋亡的重要调控作用。本研究结果发现过表达miR125b后,神经细胞中p53及Bax表达均有明显下降,明确了miR125b-p53-Bax通路在FAS神经元细胞凋亡发生中的重要作用。另一方面,鉴于microRNA类小分子可通过胎盘[17],现已有多个研究提示microRNA可作为诸多疾病的诊断标志物[18-21]。因此我们的研究同时为FAS提供了潜在预警标志物及可能的干预靶点。
综上所述,我们首次发现了FAS模型小鼠脑组织中存在miR125b表达下调,而其下调直接影响p53-Bax通路所介导的神经细胞凋亡。但miR125b下游靶基因众多,其是否可对其他通路基因产生影响,进而促进FAS中神经系统发育异常的发生有待进一步探讨。

