锂离子电池补锂技术
田孟羽,詹元杰,闫 勇,黄学杰
(1中国科学院物理研究所,北京100190;2松山湖材料实验室,广州 深圳523808)
1 补锂技术背景
近年来,便携式电子产品、新能源汽车、智能电网、分布式储能、物联网等快速发展,不断对锂离子电池各项性能提出更高要求,其中电池能量密度的提升最为迫切。在现有锂离子电池体系下,一方面,通过优化电池结构可提升能量密度,如CTP技术、刀片电池技术等;另一方面,通过正负极材料迭代,如正极使用高镍三元、高电压镍锰材料,负极使用高容量硅、锡基合金负极,可以实现电池能量密度大幅度提升。此外锂离子电池补锂技术也是提升电池能量密度的一个重要手段,锂离子电池化成过程中在负极表面SEI生长会消耗活性锂,导致电池能量损失,通过补锂技术可补偿活性锂,达到提升锂离子电池能量密度的效果。目前使用最广泛的石墨负极的不可逆容量损失大于6%,而对于具有高比容量的硅基和锡基合金负极,不可逆容量损失甚至高达10%~20%以上,配合补锂技术,能够改善低首效的短板,充分发挥其高容量的优势。补锂技术将促进新型负极材料产业化进程,进一步提升电池能量密度并延长循环寿命,极大促进锂离子电池的发展。
锂离子电池补锂技术过去一直被广泛研究,按技术路线可分为负极补锂和正极补锂两类。负极补锂技术研究开发时间较早,包括基于金属锂的物理混合补锂、自放电锂化、化学补锂、电化学锂化的多种补锂方式,其中基于金属锂的补锂技术较为成熟。美国FMC 公司最早开发出稳定化锂金属粉SLMP产品,通过喷洒或匀浆加入等工艺加入到负极之中实现补锂。锂箔补锂相比锂粉安全性有所提升,将金属锂箔碾压至几微米的厚度,然后与负极复合、碾压。电池在注液后这些金属锂迅速与负极反应,嵌入负极材料之中,从而提升材料的首周效率。这种补锂方式简单高效,但受制于金属锂自身的安全风险和工艺难度,负极补锂技术仍无法大规模应用。
近年来正极补锂技术开始受到人们的关注和研究。正极补锂通过在锂离子电池正极中添加补锂材料,电池充电过程中补锂材料分解释放活性锂,弥补负极SEI生长造成的不可逆活性锂损失。正极补锂材料拥有化学性质较为稳定、易于合成、价格低廉及具有较高补锂能力等优点,同时正极补锂工艺能够较好地兼容现有锂离子电池制作工艺,为补锂技术实现商业化应用提供了一种新的解决思路。
开发高安全性、低成本补锂技术,提升锂离子电池能量密度和循环寿命,对锂离子电池的发展至关重要。在补锂技术发展的带动下,2021 年“掺硅补锂”技术有望在高端电动汽车动力电池上得到应用,补锂技术规模化应用的落地也将带动锂离子电池相关材料、制造、设备等多个环节的协同推进,促进锂离子电池产业发展。
2 补锂技术分类
2.1 负极补锂
负极补锂即在负极中引入活性锂,用于补偿其因SEI生长引起的容量损失。负极补锂在较早的时候就受到了研究人员的广泛关注,负极补锂的主要方法有物理混合、化学锂化、自放电机制锂化和电化学锂化等。
2.1.1 物理混合锂化
早期,研究人员直接将锂片压在负极片的表面,用于补偿活性锂损失,同时提高其首周库仑效率和循环寿命。在2003 年,Kulova 等[1]直接将锂片压在石墨负极的表面,用于补偿其容量损失,指出不可逆容量损失的减少取决于金属锂和石墨的质量比,后续他们采用同样的方法补偿了非晶Si的容量损失[2-3]。Sun 等[4]同样将锂片压在硬碳负极的表面,并与LiCoO2组成全电池,其容量不仅得到了恢复,且其首周库仑效率从52%提高至86%。2019 年同济大学Xu 等[5]报道了一种可实现批量化应用的卷对卷负极极片预锂化方法(图1),将金属Sn 箔与金属锂箔卷对卷辊压,金属锂在机械力作用下与Sn箔表面层发生合金化反应形成LixSn,此预锂化Sn 箔在空气中保持了较好的稳定性,正常环境暴露48 h 预锂化锡箔表面轻微变色,79%湿度空气下暴露12 h预锂化锡箔仍然能保持初始容量的90%。预锂化Sn箔组装LFP|Sn电池首周库仑效率达到94%,可稳定循环200周。此补锂方法同样适用于Al箔和常规硅碳负极极片。
为了得到更好的电化学活性和更均匀的混合,研究人员使用锂粉替代锂片用于补锂,具有更好的效果,但因锂粉具有较高的比表面积,活性较高,研究人员致力于在其表面加上稳定的保护层,阻止其不良的副反应。滴乳液技术是合成稳定锂粉非常有效的方法[6-9],其原理如图2 所示。Kim 等[9]使用滴乳液技术在锂粉的表面包覆了一层稳定层,该稳定层的成分为碳酸锂和氟化锂,结果表明含该稳定层的锂粉不仅可以提高锂负极的循环寿命,且可以有效抑制锂枝晶的形成。
稳定金属锂粉SLMP(stabilized lithium metal powder)是由FMC公司生产的一款商业产品,其具有核壳结构,由97%的锂和3%碳酸锂包覆层组成[10]。该碳酸锂保护层均匀包覆在锂粉的表面,可阻止锂粉的不良副反应,使SLMP在干燥的环境中就可以使用,而不必在惰性气氛下[11]。SLMP 具有高达3600 mA·h/g的比容量,将其用于负极补锂不仅可以提高锂离子电池的容量,且可以提高其首周库容效率和循环寿命[12],如图3所示。
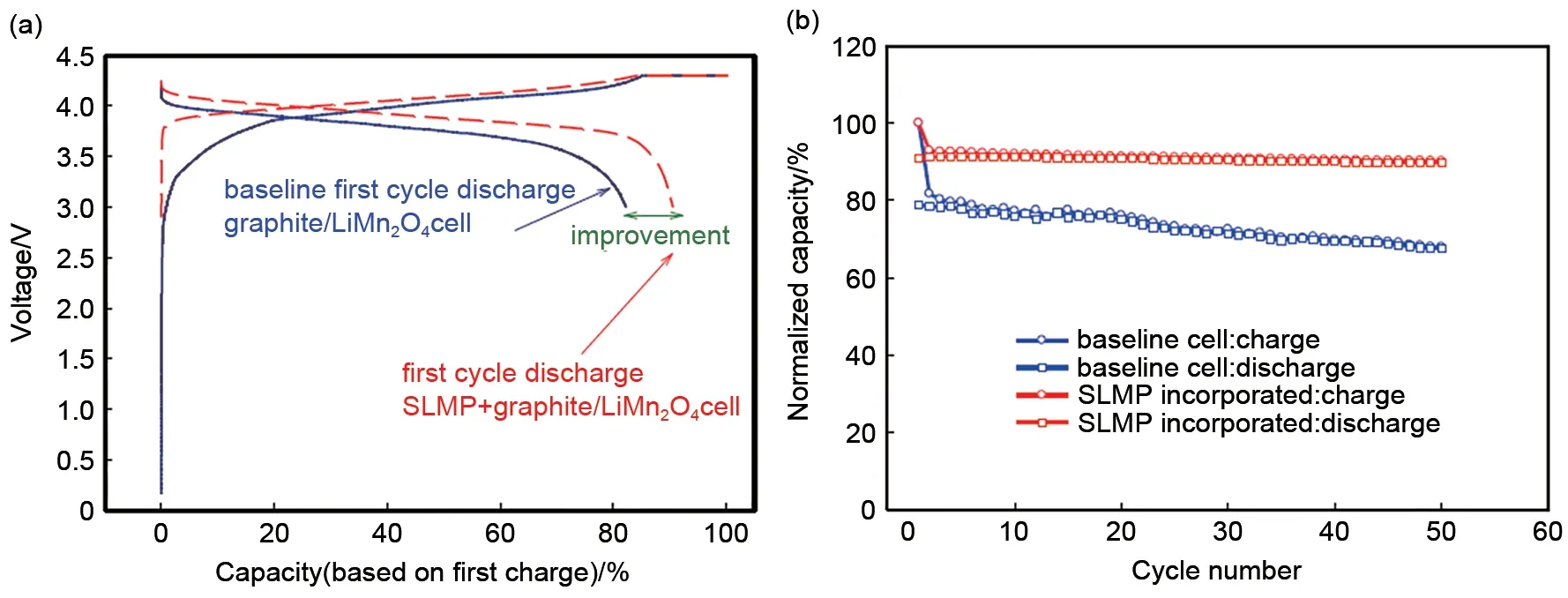
图3 经SLMP补锂后的石墨/LiMn2O4全电池的首周充放电曲线(a)及其循环性能(b)[12]Fig.3 (a)initial voltage profile of graphite/LiMn2O4full cell by using SLMP and(b)corresponding cycling performance[12]
基于金属锂箔或金属锂粉的负极补锂技术经过较长时间的研究,形成了初步的补锂产品和技术,并开始了小范围验证,但至今尚未在商品化锂离子电池中规模应用,究其原因主要在于金属锂自身的安全风险较高,给电池生产和使用过程带来不可控风险。
2.1.2 化学锂化
化学锂化同样是一种较好的嵌锂方法,尤其对于插层式化合物电极,效果显著,其用于嵌锂的物质一般为正丁基锂的己烷溶液或是碘化锂的乙腈溶液[13-17]。Cheah 等[13]使用正丁基锂化学锂化V2O5,研究其嵌锂后的电化学性能,并与Li4Ti5O12组装成全电池,获得了较好的循环性能。Cocciantelli 等[14]使 用LiI 化 学 锂 化V2O5得 到δ-Li0.95V2O5,并研究了其电化学行为。Scott 等[18]使用正丁基锂长时间处理碳基负极,结果表明经长时间处理后,在碳基负极的表面形成稳定的SEI层,显示了优异的电化学性能。除此之外,MoO2和FeSe2等过渡金属氧化物和硫化物均有被报道使用化学法进行锂化[15,19-20]。
化学锂化方法中使用的锂化剂一般具有一定毒性和危险性,导致化学锂化环境风险和安全风险较大,目前多用于基础研究,暂不具备商业化应用的可行性。
2.1.3 自放电锂化

图4 自放电机制嵌锂原理[21]Fig.4 Schematic of self-discharge lithiation[21]
自放电机制锂化是在有电解液的情况下,将负极与锂片直接接触,经自发的热力学反应嵌锂。自放电机制嵌锂不会改变活性物质的形貌特征,可用于研究形貌与电化学性能之间的关系。Liu等[21]在有电解液及微小压力的情况下,直接将Si负极和金属锂片接触在一起,经20 min,可自发嵌入2000 mA·h/g的容量,其原理如图4所示。Chae等[22]同样使用自放电机制预嵌锂Si,并与Li[Ni0.75Co0.1Mn0.15]O2组装成全电池,取得了优异的电化学性能。同样的,Sn-C的自放电机制嵌锂也得到大量的研究,并与各种正极组装成全电池,如Li[Ni0.45Co0.1Mn1.45]O4[23]、Li[Li0.2Ni0.4/3Co0.4/3Mn1.6/3]O2[22]和LiFePO4[24-25]等。除此之外,自放电机制嵌锂还可用于其他负极材料,如C/MoS2[26]、MnO[27]和Fe3O4[28-29]等。
2.1.4 电化学锂化
电化学预锂化(electrochemical prelithiation)是一种常见的用于锂离子电池负极极片的预锂化方法,在现有锂离子电化学体系中,通过引入金属锂与负极组成对电极,控制电化学充放电深度即可完成负极极片预锂化。电化学预锂化按照实施方法可以分为非原位和原位电化学预锂化。
如图5 所示[30],图5(a)展示了文献中报道的常规非原位电化学预锂化过程,先将需要预锂化的负极极片与金属锂组装半电池,经过特定充放电循环之后,负极片达到设定预锂化水平,之后将预锂化的负极片与新的正极极片组装成电池。Aurbach等[31-33]使用电化学嵌锂的方法预处理非晶Si 柱薄膜电极,在其表面形成稳定的钝化层,再将其分别与TiS2[31]、LiNi0.5Mn1.5O4[32]和S[33]组装成全池,并取得了优异的电化学性能。Derrien 等[34]将LiNi0.5Mn1.5O4|Li半电池充电至5 V,同时将Sn-C|Li 半电池预循环20周,并放电至0.01 V,再将两者组装成全电池,经测试其不可逆容量得到了消除,且获得了较为优异的循环性能。Verrelli 等[35-36]合成一系列氧化物与MCMB的复合物,同时采用电化学嵌锂的方法对其进行预嵌锂处理,并组装全电池,使其不可逆容量损失得到了消除。

图5 电化学预锂化[30]Fig.5 Schematic graphs of four types of typical pre-lithiation methods[30]
通过非原位电化学锂化方法可以便捷地控制负极预锂化深度,达到弥补负极SEI生长造成的活性锂损失目的,为科学研究提供了一种比较便捷的易于实现的负极锂化方法,但是非原位电化学锂化需要拆解电池后重复组装,操作复杂,不具备工业化应用价值。
为简化非原位电化学锂化方法中拆解、重新组装电池的过程,研究者们逐步开发了原位电化学锂化方法。如图5(b)所示,原位电化学锂化方法需要对锂离子电池进行重新设计,在组装过程中预先添加金属锂作为第三极,将负极与金属电极作为对电极进行放电,即可实现对负极原位补锂。Sun等[37]2014年报道了一种基于原位电化学补锂的单层电池设计,如图6 所示,在(活性炭+NCM)|硬碳单层电池的基础上增加了金属锂电极,首先将硬碳负极与金属锂电极作为对电极进行放电为硬碳负极补锂,之后活性炭+NCM正极与补锂硬碳负极组成电化学体系进行充放电工作。在单层电池的基础上,日本神奈川大学Tsuda 等[38-39]开发了多层软包电池原位电化学补锂技术,如图6所示,在叠片软包电池最外侧叠加一层金属锂电极,同时对正极和负极极片进行打孔处理,使得负极与金属锂电极作为对电极进行电化学预锂化的过程中锂离子可以穿透正负极极片,逐渐向远离金属锂电极的负极极片进行扩散,将所有负极极片全部预锂化。此工艺对电极结构设计要求较高,要实现所有负极片均匀预锂化,需要使用足够小的电流经过较长时间完成补锂过程,同时要确保打孔的正极与负极极片具有较好的锂离子扩散通道。

图6 (a)单层原位电化学补锂电池[37];(b)多层多孔电极原位补锂电池[38]Fig.6 (a)schematic structure of three-electrode lithium-ion hybrid capacitor[37];(b)schematic of a cell in pre-lithiation reaction with porous graphite[38]
2.2 正极补锂技术
相较于流程复杂安全性低,且工艺要求较高的负极补锂,正极补锂材料可以直接在正极浆料的匀浆过程中添加,无需额外的工艺改进且成本较低,因而更加适合现在的锂离子电池制造工艺,被誉为最有前景的补锂技术。早在2010 年,Armand[40]就曾指出,叠氮化物、碳氧化合物以及二羧基酸盐等可以用作正极补锂材料,并对每类材料做了系统性分析,指出了其理论容量和电压窗口,结果(图7)显示Li3N、Li2C4O4、Li2C2O4、Li2C3O5和Li2C4O6的分解电位较低(<4.6 V),适用于现有的碳酸酯电解液以及传统的正极材料中,有望作为牺牲锂盐用于补偿锂离子的不可逆容量损失。近年来对正极补锂材料的应用还处于研究阶段,并未出现一种稳定可靠的产品。
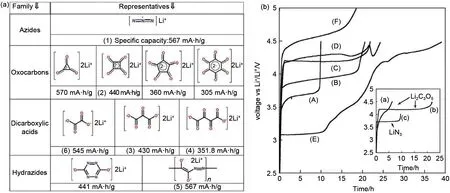
图7 (a)4类典型的可用做牺牲锂盐的分子式及其理论比容量;(b)LiN3(1)、Li2C4O4(2)、Li2C3O5(3)、Li2C4O6(4)、[COCON(Li)N(Li)]n(5)和Li2C2O4(6)的充放电曲线[40]Fig.7 (a)structural formula and specific capacity of compounds corresponding to 4“sacrificial salt”families;(b)initial voltage profile of LiN3(1),Li2C4O4(2),Li2C3O5(3),Li2C4O6(4),[COCON(Li)N(Li)]n(5)and Li2C2O4(6)[40]
从应用的角度来讲,完美的正极补锂材料需满足以下4点基本要求:①正极补锂材料的不可逆脱锂过程应处于正极的工作电压范围内,即其脱锂电位低于正极材料的电压上限,嵌锂电位低于正极材料的电压下限;②补锂材料应展现出足够高的比能量和体积能量密度,通常不可逆容量大于350 mA·h/g以满足高效的预锂化;③正极补锂材料应与现在通用的制作工艺和电池体系相兼容,在极片制作时与NMP、黏结剂等不反应,在循环过程中与电解液无不良副反应,首周循环后其分解产物不影响电池循环;④正极补锂材料具有良好的环境稳定性,在空气或较干燥的环境下能够保持稳定。
通常来讲,正极补锂材料可以分为以下3 类:第1 类是二元含锂化合物,如Li2O、Li2O2、LiF、Li2S、Li3N 等,其表面通常进行碳包覆处理,或搭配金属纳米颗粒使用,以催化补锂材料活性释放锂离子;第2 类是三元含锂化合物,如Li4FeO5、Li6CoO4、Li2NiO2、Li5ReO6、Li2RuO3、Li2MnO3、Li2MoO3、Li0.65Ni1.35O2等;第3 类是有机锂盐,如Li2DHBN、Li2C2O4等。
2.2.1 二元含锂化合物
Sun 等[41]在高温惰性气氛下将熔融的金属锂与金属氧化物混合,通过转化反应:MxOy+2yLi→xM+yLi2O(M 通常为金属Fe、Co、Ni、Mn 等)原位生成一系列Li2O与金属纳米颗粒的复合材料,其不可逆容量通常大于700 mA·h/g,如Co/Li2O(摩尔比为3∶4)容量为724 mA·h/g、2695 mA·h/cm3,Fe/Li2O(摩尔比为2∶3)容量为799 mA·h/g、2735 mA·h/cm3,Mn/Li2O( 摩 尔 比 为1∶2) 容 量 为935 mA·h/g、2891 mA·h/cm3,他们发现只有当金属纳米颗粒的尺寸足够小时才能发挥活性,微米尺度的金属颗粒与Li2O接触不充分,在4.1 V下仅能提供小于100 mA·h/g的容量。磷酸铁锂-石墨的参比全电池仅有120 mA·h/g的可逆循环容量,添加了4.8%Co/Li2O的全电池可逆循环容量为133 mA·h/g(有11%的提升),且循环性能也得到了改善。Du等[42]将FeOF与熔融金属锂反应(FeOF+3Li→Li2O+LiF+Fe)制得Fe/LiF/Li2O 复合结构,这种复合结构结合了M/LiF的环境稳定性与M/Li2O 低平台高容量的优势(M 为金属纳米颗粒),在4.3 V下仍有高达527 mA·h/g不可逆容量,且该结构在空气、NMP、电解液中均有良好的稳定性。与未添加补锂材料的Ni0.8Co0.1Mn0.1O2|SiO-石墨全电池相比,添加4.8% Fe/LiF/Li2O 的Ni0.8Co0.1Mn0.1O2|SiO-石墨全电池在0.5 C下循环100周后容量为144.7 mA·h/g,容量高出15%。
与Li2O类似,Li2O2也可作为正极补锂材料,其完全脱锂时,生成氧气,对应于高达1167 mA·h/g的理论比容量,可作为牺牲锂盐,用于补偿锂离子电池的不可逆容量损失,然而过氧化锂的电化学活性较低,需要一个较高的分解电位,故需要催化剂来降低其分解电位。Bie 等[43]将Li2O2与高能球磨6 h 后的NCM 颗粒按照5∶1 的比例复合,结果Li2O2/NCM-6h 在4.6 V 下展现出1154.2 mA·h/g 的高比容量,Li2O2仅为171 mA·h/g,NCM-6h 有效的催化了Li2O2的分解。添加2% Li2O2/NCM-6h 的NCM|SiO 全电池展现出172.9 mA·h/g 的高可逆容量,比原始的NCM|SiO全电池(143.7 mA·h/g)高出15%。我们也研究了Li2O2在充当正极补锂材料方面的应用[44],通过H2O2+2LiOH·H2O→Li2O2+4 H2O合成了Li2O2。图8(a)、(b)为合成的过氧化锂的SEM 结果。从中可看出,合成过氧化锂为米粒状的颗粒,其颗粒较小,仅100~200 nm。我们以5% LiNi0.5Mn1.5O4作为催化剂,降低过氧化锂的分解电压。图4(c)为Li2O2和Li2O2(LNMO)的首周充放电曲线,从中可以看出,Li2O2的首周分解电压高达约4.8 V,且充电比容量仅559 mA·h/g,而以5%LiNi0.5Mn1.5O4为添加剂的Li2O2(LNMO)的分解电位有显著的降低,充电至4.9 V 时,其首周充电比容量高达1050 mA·h/g。

图8 (a)~(b)Li2O2的SEM结果;(c)Li2O2和Li2O2(LNMO)的首周充放电曲线Fig.8 (a)~(b)SEM images of Li2O2;(c)voltage profiles of Li2O2 and Li2O2(LNMO)
将Li2O2(LNMO)的浆料直接涂覆于LiNi0.5Mn1.5O4的极片表面,并用做半电池测试。图9(a)为LiNi0.5Mn1.5O4和LiNi0.5Mn1.5O4(Li2O2)半电池的首周充放电曲线。经Li2O2补锂后,首周充电比容量高达约230 mA·h/g,多出了约91 mA·h/g,相当于过氧化锂释放出了1100 mA·h/g 的容量。图9(b)为LiNi0.5Mn1.5O4和LiNi0.5Mn1.5O4(Li2O2)半电池在0.2 C的循环性能对比,相比于未补锂的,经Li2O2补锂后的容量在100周内的容量衰减要快一些,这可能是因为Li2O2分解产生的氧气导致了性能的恶化。在电池制造的过程中,产生的氧气经首周循环后,从安全气阀放出。

图9 LiNi0.5Mn1.5O4和LiNi0.5Mn1.5O4(Li2O2)半电池的首周充放电曲线((a)及其循环性能(b)[44]Fig.9 (a)Voltage profiles of LiNi0.5Mn1.5O4and LiNi0.5Mn1.5O4(Li2O2)half cells and(b)corrsponding cycling performance[44]
LiF的理论容量为1030.8 mA·h/g,但LiF导电性较差且热力学稳定性较高,在大多数正极材料的电压窗口范围内较难分解,且分解后产生的F2会对电池造成不良的影响,需要使用适当的催化剂以促进其活性锂的释放。Sun 等[45]通过转化反应合成了Co/LiF、Fe/LiF等复合材料,在首周充电过程中Co+3LiF→CoF3+3Li++3e−,降低LiF分解电位的同时解决了产气问题,Co/LiF 在2.5~4.2 V 范围内展现出516 mA·h/g 的高不可逆容量,添加4.8%Co/LiF 的磷酸铁锂半电池展现出197 mA·h/g首周充电容量,比原始的磷酸铁锂半电池(164 mA·h/g)高出20.1%。
Li3N是离子导体材料,其α相(空间群:P 6/mmm)常温下的离子电导率约为10−3S/cm。Li3N 是热力学不稳定的,其分解电位较低,仅略高于0.44 V(vs. Li/Li+),脱出3 个Li+时,对应于理论比容量高达2308.5 mA·h/g,故Li3N 是一种非常好的可用于补偿不可逆容量损失的正极补锂材料。Yersak等[46]以Li3N/TiS2为正极,Li2S∶P2S5(8∶2)为固体电解质及In为负极组装全固态全电池,利用Li3N在首周充电的过程中分解产生的活性锂来提供锂源,研究Li/Ti的比例对电化学性能的影响,结果显示当比例为3 时具有较高的容量和循环性能。Park 等[47]也提出使用Li3N 作为正极添加剂,充电至4.2 V 时,Li3N释放出了1399.3 mA·h/g 的比容量,在仅添加2%Li3N情况下,LiCoO2|石墨-SiOx|C@Si全电池的不可逆容量损失就得到了恢复。
Li2S是S的嵌锂态,其完全脱锂时,对应于理论比容量高达1167 mA·h/g,分解产物为S,由于多硫离子的穿梭效应不适合作为主材,但却适合作为正极补锂材料使用。Sun等[48]通过惰性气氛下的转化反应合成了Co/Li2S 的纳米复合结构,在首周分解过程中xM+yLi2S→MxSy+2yLi++2ye−(M 为金属),降低分解电位的同时,避免了分解产物S 与碳酸酯电解液不兼容的问题,同时该结构在环境中具有较好的稳定性,其分解电位低于3 V,且具有670 mA·h/g的高不可逆容量。添加4.8%Co/Li2S的磷酸铁锂半电池首周充电容量为204 mA·h/g,比原始的磷酸铁锂半电池(164 mA·h/g)高出40 mA·h/g,且在循环过程中展现出较好的循环稳定性。为了探究Li2S作为正极补锂材料的作用,我们在Li2S的表面进行了碳包覆[49],制得了Li2S/KB复合纳米颗粒,并结合乙醇和PVP 将其配成补锂浆料,该补锂材料在碳酸酯基电解液中,在2.5~3.6 V的电位区间内具有高达1053 mA·h/g的补锂容量,该电位基本适用于所有的传统的锂离子电池。将补锂浆料直接涂覆于正极LiFePO4极片的表面,并与Si-C复合负极组装成全电池,经核壳结构Li2S/KB 补锂后,LiFePO4(Li2S)|Si-C 全电池的首周约20%的不可逆容量损失全部得到了恢复,且其拥有非常优异的循环性能和倍率性能,200 周后其放电比容量仍有150 mA·h/g,近100%的容量保持率,且在0.2、0.5、1和2 C下放电比容量分别为150、138、122和109 mA·h/g。相比于未补锂的其能量密度有明显的提高,在第1周、第10周、第100周和第200周分别有13.4%、26.7%、65%和110.2%的提升。同时经EIS 测试,经核壳结构的Li2S/KB 补锂后,其阻抗存在减小的现象,通过全电池拆解,将正负极极片重装为半电池,再分别测试其EIS,得知该阻抗减小来自于负极的影响,由XPS 分析可知,负极SEI的成分得到改善。如图10所示。

图10 (a)Li2S/KB样品的HRTEM图;(b)选择的(a)中一区域的高分辨图;(c)核壳结构的Li2S/KB的首周充放曲线[49]Fig.10 (a)HRTEM images of Li2S/KB;(b)enlarged region corresponding to black square in(a);(c)initial voltage profile of core-shell Li2S/KB half cell[49]
2.2.2 三元含锂化合物
三元含锂化合物通常是过渡金属氧化物锂盐,如Li6CoO4、Li5FeO4、Li2NiO2等,这类化合物通常含有两个或两个以上的锂离子,具有较高的不可逆容量,且在空气中具有较好的稳定性。Lim 等[50]将Li2O与CoO按照3∶1的摩尔比混合后,通过固相法在惰性气氛中700 ℃高温煅烧12 h得到了纯度较高的Li6CoO4粉末,在原位XRD 分析中,Li6CoO4作为正极的电池在4.3 V下释放出630.2 mA·h/g的容量,约对应于3.75个锂离子的脱嵌,是十分有潜力的正极补锂材料。Noh 等[51]使用Li6CoO4作为正极添加剂,用于LiCoO2|SiOx全电池中,使其首周不可逆容量损失得到了恢复,该正极添加剂可提供318 mA·h/g的补锂比容量。
Li5FeO4也可以写作5Li2O3·Fe2O3,其理论容量为870 mA·h/g, Johnson 等[52]将LiOH·H2O 与Fe2O3在惰性气氛下混合通过固相法高温煅烧得到了Li5FeO4,将其与锂片组成半电池,充至5 V,发现其在3.4~4 V 以及4 V 左右有两个明显的平台,两个过程约提供了690 mA·h/g 的容量,对应着4个锂离子的脱嵌,此时的结构为LiFeO2,该成分是个稳定结构很难继续分解。Su 等[53]使用Li5FeO4作为正极添加剂,补锂比容量约为700 mA·h/g,经Li5FeO4补锂后,LiCoO2/硬碳全电池的容量恢复了14%,且具有更为优异的循环性能。Park等[54]也对Li5FeO4进行了研究,发现其在2~4.7 V 下有670 mA·h/g的比容量。
Park 等[55]对Li2NiO2的性能进行了研究,发现Li2NiO2会在3.5 V(vs.Li/Li+)的状态下随晶态向非晶态的转变而分解,这远低于普通正极的充电电位(例如LiCoO2约为4.0 V),分解后的非晶相在第1 次充电时提供的去锂化能力高达>300 mA·h/g。易分解和首次脱锂能力高的共同特征表明,Li2NiO2是有前途的正添加剂。此外,由于较小的电荷转移电阻,当Li2NiO2以更快的速率分解时,容量增益(额外容量)较大。这表明当使用Li2NiO2作为正极补锂材料时,在第1 次充电时可以使用更高的电流。Kim等[56]在N2气氛下将纯Li2O和NiO的物理混合物在600 °C 的温度下焙烧10 h 制得Li2NiO2,并在其表面进行了Al2O3的包覆,在1.5~4.3 V 时其充放电容量为420 mA·h/g 和310 mA·h/g,显示不可逆的容量比为26%。但是,当放电截止电压增加到2.75 V 时,其放电容量降低至120 mA·h/g,对应不可逆容量比为71%。在LiCoO2|石墨全电池中仅添加4%即可补充首周形成SEI膜所消耗的锂离子,此外添加剂可防止12 V 过充电,从而防止电池爆炸,Li2NiO2分解会在过充电至12 V 的过程中消耗多余的电流,因此直到Li2NiO2完全分解后电压才会增加。
Park等[57]研究了一系列的过渡金属氧化物锂盐及其在锂离子电容器中的应用,他们用固相法将RuO2与Li2CO3合成了Li2RuO3,用热碳还原法还原Li2MoO4制得了Li2MoO3[58],在2.5~4.7 V 范 围 内0.1 C下进行充放电,发现Li2MoO3首周充放电容量分别为267.1、85.0 mA·h/g,Li2RuO3首周充放电容量分别为231.0、220.3 mA·h/g,第1 次充电期间从Li2MoO3电化学提取的大部分Li+都将用于负极的预锂化,而Li2RuO3将会对锂离子电容器电化学性能有积极作用。Jezowski 等[59]通过固相法使用Li2CO3和NiO 合 成 了Li0.65Ni1.35O2,Li0.65Ni1.35O2在4.2 V 下的不可逆充电容量约为120 mA·h/g,将Li0.65Ni1.35O2用于锂离子电容器的正极中对石墨负极进行预锂化,发现其1800 周后仍能保持稳定的循环。Jezowski 等[60]还发现Li5ReO6(LReO)在4.3 V下有410 mA·h/g的不可逆容量(接近423 mA·h/g的理论容量),添加于锂离子电容器的活性炭正极中对石墨负极进行补锂,锂离子电容器在2.2~4.1 V的电压范围内显示了出色的电容稳定性,最多可循环5000次。
2.2.3 有机含锂化合物
Jezowski等[61]合成了Li2DHBN,该有机锂盐脱锂电位低,3.5 V 下即可有活性锂离子脱出,且能提供365 mA·h/g 的不可逆容量,该正极补锂材料不包含任何其他金属元素,且可以容易地从相应的邻苯二酚母体结构获得,成本较低。
Solchenbach等[62]研究了Li2C2O4在高电压镍锰酸锂(LMNO)中的应用,他们通过电化学质谱证明了Li2C2O4在4.7 V 下 容 量 高 达525 mA·h/g,在LMNO|石墨全电池中分别添加质量分数为2.5%和5%的Li2C2O4,其首周充电容量分别有10%和20%的提升。我们也对Li2C2O4的补锂效果进行了探索[44],如图11(a)所示,Li2C2O4的电化学活性较低,其分解电位高达4.85 V,且其首周充电比容量仅约为200 mA·h/g。而以5%LiNi0.5Mn1.5O4作为催化剂的Li2C2O4(LNMO)的分解电位有明显的降低,分解电位为4.6 V,其首周的充电比容量高达505 mA·h/g,接近于其理论比容量545 mA·h/g。在放电过程中,二者均几乎没有容量,故草酸锂释放的活性锂可全部用于补偿锂离子电池的不可逆容量损失。后续,我们组装全电池进一步进行了验证,图11(b)为LiNi0.5Mn1.5O4|石墨和LiNi0.5Mn1.5O4(Li2C2O4)|石墨全电池的首周充放电曲线对比,从中可看出,LiNi0.5Mn1.5O4|石墨的首周充电比容量为136 mA·h/g,放电比容量为122 mA·h/g,约有10%的不可逆容量损失,而经草酸锂补锂后,LiNi0.5Mn1.5O4(Li2C2O4)|石墨全电池的首周充电比容量增加至195 mA·h/g,多出了约59 mA·h/g,该容量由草酸锂分解产生的活性锂提供,其放电比容量为130 mA·h/g,与半电池的容量一致,即其放电容量全部得到了恢复,这是因为负极SEI形成消耗的活性锂全部被草酸锂分解产生的活性锂所补偿。图11(b)为LiNi0.5Mn1.5O4|石墨和LiNi0.5Mn1.5O4(Li2C2O4)|石墨全电池的循环性能对比。从中可以看出,LiNi0.5Mn1.5O4|石墨全电池随着循环,容量有一定的衰减,其100周后的放电比容量仅约为102 mA·h/g,而经草酸锂补锂后,LiNi0.5Mn1.5O4(Li2C2O4)|石墨全电池在100周后放电比容量仍高达128.1 mA·h/g,容量保持率高达97.8%,相比于未补锂,容量有显著的提高。这是因为草酸锂分解产生的活性锂不仅补偿了首周因SEI形成消耗的活性锂,同时其后续循环过程中损耗的活性锂也得到了补偿,在提高全电池容量的同时,提高其循环性能。

图11 (a)Li2C2O4和Li2C2O4(LNMO)半电池的首周充放电曲线;(b)LiNi0.5Mn1.5O4和LiNi0.5Mn1.5O4(Li2C2O4)半电池的首周充放电曲线及其;(c)循环性能[44]Fig.11 (a)initial voltage profiles of Li2C2O4and Li2C2O4(LNMO)half cells;(b)initial voltage profiles of LiNi0.5Mn1.5O4 and LiNi0.5Mn1.5O4(Li2C2O4)half cells;(c)corresponding cycling performance[44]
2.3 小 结
综上所述,正极补锂和负极补锂为主的补锂技术已经得到了长足的进步与发展,科研人员提出了大量的补锂方案去补偿首周化成过程中负极SEI膜形成所消耗的活性锂。目前负极补锂的应用更为成熟和广泛,金属锂粉、锂箔等产品能量密度高,已经在产业线上得到广泛的应用,但负极补锂所应用的锂粉、锂箔等材料环境稳定性差、成本较高、与现有产线不兼容且产线改造成本较高,是补锂技术发展的过渡阶段,负极补锂技术的局限与工业生产对补锂技术的迫切需求产生了矛盾,一定程度上推动了正极补锂技术的发展,相较而言,正极补锂技术操作简便、成本较低且兼容性强,是未来补锂技术最有潜力的发展方向,受限于材料自身,目前并没有任何一种能够满足完美的正极补锂材料所能要求的4项基本条件的材料,因而正极补锂技术的应用还处于探索阶段。
3 总结及未来发展
锂离子电池补锂技术可补偿活性锂损失,是提升电池能量密度的一种有效方法,特别是针对新型高容量硅、锡基合金类负极材料体系,结合补锂技术可实现锂离子电池能量密度的跨越,并提升锂离子电池的循环寿命。
补锂技术经过近20 年发展,逐渐从科学研究走向产业应用。基于金属锂的负极补锂技术受到的关注和研究最多,其补锂容量高,补锂技术原理和工艺清晰,但受限于金属锂自身的安全风险,负极补锂技术在产业化应用中进展缓慢,未来研发重点将集中于如何克服补锂电池制造及使用过程中存在的安全风险。近年来,正极补锂技术作为一种新的锂离子电池补锂解决方案被提出,相比负极补锂,正极补锂在安全性、工艺便捷性上有明显优势,但还存在一些问题,如Li3N、Li2O等材料分解电位较低但稳定性差、易产气,影响电池性能带来安全隐患;Li5FeO4、Li6CoO4等材料不可逆容量较高,环境稳定性好,但分解产物增加电极质量且分解电压较高与大多数正极材料不兼容;Li0.65Ni1.35O2、Li2DHBN等材料分解电位较低,环境稳定性好,但其不可逆容量较低,补锂能力有限。正极补锂技术需要开发一种化学性质比较稳定、分解电位低、不产气、脱锂容量高、能不可逆嵌锂的正极补锂材料,同时兼容现有锂离子电池制造工艺。基于上述优势,正极补锂技术有望率先在现有锂离子电池体系中实现大规模应用,是目前补锂技术最有前景的发展方向。
在锂离子电池材料体系发展迟缓的背景下,通过补锂技术来弥补锂离子电池不足,突破能量密度和循环寿命的瓶颈,其将成为锂离子电池未来发展的一项关键技术,成为科学研究和技术开发的一大热点。补锂技术在锂离子电池中的成功应用能够提升电动汽车续航里程和寿命,推动汽车电动化,助力节能减排,早日达成碳中和目标。

